硫化法除鉬過程中雜質砷的行為
謝昊,趙中偉,曹才放,梁勇,李江濤
(1. 中南大學 冶金科學與工程學院,湖南 長沙,410083;2. 中南大學 稀有金屬與材料制備湖南省重點實驗室,湖南 長沙,410083)
隨著鎢礦資源的不斷開發和利用,優質鎢資源日益減少,處理品位低、雜質含量高的鎢礦已成為鎢冶金中一個很現實的問題。這些高雜質的鎢礦中,除了雜質元素鉬以外,砷的含量也日益增加。而隨著硬質合金、電子、國防等工業的發展,對鎢制品尤其是對許多尖端用途所需的鎢制品中的雜質含量要求越來越嚴格。在鎢冶金產品中,砷是需嚴格控制的雜質元素,如國標GB 10116—88中規定在APT-0級產品中,雜質砷的質量分數要小于10×10?6。鎢酸鈉溶液中凈化除砷的一些方法,有經典沉淀凈化法[1?2]、強堿性陰離子樹脂交換法[3]、離子交換法、離子浮選法和溶劑萃取法[4?5]等。但采用這些方法要么鎢損失較大,渣量大,要么流程冗長,設備復雜。選擇性沉淀法在鎢酸鹽溶液中除鉬已經被廣泛采用[6]。工業上應用這一新工藝時,一部分雜質砷也會在除鉬過程中除去,說明砷酸根也可能硫化成為了硫代砷酸鹽[7?8],進而也像硫代鉬酸根一樣被結合。進行雜質砷的硫化行為的研究對于進一步優化條件,提高砷的硫化轉化率及沉淀脫除率,從而實現鉬、砷的同時深度脫除具有重要意義。
1 熱力學計算及計算方法
在As-S-H2O體系中,存在表1所示的平衡關系式。所有數據均引自文獻[9]。其中:[H3AsSO3]表示H3AsSO3的濃度,mol/L。其余含義依此類推。
本研究需考慮同時存在3價砷化合物和5價砷化合物的溶液體系。因此,需要在3價砷和5價砷之間建立氧化還原的關系式。這里選擇如下的關系式(由于各含砷離子的活度系數參數尚無文獻報道,并且對高濃度溶液的熱力學計算尚無有效解決辦法,故在計算中均以濃度代替活度):

表1 25 ℃時As-S-H2O體系的平衡反應及其平衡常數Table 1 Equilibrium reactions and constants for As-S-H2O system at 25 ℃
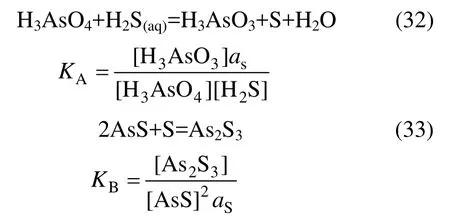
式中:KB=3.9。由式(33)得出 as= KB?1。由于式(32)中各組分的自由能已知,得到KA=14.47。
由(1)~(33)平衡關系式可以看出:溶液中游離的As和 S 的游離形態有
各含S溶解組分濃度總和等于總S濃度:

各含As溶解組分濃度總和等于總As濃度:
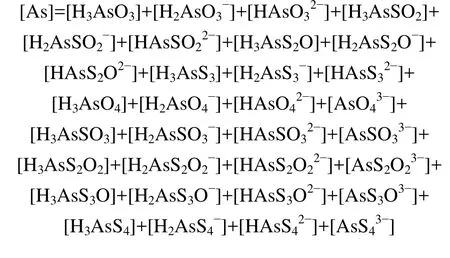
2 結果與討論
2.1 pH對硫化行為的影響
若給定砷、硫的濃度及體系的pH,聯立(32),(33)式以及表1中(1)~(31)的濃度關系式,可得到1個含有33個未知數的方程組,解這個方程組可得各含砷離子的濃度。
砷在低pH環境下,會形成As2S3的沉淀,存在溶解平衡;在高pH環境下,砷會形成各種含砷的離子。因此,需要分段計算。
除砷過程是在鎢酸鹽溶液中除鉬的情況下進行,因此,參考鎢鉬分離的常用工業條件,取[S]=0.15 mol/L[10],假定溶液中含[As]=0.0015 mol/L[11?12],考察各含砷離子分布隨pH變化的情況,結果見圖1。
從圖1可知:當pH為2~5時,溶液中砷的溶解度隨著pH的減小而減小;當pH=2時,溶液中總砷濃度僅為8.5×10?5mol/L,As2S3的沉淀率達到94.3%;在pH=4~6時,H2As是溶液中的主要離子;在pH>6時,溶液中5價砷的化合物 As成為溶液中最主要的陰離子,并且在pH=7~12時,As濃度曲線和總砷濃度曲線重合,As全部被硫化為As。
在工業上除鉬的條件下,從熱力學上分析,溶液中的砷可以被完全硫化形成AsS43?。
2.2 硫用量對砷硫化行為的影響
取總砷量[As]=0.0015 mo1/L,pH分別取7.5,8.5和 9.5,針對不同的硫用量[S]計算各含砷離子的平衡濃度分數,以考察硫加入量與砷硫化效果的關系,結果見圖2~4(圖中只列出了主要離子,其余離子由于含量過低而無法正常顯示)。圖2~4中:[As]表示As的濃度,mol/L;[As]T表示As的總濃度,mol/L。
由圖2~4可知:在溶液pH=7.5,硫用量[S]/[As]=4時(即理論用量),完全硫化的 As只占 90%,HAsS3O2?占 8.9%,這顯然不滿足要求;當硫用量[S]/[As]=6時,已可使99 %的砷以As的形式存在,這相當于溶液中游離硫離子的濃度約為0.003 mol/L;再進一步增加硫用量,對硫化的促進作用漸弱;當加大硫用量至[S]/[As]=20時,也只能使完全硫化率增至99.4%,此時,溶液中游離硫離子濃度約為23 mmol/L。
在溶液pH=8.5,硫用量[S]/[As]=4時,砷的完全硫化率為91.8%;當硫用量[S]/[As]=6時,砷的完全硫化率為99.6%。
在溶液pH=9.5,硫用量[S]/[As]=4時,砷的完全硫化率為 92%;當硫用量[S]/[As]=6時,砷的完全硫化率為99.6%。
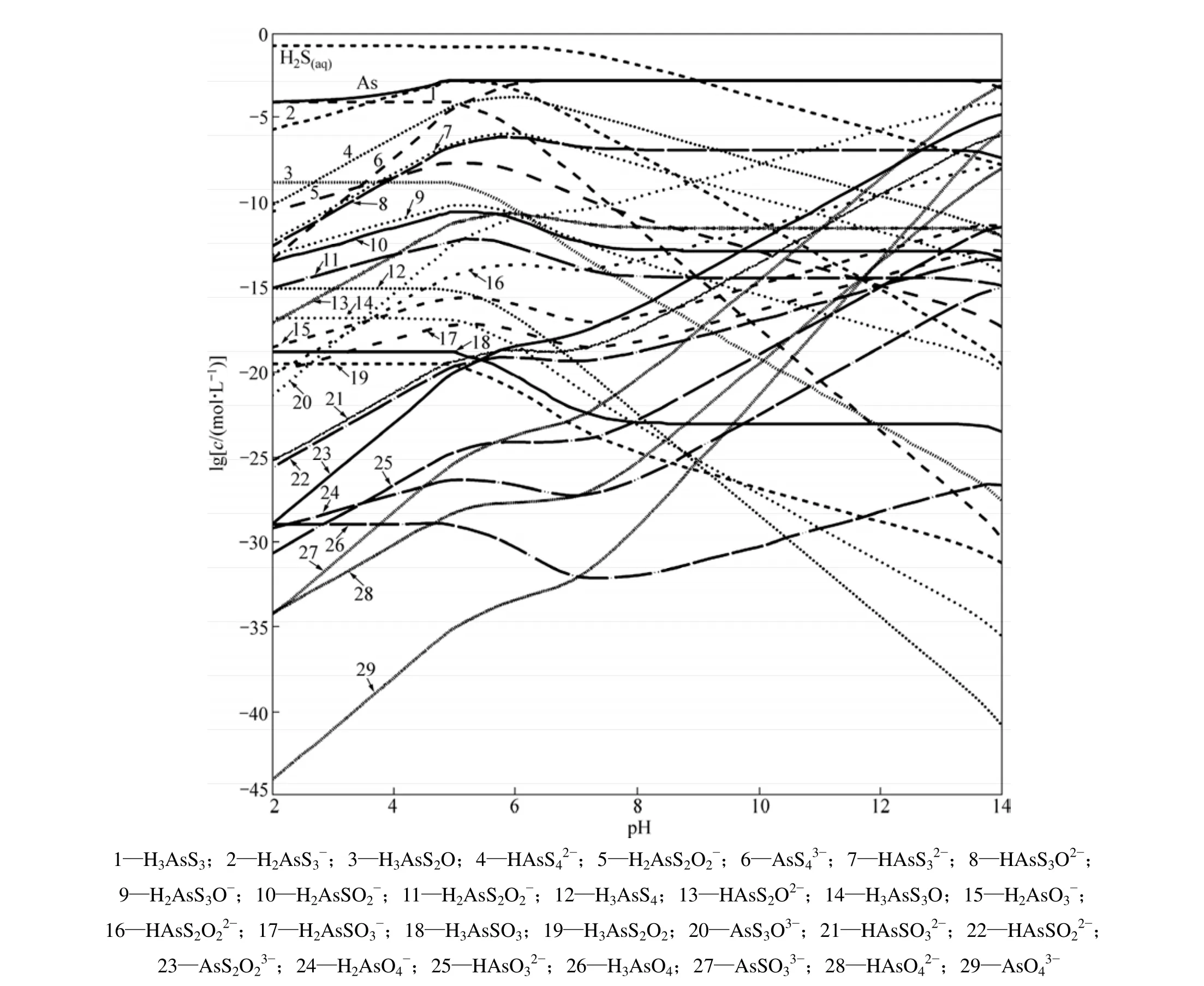
圖1 各含砷離子分布隨pH變化的分布曲線Fig.1 lgc?pH curves for different arsenic ions at 25 ℃
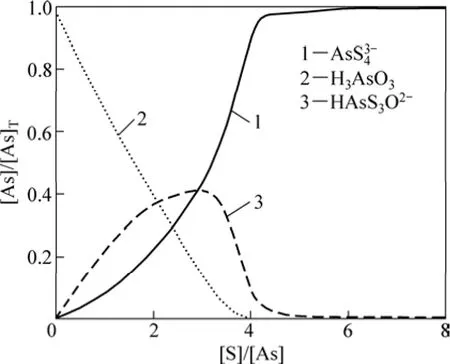
圖2 pH=7.5時硫濃度對硫化效果的影響Fig.2 Influences of sulfur dosage on effect of sulfidation at pH=7.5
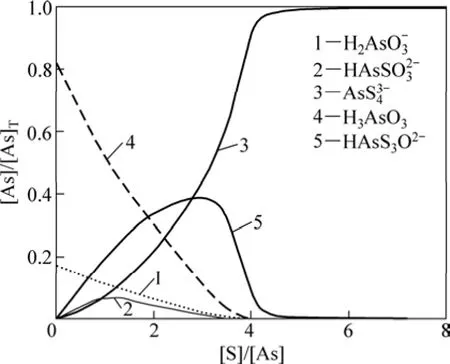
圖3 pH=8.5時硫濃度對硫化效果的影響Fig.3 Influences of sulfur dosage on effect of sulfidation at pH=8.5
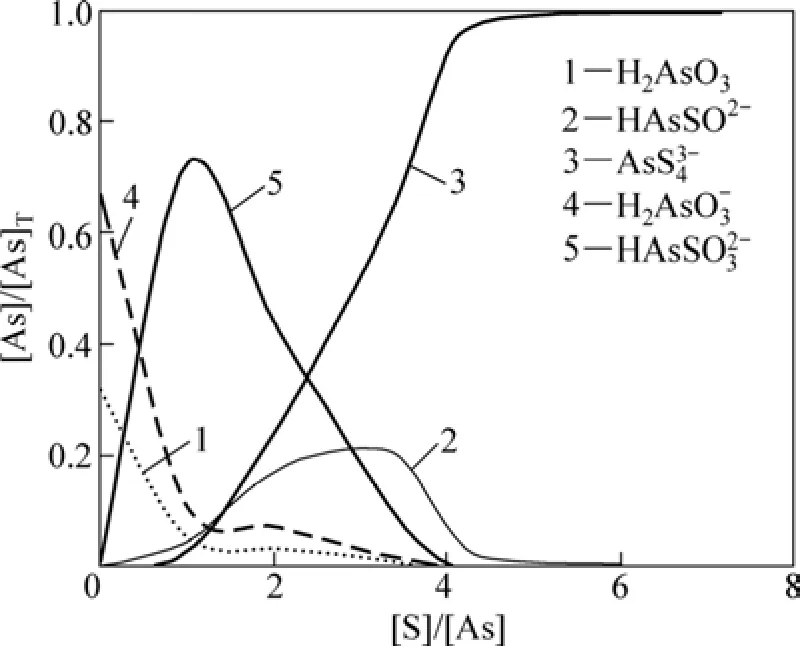
圖4 pH=9.5時硫濃度對硫化效果的影響Fig.4 Influences of sulfur dosage on effect of sulfidation at pH=9.5
3 結論
(1) 控制一定的條件,將溶液中的含砷化合物較徹底地硫化為As在熱力學上是完全可能的。
(2) 溶液的 pH是影響硫化效果的關鍵因素,As的硫化程度隨pH的增大有峰值。
(3) 砷的硫化程度隨硫用量的增加而增大,但當硫用量增加到一定程度后,進一步增加硫用量對硫化的促進作用并不顯著;在溶液 pH減小時,為了取得較好的硫化效果,需相應地增加硫化劑的用量。
(4) 在 pH=7.5~9.5范圍內,在硫用量[S]/[As]>6時,可使99%以上的As硫化為As。
[1]李洪桂. 稀有金屬冶金學[M]. 北京: 冶金工業出版社, 1990:55?56.LI Hong-gui. Rare metals metallurgy[M]. Beijing: Metallurgical Industry Press, 1990: 55?56.
[2]李洪桂. 有色金屬提取冶金手冊:稀有高熔點金屬: 上卷(W,Mo, Re, Ti)[M]. 北京: 冶金工業出版社, 1999:118?119.LI Hong-gui. Non-ferrous metal extraction metallurgy handbook:Rare refractory metals: Vol. 1(W, Mo, Re, Ti)[M]. Beijing:Metallurgical Industry Press, 1999:118?119.
[3]陳洲溪, 黃芍英, 周良益, 等. 離子交換法分離鎢酸鹽溶液中的鉬: 中國, 881057126[P]. 1988?05?16.CHEN Zhou-xi, HUANG Shao-ying, ZHOU Liang-yi, et al.Removing molybdenum from tungstate solution by using ion exchange technics: CN 881057126[P]. 1988?05?16.
[4]黃蔚莊, 龔柏凡, 張啟修. 溶劑萃取硫代鉬酸鹽分離鎢鉬[J].中國有色金屬學報, 1995, 5(1): 45?47.HUANG Wei-zhuang, GONG Bai-fan, ZHANG Qi-xiu.Separation of Tungsten and molybdenum by solvent extraction with thio molybdate[J]. The Chinese Journal of Nonferrous Metals, 1995, 5(1): 45?47.
[5]Zheng Q Y, Fan H H. Separation of molybdenum from tungsten by di-2-ethylhexyl phosphoric acid ext reactant[J].Hydrometallurgy, 1986, 16(3): 263?270.
[6]孫培梅, 李洪桂, 李運姣, 等. 選擇性沉淀法從鎢酸鹽溶液中除鉬的工業試驗[J]. 中國有色金屬學報, 2001, 11(3): 499?502.SUN Pei-mei, LI Hong-gui, LI Yun-jiao, et al. Commercial scale test of selective precipitation method for Mo removal from tungstate solution[J]. The Chinese Journal of Nonferrous Metals,2001, 11(3): 499?502.
[7]肖若珀. 砷的提取、環保和應用方向[M]. 柳州: 廣西金屬學會出版社,1992: 58.XIAO Ruo-po. Extraction, environmental protection and application direction of arsenic[M]. Liuzhou: Guangxi Society for Metals Press, 1992: 58.
[8]張啟修, 肖連生, 龔柏凡. 一步離子交換法生產 APT新工藝的沿革與現狀[J]. 中國鎢業, 2000, 15(1): 24?25.ZHANG Qi-xiu, XIAO Lian-sheng, GONG Bai-fan. The developmental curse and status of producing APT with oe-step in a change process[J]. China Tungsten Industry, 2000, 15(1):24?25.
[9]Helz G R, Tossell J A. Thermodynamic model for arsenic speciation in sulfidic waters: A novel use of ab initio computations[J]. Geochimica et Cosmochimica Acta, 2008,72(18): 4457?4468.
[10]霍廣生, 趙中偉, 吳保林. 鉬的硫化反應熱力學分析[J]. 中南工業大學學報: 自然科學版, 2001, 32(3): 259?261.HUO Guang-sheng, ZHAO Zhong-wei, WU Bao-lin. Thermal dynamic analysis on sulfidation of molybdate[J]. Journal of Central South University of Technology: Natural Science, 2001,32(3): 259?261.
[11]孫培梅, 陳洲溪, 陳樹翹, 等. 用鎢細泥制取鎢酸鈉和仲鎢酸銨新工藝研究[J]. 中國鎢業, 1993(4): 10?15.SUN Pei-mei, CHEN Zhou-xi, CHEN Shu-qiao, et al. Study on new technology of producting sodium tungstate and APT with tungsten fine deposit[J]. China Tungsten Industry, 1993(4):10?15.
[12]劉茂盛, 孫培梅, 李運姣, 等. 關于鎢冶煉離子交換工藝除雜效果的探討[J]. 稀有金屬與硬質合金, 1990, 101: 8?15.LIU Mao-sheng, SUN Pei-mei, LI Yun-jiao, et al. Study ion exchange process on the tungsten smelting effects of impurities[J]. Rare Metals and Cemented Carbides, 1990, 101:8?15.
[13]盧江波, 趙中偉, 李洪桂. 鎢鉬的硫化反應熱力學分析[J]. 中國鎢業, 2005, 20(4): 33?38.LU Jiang-bo, ZHAO Zhong-wei, LI Hong-gui. Thermodynamic analysis on sulfidation of molybdate and tungstate[J]. China Tungsten Industry, 2005, 20(4): 33?38.

