水滑石負(fù)載的鈀納米粒子對水合肼的電催化氧化
金榮榮 李麗芳 徐雪峰 連英惠 趙 凡
(山東農(nóng)業(yè)大學(xué)化學(xué)與材料科學(xué)學(xué)院,山東泰安271018)
水滑石負(fù)載的鈀納米粒子對水合肼的電催化氧化
金榮榮 李麗芳*徐雪峰 連英惠 趙 凡
(山東農(nóng)業(yè)大學(xué)化學(xué)與材料科學(xué)學(xué)院,山東泰安271018)
利用共沉淀方法制備了載體水滑石(LDH),通過離子交換法將PdCl2-4插入水滑石層間,再用水合肼將其還原,制備得到了水滑石負(fù)載的分散狀鈀納米粒子(LDH-Pd0).利用X射線衍射(XRD)、透射電鏡(TEM)和X射線電子能譜(XPS)等手段對所得樣品進(jìn)行了表征,結(jié)果表明鈀納米粒子能很好地分散在水滑石上.將該納米材料修飾的玻碳電極(GCE)用于水合肼的電催化氧化,該修飾電極表現(xiàn)出很好的電化學(xué)催化活性.用循環(huán)伏安法(CV)、計(jì)時(shí)庫侖法(CC)和計(jì)時(shí)安培法(i-t)對修飾電極的催化活性、有效表面積和水合肼的催化氧化機(jī)理等進(jìn)行了研究.結(jié)果表明水合肼在-0.1 V附近有明顯的氧化峰,在1.0×10-5-2.0×10-4mol·L-1范圍內(nèi),陽極峰電流與水合肼濃度間有良好的線性關(guān)系,其檢測限為9.5×10-7mol·L-1.計(jì)算得到GCE,LDH-Pd0/GCE和LDH/GCE電極活化面積分別為0.02089,0.02762和0.02496 cm2.推知水合肼的氧化過程有4電子和4質(zhì)子參與,并且其在電極上的反應(yīng)是受擴(kuò)散控制的不可逆過程.
水滑石;鈀納米粒子;循環(huán)伏安;水合肼;修飾電極;電催化
1 引言
水合肼作為一種重要的精細(xì)化工原料已被廣泛應(yīng)用于醫(yī)藥、化工、軍事、航天等領(lǐng)域,并被用在推進(jìn)劑、水處理劑、農(nóng)藥、醫(yī)藥、燃料電池、光穩(wěn)定劑以及化工生產(chǎn)助劑等諸多方面.1由于水合肼也是一種神經(jīng)毒素,過量吸入可使細(xì)胞產(chǎn)生誘變效應(yīng),甚至致癌;在人體內(nèi)能與過氧化物酶反應(yīng)生成活性中間體,并造成種種不良作用,包括對DNA的損害等.2因此水合肼在使用中是一把雙刃劍,建立靈敏可靠,快捷簡便的檢測方法是人們掌控其應(yīng)用的措施.
目前對液體水合肼的測定方法有紫外-分光光譜法,3熒光分光光譜法,4流動(dòng)注射法,5氣相色譜-各檢測手段聯(lián)用法,6化學(xué)發(fā)光法,7化學(xué)滴定法8和電化學(xué)分析法9等.其中電化學(xué)分析以其檢測靈敏,操作簡便而越來越受到人們的青睞.但是在常規(guī)的玻碳電極上,水合肼的直接電化學(xué)氧化受到過電壓的限制,所以人們利用各種修飾物質(zhì)10-13來減小過電壓的影響,以達(dá)水合肼在修飾電極上電化學(xué)檢測的目的.
鈀納米粒子作為水合肼的一種高活性催化劑已引起人們的很大關(guān)注,14-18鈀納米粒子可以通過電沉積方法19-21和化學(xué)還原鈀鹽22-24合成,復(fù)合鈀納米粒子含有聚苯胺負(fù)載的Pd納米粒子14和碳納米管負(fù)載的Pd納米粒子.15但至目前為止,查閱的方法中都存在鈀納米粒子團(tuán)聚的現(xiàn)象.而高分散性和超高界面能是納米粒子高催化活性的保障,因此如何制備分散性良好的鈀納米粒子一直是人們關(guān)注的熱點(diǎn).
水滑石因具特殊層狀結(jié)構(gòu)、較大比表面積和層間陰離子的可交換性等特點(diǎn)而常被用作催化劑或催化劑載體.通過離子交換法將雜多陰離子引入類水滑石層間,得到雜多陰離子柱撐水滑石復(fù)相催化劑,不僅具有固載催化劑的優(yōu)點(diǎn),還具有潛在的選擇性催化和酸堿雙功能催化作用,因此水滑石負(fù)載的催化劑已引起人們的廣泛關(guān)注.
本文參考Choudary等25制備鈀納米粒子的方法,通過離子交換,將引入水滑石層間,再經(jīng)水合肼還原,得到了水滑石負(fù)載的分散性較好的鈀納米粒子.將該復(fù)合納米材料修飾的玻碳電極用于水合肼的電催化氧化,表現(xiàn)出了很好的催化活性,本文為探討水合肼的電催化氧化機(jī)理,實(shí)現(xiàn)水合肼的電化學(xué)檢測提供了重要依據(jù).
2 實(shí)驗(yàn)部分
2.1 儀器與試劑
CHI832a電化學(xué)工作站(上海辰華儀器有限公司);KQ-50B型超聲波清洗器(昆山市超聲儀器有限公司);JB-1型攪拌器(上海雷磁新涇儀器公司); pHS-3CT型酸度計(jì)(上海康儀儀器有限公司);D8 Advance X射線衍射儀(Bruker-Axs公司,德國);JEM-1011透射電子顯微鏡(日本電子,日本);ESCALAB 250.X射線光電子能譜(ThermoFisher Scientific,美國)使用條件為AlKα,0.60 eV,Ag 3d5/2峰;紅外干燥燈;三電極系統(tǒng):自制修飾電極為工作電極,飽和甘汞電極(SCE)為參比電極,鉑電極為對電極.
N2H4(50%)和Na2PdCl4(Aladdin,分析純);無水乙醇(天津市百世化工有限公司,分析純);K3[Fe(CN)6] (沈陽市試劑二廠,分析純);K4[Fe(CN)6](上海夢成化工有限公司,分析純);KCl(安徽蚌埠電化試劑廠,分析純);Mg(NO3)2·6H2O和Al(NO3)3·9H2O(天津市巴斯夫化工有限公司,分析純);NaOH(天津市永大化學(xué)試劑開發(fā)中心,分析純);實(shí)驗(yàn)用水均為二次重蒸水.
2.2 Mg-Al-NO3水滑石的制備
室溫下按n(Mg2+)/n(Al3+)=3:1的比例稱取一定量的Mg(NO3)2·6H2O和Al(NO3)3·9H2O配置成混合硝酸鹽溶液,總濃度為1 mol·L-1.劇烈攪拌下,將混合鹽溶液加入到1 mol·L-1的NaOH溶液中形成沉淀,n(OH-)/[2n(Mg2+)+3n(Al3+)]=1.1-1.2,反應(yīng)體系的最終pH值用1 mol·L-1的NaOH溶液調(diào)整為10.沉淀老化1 h后,抽濾、洗滌至中性,于80°C烘干得到Mg-Al-NO3水滑石.
2.3 電極修飾材料的制備
0.2775 g(0.0943 mmol)Na2PdCl4溶于100 mL二次重蒸水后,將2.0 g Mg-Al-NO3水滑石在氮?dú)獗Wo(hù)下分散于Na2PdCl4溶液中,磁力攪拌12 h.用500 mL二次重蒸水反復(fù)洗滌、抽濾,60°C真空干燥,即得到插層水滑石(LDH),記作LDH-PdCl24-.將1.0 g散在10 mL無水乙醇中,加入2.0 mL(20 mmol)50%的水合肼作為還原劑,室溫反應(yīng)3 h,抽濾,60°C真空干燥,即得到水滑石負(fù)載的鈀納米粒子,記作LDH-Pd0.
0.1388 g(0.04715 mmol)Na2PdCl4溶于10 mL無水乙醇中,加入2.0 mL(20 mmol)50%的水合肼作還原劑,室溫反應(yīng)3 h,抽濾,60°C真空干燥即得鈀粉末.將該粉末分散在100 mL二次重蒸水中,加入2.0 g Mg-Al-NO3水滑石振蕩吸附12 h,抽濾干燥,即得到水滑石直接吸附(或混合)的鈀納米材料,記作LDH@Pd0.
2.4 修飾電極的制備
工作電極為玻碳電極(GCE)(直徑d=3 mm),使用前用0.3 μm和0.05 μm的Al2O3粉拋光成鏡面,再分別用無水乙醇和二次重蒸水超聲洗滌3 min,經(jīng)二次重蒸水淋洗干凈.在10 mL二次重蒸水中加入20.0 mg所制催化劑,超聲分散1 h后,移取10 μL滴涂到玻碳電極表面,紅外燈下晾干(大約3 min)后得到工作電極.所有電化學(xué)測試均在室溫進(jìn)行.
3 結(jié)果與討論
3.1 X射線衍射、透射電鏡和X射線電子能譜的結(jié)果分析
LDH及通過離子交換制備的LDH-Pd0的X射線衍射(XRD)圖譜見圖1.由圖1可知,LDH在2θ為11.3°、22.5°、34.4°處的衍射峰分別對應(yīng)(003)、(006)、(009)晶面,26,27且峰形尖銳,表明合成的Mg-Al-LDH晶相單一,晶體結(jié)構(gòu)一致,結(jié)晶度較好,層間距大約為0.78 nm,在35°-50°之間兩個(gè)較強(qiáng)峰分別對應(yīng)于水滑石的(015)、(018)晶面.28LDH-Pd0與LDH衍射峰位置相似,但衍射峰強(qiáng)度減弱,說明鈀納米粒子的插層影響了水滑石的結(jié)晶度,但對其層狀結(jié)構(gòu)基本無影響(LDH-Pd0層間距大約為0.79 nm).由于LDH-Pd中的Pd0(111)、(200)處衍射峰分別與水滑石的(015)、(018)衍射峰位置相似,衍射峰疊加,所以造成圖1b中箭頭處的峰是展寬的.
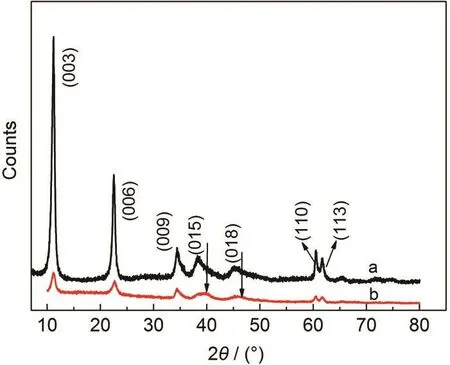
圖1 (a)LDH和(b)LDH-Pd0的XRD圖Fig.1 XRD patterns of(a)LDH and(b)LDH-Pd0
由圖2透射電鏡照片(TEM)可以看出,水滑石呈很好的片層結(jié)構(gòu).Pd0粒子負(fù)載在水滑石的片層上(見圖2b),粒徑約5-10 nm,分散較均勻,沒有很明顯的團(tuán)聚.說明利用水滑石層間陰離子的可交換性能,可用替代原水滑石層間的當(dāng)加入水合肼將還原后,Pd0納米粒子就被固定在水滑石層間,形成水滑石負(fù)載的分散性較好的Pd0納米粒子,從圖2c可以看出水滑石直接吸附的Pd0納米粒子在水滑石的片層上嚴(yán)重團(tuán)聚.
圖3為LDH-Pd0的X射線電子能譜(XPS)譜圖,從XPS譜圖可以看出在335 eV附近鈀的譜峰很明顯(以C 1s峰出現(xiàn)在284.9 eV處來校正),可以證明形成了Pd0.25
3.2 電化學(xué)性能的測試

圖2 (a)LDH,(b)LDH-Pd0及(c)LDH@Pd0的TEM照片F(xiàn)ig.2 TEM images of(a)LDH,(b)LDH-Pd0,and (c)LDH@Pd0Inset in figure b shows the particle size distribution.

圖3 LDH-Pd0的XPS圖譜Fig.3 XPS pattern of LDH-Pd0Insert shows the Pd 3d narrow-spectrum.
從圖4各電極的循環(huán)伏安圖可以看出,LDH-Pd0修飾的玻碳電極在空白溶液即不含水合肼的pH為 7.0的0.1 mol·L-1磷酸緩沖溶液(PBS)中,在-0.4-0.6 V的范圍內(nèi),沒有電化學(xué)反應(yīng),即對水合肼的檢測沒有干擾.在此范圍內(nèi)水合肼在裸電極和水滑石修飾的電極上沒有明顯的氧化還原峰,而在LDH-Pd0修飾的電極上在-0.1 V左右有很強(qiáng)的氧化峰,說明LDH-Pd0對水合肼有較強(qiáng)的催化活性.但在LDH@Pd0/GCE上也沒有出現(xiàn)水合肼的氧化峰,很可能就是因?yàn)橹苯游?或混合)的Pd0易于團(tuán)聚,失去了分散性好的Pd0納米粒子所具有的高效催化活性.圖5為LDH-Pd0/GCE在不同濃度水合肼磷酸緩沖溶液(0.1 mol·L-1,pH為7.0)中的循環(huán)伏安圖.可看出隨水合肼濃度增大,在-0.1 V附近的氧化峰電流逐漸增大,所以水滑石負(fù)載的鈀納米粒子修飾電極可用于水合肼的電化學(xué)檢測.

圖4 (a)GCE,(b)LDH/GCE,(c)LDH-Pd0/GCE和(d)LDH@Pd0/GCE在含1.0 mmol·L-1水合肼PBS溶液(0.1 mol·L-1,pH=7.0)中及(e)LDH-Pd0/GCE在PBS溶液(0.1 mol·L-1,pH=7.0)中的循環(huán)伏安圖Fig.4 Cyclic voltammograms of(a)GCE,(b)LDH/GCE, (c)LDH-Pd0/GCE,and(d)LDH@Pd0/GCE in PBS(0.1 mol·L-1,pH=7.0)containing 1.0 mmol·L-1N2H4and (e)LDH-Pd0/GCE in PBS(0.1 mol·L-1,pH=7.0) PBS:phosphate buffer solution

圖5 LDH-Pd0/GCE在不同濃度水合肼溶液中的循環(huán)伏安圖Fig.5 Cyclic voltammograms of LDH-Pd0/GCE with different concentrations of N2H4c(N2H4)/(mmol·L-1):(a)0.0,(b)1.0,(c)2.0,(d)3.0,(e)4.0, (f)5.0;scan rate(v):100 mV·s-1
3.3 pH值的影響

圖6 (A)LDH-Pd0/GCE在含有1.0mmol·L-1水合肼的不同pH的PBS(0.1mol·L-1)中的循環(huán)伏安圖(v=100mV·s-1); (B)不同pH的PBS(0.1 mol·L-1)對Ipa(a)和Epa(b)的影響Fig.6 (A)Cyclic voltammograms of LDH-Pd0/GCE in PBS(0.1 mol·L-1)with different pH values containing 1.0 mmol·L-1N2H4(v=100 mV·s-1);(B)effects of PBS(0.1 mol·L-1)with different pH values on the Ipa(a)and Epa(b)Ipa:anodic peak current;Epa:anodic peak potential
圖6描述了磷酸緩沖溶液的pH值對水合肼氧化電流(Ipa)和氧化峰電位(Epa)的影響,由圖6可以看出,當(dāng)pH值從4.20增加到6.62時(shí),水合肼的氧化電流逐漸增大;當(dāng)pH值繼續(xù)增加時(shí),氧化電流反而減小,所以本實(shí)驗(yàn)選擇pH=7.0的磷酸緩沖溶液.由圖6還可以看出,水合肼的氧化電位Epa和pH值呈線性關(guān)系,并且隨著pH值增大,Epa逐漸負(fù)移,該現(xiàn)象說明有H+參與水合肼的氧化過程.Epa對pH值的線性關(guān)系遵循如下的方程式:

0.06428 pH-1近似于能斯特公式的理論值(0.059 pH-1),表明在電極反應(yīng)的電子轉(zhuǎn)移過程中伴隨著有相同數(shù)目的H+轉(zhuǎn)移.29
3.4 掃描速率的影響
圖7為氧化峰電流與掃描速率平方根及掃描速率的自然對數(shù)(lnv)和Epa的關(guān)系圖.由圖7A可見,氧化峰電流與掃描速率的平方根呈線性關(guān)系,線性回歸方程為:Ipa=-12.17-122.1v1/2(r=0.9930),說明水合肼在LDH-Pd0修飾電極上電化學(xué)催化氧化過程是受擴(kuò)散控制的.
隨掃描速率的逐漸增大,Epa也逐漸增大.在掃描速率為50-500 mV·s-1的范圍內(nèi)可以得到一線性關(guān)系,如圖7B所示,其方程為:Epa=0.01299 lnv-0.08462(r=0.9976),對于受擴(kuò)散控制的不可逆過程, Epa和lnv間遵循如下關(guān)系:30

圖7 (A)Ipa與v1/2及(B)Epa與lnv的關(guān)系圖Fig.7 Plots of(A)Ipaversus v1/2and(B)Epaversus lnv
Epa=Eo+(RT/αnF)ln(RTk0/αnαF)+(RT/αnαF)lnv其中,Eo為式量電位(V);R為氣體常數(shù);T為溫度(K);α為電極反應(yīng)電子傳遞系數(shù);nα為還原反應(yīng)的電子轉(zhuǎn)移數(shù);k0為電極反應(yīng)的速率常數(shù)(s-1);F為法拉第常數(shù).根據(jù)斜率(RT/αnαF),可求得αnα=1.977(其中T=298 K,R=8.314 J·K-1·mol-1,F=96480 C·mol-1),對于不可逆過程,α通常取0.5,據(jù)此可求出電極反應(yīng)的電子轉(zhuǎn)移數(shù)為4,結(jié)合pH值與氧化峰電位的關(guān)系可知,水合肼的氧化過程是一個(gè)4電子、4質(zhì)子過程,此結(jié)果與文獻(xiàn)31描述(N2H4→N2+4H++4e-)的一致.
3.5 電極有效面積的測定
裸電極和修飾電極的有效表面積可以通過電位階躍計(jì)時(shí)庫侖法(CC)得到,以0.1 mmol·L-1K3[Fe(CN)6]為模型化合物(1 mol·L-1KCl支持電解質(zhì)中K3[Fe(CN)6]的擴(kuò)散系數(shù)D為7.6×10-6cm2·s-1)32,根據(jù)Anson方程:33

式中,Q表示計(jì)時(shí)庫侖法中的電量,n為電極反應(yīng)轉(zhuǎn)移的電子數(shù),A為電極面積,D為電活性物質(zhì)在溶液中的擴(kuò)散系數(shù),Qdl表示雙電層的充電電量, 2nFACD1/2t1/2π-1/2是擴(kuò)散組分的計(jì)時(shí)電量中的分電量,它表示電化學(xué)反應(yīng)通過電極表面的法拉第電量.由圖8的電極在支持電解質(zhì)中電量與時(shí)間關(guān)系可以得到:


圖8 (a)GCE,(b)LDH-Pd0/GCE和(c)LDH/GCE在0.1 mmol·L-1K3[Fe(CN)6]和1 mol·L-1KCl支持電解質(zhì)中電量Q和時(shí)間t的關(guān)系Fig.8 Plots of Q-t curves of(a)GCE,(b)LDH-Pd0/ GCE,and(c)LDH/GCE in 0.1 mmol·L-1K3[Fe(CN)6] containing 1 mol·L-1KCl electrolyteInsert:plots of Q-t1/2curves of(a)GCE,(b)LDH-Pd0/GCE,and (c)LDH/GCE

表1 各種鈀納米粒子修飾電極對水合肼的電化學(xué)催化氧化比較Table 1 Electroanalytical characteristics of various modified electrodes toward N2H4detection

圖9 10 mL0.1 mol·L-1pH 7.0的PBS中依次加入10.0 μL10.0 mmol·L-1水合肼的LDH-Pd0/GCE電流響應(yīng)Fig.9 Amperometric response of LDH-Pd0/GCE to successive injection of 10.0 μL10.0 mmol·L-1N2H4 stirring into 10 mL0.1 mol·L-1pH 7.0 PBS working potential:-0.1 V.Inset shows calibration plot.

測得GCE、LDH-Pd0/GCE和LDH/GCE電極活化面積分別為0.02089,0.02762和0.02496 cm2.說明通過LDH-Pd0修飾玻碳電極,使電極的比表面積增大的不多,不是非常有利于電子傳輸,這正好說明了水滑石的弱導(dǎo)電性.
3.6 水合肼的安培檢測
圖9為LDH-Pd0/GCE的電流響應(yīng).由圖9可以看出在10.0-200.0 μmol·L-1范圍內(nèi),水合肼濃度與電流呈現(xiàn)出良好的線性關(guān)系,線性回歸方程為Ipa= 0.00243+(5.7541×10-4)c(N2H4)(r=0.9947),靈敏度為0.0275 μA·cm-2·(μmol·L-1)-1,檢測限為9.5×10-7mol·L-1.該修飾電極的檢測限低于其它一些鈀納米粒子的檢測限16-18(如表1所示),工作電壓也較低,17,18這可以很好地解決常規(guī)水合肼直接氧化時(shí)過電壓較高的問題.
4 結(jié)論
采用離子交換法和水合肼還原法成功制備了水滑石負(fù)載的鈀納米粒子.XRD、TEM和XPS等表征結(jié)果表明,Pd納米粒子較均勻地分散在水滑石表面,負(fù)載了Pd納米粒子的水滑石仍保持其片層狀結(jié)構(gòu).該法制備得到的水滑石負(fù)載鈀納米粒子修飾玻碳電極對中性介質(zhì)中的水合肼有顯著的電催化活性,該電催化氧化過程是擴(kuò)散控制過程,有4電子、4質(zhì)子參與.此法制備得到的修飾電極在水合肼較寬的濃度范圍(10.0-200.0 μmol·L-1)內(nèi),氧化峰電流與肼濃度間具有良好的線性關(guān)系,且具有檢測限較低和工作電壓較低的優(yōu)點(diǎn).
(1)Umar,A.;Rahman,M.M.;Kim,S.H.;Hahn,Y.B.Chem. Commun.2008,No.2,166.
(2) Garrod,S.;Bollard,M.E.;Nicholls,A.W.;Connor,S.C.; Connelly,J.;Nicholson,J.K.;Holmes,E.Chem.Res.Toxicol. 2005,18(2),115.doi:10.1021/tx0498915
(3) George,M.;Nagaraja,K.S.;Balasubramanian,N.Anal.Lett. 2007,40(13),2597.doi:10.1080/00032710701585552
(4) Chen,X.T.;Xiang,Y.;Li,Z.F.;Tong,A.J.Anal.Chim.Acta 2008,625(1),41.doi:10.1016/j.aca.2008.07.016
(5) Ensafi,A.A.;Rezaei,B.Talanta 1998,47(3),645.doi:10.1016/ S0039-9140(98)00113-1
(6) Sun,M.J.;Bai,L.;Liu,D.Q.J.Pharm.Biomed.Anal.2009,49 (2),529.doi:10.1016/j.jpba.2008.11.009
(7) Safavi,A.;Karimi,M.A.Talanta 2002,58(4),785 doi: 10.1016/S0039-9140(02)00362-4
(8) He,Z.K.;Fuhrmann,B.;Spohn,U.Anal.Chim.Acta 2000,409 (1-2),83.doi:10.1016/S0003-2670(99)00890-9
(9)Yamada,K.;Yasuda,K.;Tanaka,H.;Miyazaki,Y.;Kobayashi, T.J.Power Sources 2003,122(2),132.doi:10.1016/S0378-7753(03)00440-3
(10) Casella,I.G.;Guascito,M.R.;Salvi,A.M.;Desimoni,E.Anal. Chim.Acta 1997,354(1-3),333.doi:10.1016/S0003-2670(97) 00453-4
(11) Umar,A.;Rahman,M.M.;Hahn,Y.B.Talanta 2009,77(4), 1376.doi:10.1016/j.talanta.2008.09.020
(12) Salimia,A.;Miranzad,L.;Hallaj,R.Talanta 2008,75(1),147.
(13)Wang,G.F.;Gu,A.X.;Wang,W.;Wei,Y.;Wu,J.J.;Wang,G. Z.;Zhang,X.J.;Fang,B.Electrochem.Commun.2009,11(3), 631.doi:10.1016/j.elecom.2008.12.061
(14) Ivanov,S.;Lange,U.;Tsakova,V.;Mirsky,V.M.Sens. Actuators B 2010,150(1),271.doi:10.1016/j.snb.2010.07.004
(15)You,J.M.;Jeong,Y.N.;Ahmed,M.S.;Kim,S.K.;Choi,H.C.; Jeon,S.Biosens.Bioelectron.2011,26(5),2287.doi:10.1016/ j.bios.2010.09.053
(16) Zhang,H.J.;Huang,J.S.;Hou,H.P.;You,T.Y.Electroanalysis 2009,21(16),1869.doi:10.1002/elan.200904630
(17) Ji,X.;Banks,C.E.;Holloway,A.F.;Jurkschat,K.;Thorogood, C.A.;Wild-Goose,G.G.;Compton,R.G.Electroanalysis 2006,18(24),2481.doi:10.1002/elan.200603681
(18) Baron,R.;Sljukic,B.;Salter,C.;Crossley,A.;Compton,R.G. Electroanalysis 2007,19(10),1062.doi:10.1002/elan. 200703822
(19) Li,F.;Zhang,B.;Dong,S.;Wang,E.Electrochim.Acta 1997, 42(16),2563.doi:10.1016/S0013-4686(96)00450-1
(20) Guo,D.J.;Li,H.L.Electrochem.Commun.2004,6(10),999. doi:10.1016/j.elecom.2004.07.014
(21) Guo,D.J.;Li,H.L.J.Colloid Interface Sci.2005,286(1),274. doi:10.1016/j.jcis.2004.12.042
(22) Dong,B.;He,B.L.;Huang,J.;Gao,G.Y.;Yang,Z.;Li,H.L. J.Power Sources 2008,175(1),266.doi:10.1016/j.jpowsour. 2007.08.090
(23)Shen,Y.;Xu,Q.;Gao,H.;Zhu,N.N.Electrochem.Commun. 2009,11(6),1329.doi:10.1016/j.elecom.2009.05.005
(24) Shao,C.Y.;Lu,N.;Deng,Z.X.J.Electroanal.Chem.2009, 629(1-2),15.doi:10.1016/j.jelechem.2009.01.006
(25)Choudary,B.M.;Madhi,S.;Chowdari,N.S.;Kantam,M.L.; Sreedhar,B.J.Am.Chem.Soc.2002,124(47),14127.doi: 10.1021/ja026975w
(26) Xu,M.K.;Li,L.F.;Xu,J.;Wang,D.Q.J.Dispersion Sci. Technol.2004,32(7),1.
(27)Gou,G.J.;Ma,P.H.;Chu,M.X.Acta Phys.-Chim.Sin.2004, 20,1357.[茍國敬,馬培華,褚敏雄.物理化學(xué)學(xué)報(bào),2004, 20,1357.]doi:10.3866/PKU.WHXB20041114
(28) Ren,Q.L.;Zhang,Z.F.;Luo,Q.Acta Phys.-Chim.Sin.2004, 20,318.[任慶利,張贊鋒,羅 強(qiáng).物理化學(xué)學(xué)報(bào),2004,20, 318.]doi:10.3866/PKU.WHXB20040321
(29) Luckza,T.Electrochim.Acta 2008,53(19),5725.doi:10.1016/ j.electacta.2008.03.052
(30) Laviron,E.J.Electroanal.Chem.1974,52(3),355.doi: 10.1016/S0022-0728(74)80448-1
(31) Kim,S.K.;Jeong,Y.N.Sens.Actuators B 2011,153(1),246. doi:10.1016/j.snb.2010.10.039
(32)Adams,R.N.Electrochemistry at Solid Electrodes;Marcel Dekker:New York,1969;pp 220-222.
(33)Anson,F.Anal.Chem.1964,36(4),932.doi:10.1021/ ac60210a068
February 3,2012;Revised:May 21,2012;Published on Web:May 23,2012.
Layered Double Hydroxide Supported Palladium Nanoparticles for Electrocatalytic Oxidation of Hydrazine
JIN Rong-Rong LI Li-Fang*XU Xue-Feng LIAN Ying-Hui ZHAO Fan
(College of Chemistry and Material Science,Shandong Agricultural University,Taian 271018,Shandong Province,P.R.China)
A Mg-Al layered double hydroxide(LDH)was prepared from Mg(NO3)2·6H2O and Al((NO3)3· 9H2O by a constant-pH co-precipitation method at room temperature.PdCl2-4was successfully introduced into the gallery space of the Mg-Al-LDH via an ion exchange process,and then reduced by hydrazine to produce LDH-supported palladium(LDH-Pd0)nanomaterials.The sample was characterized by X-ray diffraction(XRD),transmission electron microscope(TEM),and X-ray photoelectron spectroscopy(XPS).It was found that palladium nanoparticles were well dispersed on the LDH surface.The LDH-Pd0nanomaterial was immobilized on a glassy carbon electrode(GCE)to oxidize hydrazine in a phosphate buffer solution(PBS,pH 7.0)using cyclic voltammetry(CV).The modified electrode exhibited excellent electrocatalytic activity and thus could be used to determine the concentration of hydrazine.This was verified by examining the amperometric response at a working potential of-0.1 V,where it was found that the anodic peak current of the modified electrodes was linear with hydrazine concentration in the range of 1.0×10-5
-2.0×10-4mol·L-1.The detection limit was 9.5×10-7mol·L-1at a signal-to-noise ratio of 3.The electrochemically effective surface areas were determined by chrono-coulometry(CC)to be 0.02089, 0.02762,and 0.02496 cm2for GCE,LDH-Pd0/GCE,and LDH/GCE,respectively.The irreversible oxidation of hydrazine on the modified electrode is diffusion controlled with the participation of four electrons and four protons.
Layered double hydroxide;Palladium nanoparticle;Cyclic voltammetry;Hydrazine; Modified electrode;Electrocatalysis
10.3866/PKU.WHXB201205231
O646
?Corresponding author.Email:angll@sdau.edu.cn;Tel:+86-538-8248520.
The project was supported by the Outstanding Young Scientist ResearchAward Fund of Shandong Province,China(2008bs07016).山東省優(yōu)秀中青年科學(xué)家獎(jiǎng)勵(lì)基金(2008bs07016)資助項(xiàng)目
- 物理化學(xué)學(xué)報(bào)的其它文章
- B12Sc4和B12Ti4團(tuán)簇的儲氫性質(zhì)
- YS+(1Σ+,3Φ)與COS氣相反應(yīng)YS++COS→+CO的理論研究
- Ce0.50Zr0.50O2中摻雜M(M=Mn,Y)對乙酸乙酯燃燒催化劑MnOx/ Ce0.50-zZr0.50-zM2zOy/Al2O3性能的影響
- Co(II)與煙酸類分子形成的配位聚合物的晶體結(jié)構(gòu)與孔道穩(wěn)定性
- 水+甲烷系統(tǒng)的氣液相邊界曲線和臨界線
- 二棕櫚酰磷脂酰膽堿/豆固醇脂質(zhì)體液態(tài)有序相的結(jié)構(gòu)性質(zhì):同步輻射X光衍射研究