饅頭加工過程中麥谷蛋白提取率變化研究
范麗霞
(河南工業貿易職業學院,河南 鄭州 450012)
小麥是世界上栽培最早的糧食作物之一,對人類的文明和文化的發展起了最重要的作用。盡管與豆科植物相比,小麥種子蛋白質含量較低,但由于產量位居世界第一位,因此,小麥蛋白質仍是人類食物蛋白質的主要來源。
小麥籽粒中蛋白質的含量及性質直接影響著小麥面粉的加工品質。Osborne(1907)[1]根據其溶解性將小麥籽粒中的蛋白質分為清蛋白、球蛋白、麥谷蛋白和醇溶蛋白。這種分類法是關于小麥蛋白分類最早的報道,為研究小麥蛋白質功能特性及與加工品質之間的關系奠定了理論基礎。通過這種方法提取出清、球蛋白、醇溶蛋白和麥谷蛋白后,還會剩余一些不溶于上述溶劑的蛋白,稱之為殘渣蛋白,又叫剩余蛋白[2]。麥谷蛋白和醇溶蛋白是主要的小麥儲藏蛋白,為組成面筋的主要成分,是決定小麥面團粘彈性的主要因素。
小麥粉加工品質和筋性大小主要由小麥中面筋蛋白質的數量和質量決定[3],而不僅僅是由蛋白質(粗蛋白)總量決定的。事實上,麥谷蛋白和醇溶蛋白共同形成面筋,并以一定的比例相結合時,才共同賦予面團特有的性質。因此,麥谷蛋白和醇溶蛋白是影響小麥粉加工品質的決定性因素。小麥粉在中國的一個主要用途是用來蒸制饅頭。據統計,饅頭用粉量約占我國小麥粉用粉總量的40%[4]。
相對饅頭來說,有關面包品質的研究很多。本文選用3種品種不同的小麥,研究在饅頭加工過程中麥谷蛋白組分提取率的變化,為深入探討面團及饅頭形成機理提供參考。
1 材料與方法
1.1 材料
3種品種不同的小麥:豫麥56和豫麥47由河南省農科院小麥研究所提供,煙農19由鄭州市農科所提供。小麥種子于冰箱中(4℃)保存。
1.2 方法
1.2.1 水分的測定
按GB 5497-85進行。
1.2.2 磨粉
原料除雜→根據要求確定加水量→潤麥24 h→磨粉→保存
1.2.3 粗蛋白含量的測定
采用微量凱氏定氮法(GB/T 5511-2008),蛋白質換算系數為5.7。
1.2.4 濕面筋含量的測定
按GB/T 5506.4-2008的方法進行。
1.2.5 饅頭制作方法
按照一次發酵法進行。
具體操作如下:稱取1 kg面粉,酵母3 g,加水480 mL左右(具體加水量應通過預實驗決定),在立式攪拌機中慢攪2 min,快攪2 min,使面團表面光滑柔軟均勻,分割成10個重量相同的饅頭坯,手工搓圓成型,于35℃、85%RH條件下醒發40 min~60 min后,沸水汽蒸25 min,室溫冷卻后測定及包裝貯存。
1.2.6 饅頭加工過程中取樣點的確立
饅頭加工過程分為面團攪拌、面團成型、面團醒發、蒸制4個階段。根據饅頭加工的這4個階段將取樣點分為7個:原始小麥粉;面團攪拌2 min;面團攪拌結束并成型(4 min);面團醒發30 min;面團醒發結束(60 min);蒸制 15min;蒸制結束(25 min)。
1.2.7 饅頭加工過程中麥谷蛋白組分提取率測定
稱取相當于5 g面粉的面團或饅頭塊,加50 mL 0.1 mol/L NaCl溶液,于4℃間歇提取(振蕩)2 h,4000 r/min離心,沉淀加50 mL 70%乙醇溶液,磁力攪拌2h,4000r/min離心20min,沉淀加50mL0.1mol/L乙酸溶液,攪拌提取2 h,5000 r/min離心30 min,將上清液(醋酸可溶性麥谷蛋白)定容至100 mL,沉淀加50 mL 1.5%SDS溶液,攪拌提取2 h,5000 r/min離心30 min,將上清液(SDS可溶性麥谷蛋白)定容至100 mL,沉淀加50 mL GMP提取液(2%SDS+5%2-ME+10%甘油+0.01 mol/LTris-HCl緩沖液),攪拌提取2 h,5000 r/min 離心 30 min,將上清液(Glutenin Macropolymer,GMP)定容至 100 mL。
2 結果與討論
2.1 饅頭加工過程中麥谷蛋白組分提取率的變化
2.1.1 酸可溶性麥谷蛋白提取率在饅頭加工過程中的變化酸可溶性麥谷蛋白提取率在饅頭加工過程中的變化見圖1。
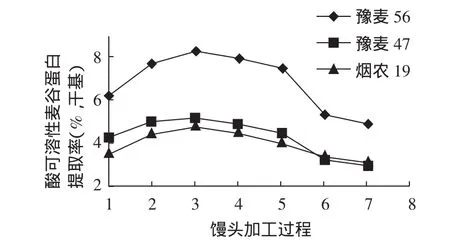
圖1 酸可溶性麥谷蛋白提取率在饅頭加工過程中的變化Fig.1 Acid soluble glutenin extraction rate in the steamed bread processing process changes
由圖1可以看出,在由面粉制作饅頭的整個過程中,酸可溶性麥谷蛋白提取率在不同階段的變化不同,其具體情況為:
在面團攪拌過程中,3種小麥樣品中酸可溶性麥谷蛋白提取率都隨攪拌時間延長而增加。另外還發現,筋力較弱的豫麥56樣品中酸可溶性麥谷蛋白提取率增加的速度比筋力強的豫麥47和煙農19要快。這主要可能由于筋力較弱的小麥品種中麥谷蛋白大聚合體的結構穩定性較差,分子內或分子間-S-S-易斷裂,使得麥谷蛋白大聚合體發生解聚,一部分轉化為可溶性麥谷蛋白,從而使得酸可溶性麥谷蛋白的數量增加,進而引起弱筋小麥品種中酸可溶性麥谷蛋白提取率增加的速度比筋力強的小麥品種快。
在醒發過程中,3種樣品中酸可溶性麥谷蛋白提取率則逐步下降,而且3種樣品下降速度大致相同,沒有什么明顯差異。在此階段,酸可溶性麥谷蛋白提取率減小的主要原因在于面筋網絡的形成,麥谷蛋白分子間通過-S-S-進一步交聯成大分子聚合物,使得酸可溶性麥谷蛋白溶解度降低,提取率減小。
在蒸制初期,3種樣品中酸可溶性麥谷蛋白提取率急劇下降,蒸制后期變化比較平緩。在此階段,造成酸可溶性麥谷蛋白提取率大幅度下降,主要歸因于蛋白質的變性作用[5],引起蛋白質二、三、四級結構發生了變化,成為較混亂的排列。在蒸制過程中,熱變性的蛋白質基質形成了饅頭的部分彈性和韌性。
上述現象說明酸可溶性麥谷蛋白的存在狀態及溶解性在饅頭加工過程中發生了有規律的變化。
2.1.2 SDS-可溶性麥谷蛋白提取率在饅頭加工過程中的變化
SDS-可溶性麥谷蛋白提取率在饅頭加工過程中的變化見圖2。

圖2 SDS-可溶性麥谷蛋白提取率的變化Fig.2 The change of SDS-soluble glutenin extraction rate
由圖2可以看出:在面團攪拌階段,3種小麥樣品中SDS-可溶性麥谷蛋白提取率一直呈上升趨勢;在面團醒發過程中,豫麥56樣品中SDS-可溶性麥谷蛋白提取率在醒發前期一直呈下降趨勢,但隨著醒發時間的延長又逐步上升,最終仍比醒發開始時減少4.0%;豫麥47和煙農19樣品中SDS-可溶性麥谷蛋白提取率在醒發階段一直保持下降趨勢;在蒸制過程中,三種小麥樣品中SDS-可溶性麥谷蛋白提取率均下降。
由上述可知,在整個饅頭加工過程中,蒸制過程對SDS-可溶性麥谷蛋白提取率影響最大,變化幅度也最大,其原因可能由于加熱作用,一方面使蛋白質受熱變性,另一方面,由于高分子量的蛋白質對熱最敏感,即大分子麥谷蛋白在受熱時比小分子麥谷蛋白更易結合成多分子蛋白網絡,成為殘渣蛋白的“新成員”[6],使面團的硬度增加,彈性提高,從而導致SDS-可溶性麥谷蛋白提取率下降。
2.1.3 麥谷蛋白大聚合體(GMP)提取率在饅頭加工過程中的變化
麥谷蛋白大聚合體(GMP)提取率在饅頭加工過程中的變化見圖3。

圖3 麥谷蛋白大聚合體(GMP)提取率的變化Fig.3 The change of Glutenin macropolymer(GMP)extraction rate
由圖3可以看出:在面團攪拌階段,3種小麥樣品面團中GMP的提取率均呈下降趨勢;在面團醒發階段,在醒發初期,3種小麥樣品面團中GMP的提取率均表現為升高,但隨著醒發時間的延長,豫麥56樣品面團中GMP的提取率開始下降,豫麥47和煙農19樣品面團中GMP的提取率仍保持上升趨勢;在蒸制初期,煙農19樣品中GMP提取率急劇下降,豫麥56和豫麥47樣品中GMP提取率均有所上升,但隨著蒸制過程的繼續進行,3種小麥樣品中GMP提取率均呈下降趨勢,且變化比較平緩。
根據GMP在面團攪拌、醒發及蒸制過程中的提取率變化規律,認為在面團攪拌過程中,GMP可能在機械力作用下被打斷、分開,從而形成分子量呈連續性的碎片,其中一些分子量較小的蛋白碎片較容易溶于1.5%SDS溶液;或當面團中形成連續的面筋網絡后,GMP中的大聚合體的一些非共價鍵發生了斷裂;最后一種可能是這些大聚合體的二硫鍵在一些水溶性或疏水性的面筋蛋白的自由巰基作用下發生了“巰基-二硫鍵交換反應”被還原而斷裂,從而使其分子量降低;或者是三種機理的綜合作用[7-9],使得GMP提取率下降,SDS-可溶性麥谷蛋白提取率增加。面團醒發階段,由于GMP的空間結構發生了一定的變化,其主要作用可能在于通過其外部暴露的游離巰基與麥醇溶蛋白或其它蛋白發生了巰基-二硫鍵的交換反應以及氫鍵或疏水作用而相互結合,醒發促進了面筋網絡結構更快的形成和完整,使得GMP含量增加,從而引起GMP提取率升高。饅頭蒸制初期,由于蛋白質受到加熱處理,使得可溶性麥谷蛋白含量減少,增加了殘渣蛋白的含量,同時由于蛋白質分子受到高溫的作用而發生構象變化,從而喪失生物學活性,引起物理化學性質的異變,分子發生變性[10],并且分子量大的蛋白質組分對熱相對比較敏感,容易發生變性。而筋力較強的煙農19樣品中分子量大的蛋白質組分含量相對較高,這幾種因素綜合的結果導致豫麥56和豫麥47樣品中GMP提取率升高,煙農19樣品中GMP提取率下降;但隨著蒸制過程的進行,蛋白質主要發生變性作用,保持蛋白質空間構象的一些弱鍵斷裂,破壞了肽鏈的特定的排列,原來在分子內部的一些非極性基團暴露到了分子的表面,因而降低了蛋白質的溶解度,促進了蛋白質分子之間相互結合而凝結[11],使得3種小麥樣品中GMP提取率均下降。
2.2 麥谷蛋白組分在饅頭加工過程中的變化機理及與饅頭制作品質之間的關系
從上述麥谷蛋白組分的變化,結合圖1~3繪制出酸可溶性麥谷蛋白、SDS-可溶性麥谷蛋白和GMP在饅頭加工過程中的模擬變化趨勢圖。
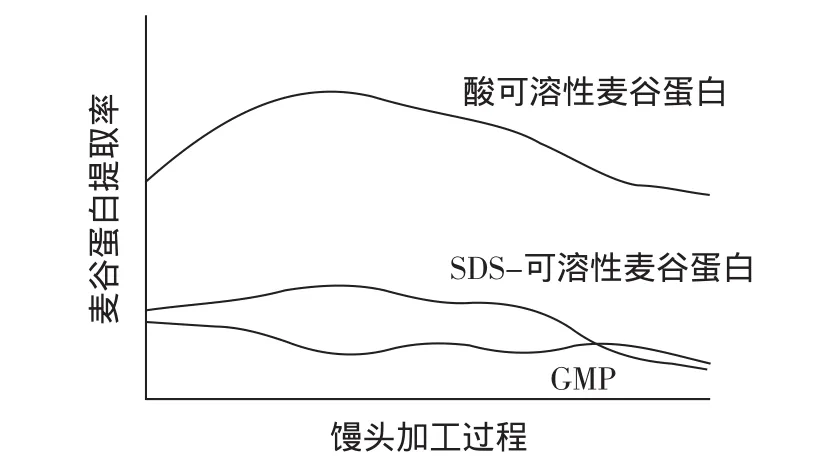
圖4 饅頭加工過程中麥谷蛋白組分提取率變化模擬圖Fig.4 During the process of steamed bread glutenin fractions extracted from rate change simulation diagram
由圖4可以看出,麥谷蛋白組分在饅頭加工過程中均發生了有規律的變化,具體表現為面團攪拌過程中酸可溶性麥谷蛋白提取率、SDS-可溶性麥谷蛋白提取率增加,在醒發和蒸制過程開始下降;并且SDS-可溶性麥谷蛋白提取率變化與GMP提取率變化呈顯著負相關。有關可溶性麥谷蛋白提取率在面團攪拌階段增加的機理有幾種不同的解釋。一種認為在面粉攪拌過程中,由于凝聚體的物理特性而分離或由于共價鍵/非共價鍵的斷裂造成了蛋白凝聚體體積降低[12],而Eckert(1993)[13]則認為蛋白質提取率增加是由于結構壓縮引起的。在醒發階段,一方面,由于面筋網絡的進一步形成;另一方面,蛋白質受溫度的影響,使其構象發生變化,暴露出某些疏水性側鏈基團,有些基團在一定溫度下被活化,使它們處于一個易于合作的狀態,容易與其它蛋白質或其它組分(如脂類)發生相互作用,蛋白質分子間相互貫穿、纏繞,依靠次級鍵特別是疏水鍵的力量結合在一起,使之“理順”或“重構”,包括各種次級鍵的“重組”,增加了不溶性蛋白質的含量[6],從而使GMP提取率升高。在蒸制階段,由于蛋白質分子受到高溫的作用而發生構象變化,從而喪失生物活性,引起物理化學性質的異變,分子發生變性[5],同時由于蛋白質受到加熱處理,使得可溶性麥谷蛋白含量減少,增加了殘渣蛋白的含量,兩種作用綜合的結果導致GMP提取率發生變化。
酸可溶性麥谷蛋白、SDS-可溶性麥谷蛋白是分子量較小的蛋白聚合體,GMP是分子量較大的谷蛋白聚合體。由面團的流變學特性和最終烘焙品質可知,煙農19小麥樣品的品質最好,豫麥56最差,豫麥47介于二者之間。由圖2可知,從整體上看,品質好的小麥樣品SDS-可溶性麥谷蛋白提取率比品質差的小麥樣品低,殘渣蛋白量多,很有可能是品質好的小麥樣品通過-S-S-交聯成的大分子麥谷蛋白含量高[14]。一般來說,GMP含量高的小麥粉,其面筋強度較大,最終烘焙品質較好[15]。從圖3可以看出,在品質最好的煙農19小麥粉中,GMP的含量相對比較高,豫麥47次之,豫麥56最低。這說明GMP的含量和粒度分布是影響面粉烘焙品質性狀的決定性因素。Mac Ritchie[16-17]、Booth[18]和Orth[19]都認為面包烘焙品質差異主要在于麥谷蛋白大聚合體,其含量能最好地解釋面包體積差異(2%~97%)。
3 結論
酸可溶性麥谷蛋白提取率、SDS-可溶性麥谷蛋白提取率在面團攪拌過程中增加,在醒發和蒸制過程開始下降;并且SDS-可溶性麥谷蛋白提取率變化與GMP提取率變化呈顯著負相關。
[1]Osborne T B.The proteins of the wheat kernel[M].Washington:Publications of the Carnegie Institute,1907(84):1-119
[2]Macritchie F.Differences in baking quality between wheat flours[J].Food technology,1978(13):187-197
[3]Branlard G,Khelifi D,Lookhart G.Identification of some wheat proteins separated by a two-step acid polyacrylamide gel electrophoresis and sodium dodecyl sulfate-polyacrylamide gel electrophoresis technique[J].Cereal chemistry,1992,69(6):677-678
[4]朱克慶.傳統主食饅頭的工業生產技術[J].糧食與油脂,1997(4):2-5
[5]張國權,魏益民,歐陽韶暉.面粉質量與面條品質關系的研究[J].西部糧油科技,1997,24(4):39-41
[6]汲言山,趙友梅,秦禮謙.小麥蛋白質的加熱效應[J].鄭州糧食學院學報,1993(1):15-20
[7]Mecham D K,Sokol H A,Pence J W.Extractable protein and hydration characteristics of flours and doughs in dilute acid[J].Cereal chemistry,1962,39(2):81-93
[8]Mecham D K,Cole E G,Sokol H A.Modification of flour proteins by dough mixing:Effects of sulfhydryl-blocking and oxidizing agents[J].Cereal chemistry,1963,40(1):1-9
[9]Mecham D K,Cole E G,Pence J W.Dough-mixing properties of crude and purified glutens[J].Cereal chemistry,1965,42(4):409-420
[10]杜長安,陳復生.植物蛋白工藝學[M].北京:中國商業出版社,1995:76
[11]天津輕工業學院,無錫輕工業學院.食品生物化學[M].北京:中國輕工業出版社,1994:138
[12]Danno G,Hoseney R C.Effects of Dough Mixing and Rheological Acfive Compounds on Relative Viscosity of Wheat Proteins[J].Cereal chemistry,1982,59(3):196-198
[13]Eckert B,Amend T,Belitz H D.The course of the SDS and zeleny sedimentation tests for gluten quality and related phenomena studied using the light microscope[J].Zeitschrift Fur Lebensmittel Untersuchung und Forschung A,1993,196(2):122-125
[14]傅賓孝,趙友梅,秦禮謙.小麥麥谷蛋白與面粉品質[J].鄭州糧食學院學報,1988(3):1-12
[15]Dachkevitch T,Autran J C.Prediction of baking quality of bread wheats in breeding programs by size-exclusion high-performance liquid chromatograph[J].Cereal chemistry,1989,66(6):448-456
[16]Macritchie F.The relationship between baking qualities and glutenin micropolymer[J].Food technology,1978,13(2):187-191
[17]Critchie F A study of the baking qualities of high-molecular weigh subunits[J].Cereal science,1985,3(3):221-230
[18]Booth M R,Melvin M A.Factors responsible for the poor breadmaking quality of high yielding european wheat[J].Science of food and agriculture,1979,30(11):1057-1064
[19]Orth R A,Bushuk W.A comparative study of the proteins of wheats of diverse baking qualities[J].Cereal chemistry,1972,49(2):268-271

