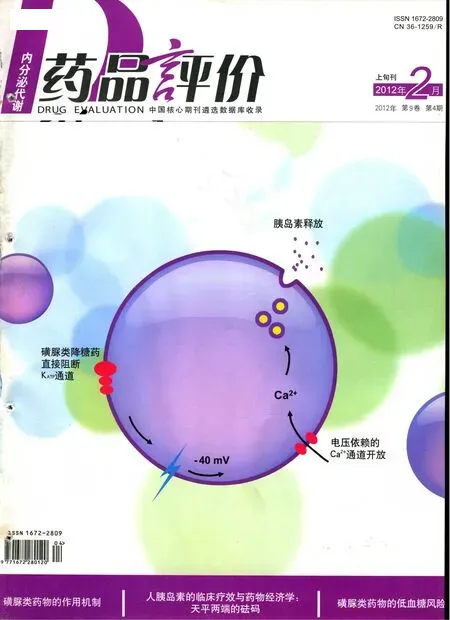
磺脲類藥物的作用機制
中國人民解放軍第305醫(yī)院內(nèi)分泌科 王彤 祝開思
作為一類重要的口服降糖藥物,磺脲類藥物從開始被發(fā)現(xiàn)并應(yīng)用于臨床到現(xiàn)在已有50多年的歷史,并以其確切的降糖效果在臨床工作中得以廣泛應(yīng)用。目前磺脲類藥物共分為3代,第一代包括甲苯磺丁脲、氯磺丙脲、醋磺己脲和妥拉磺脲;第二代包括格列本脲、格列齊特、格列吡嗪、格列喹酮、格列波脲(克糖利)等;格列美脲為第三代。本文擬就磺脲類藥物的具體作用機制進行深入探討。
胰內(nèi)降糖機制
磺脲類藥物主要作用于胰島B細胞膜上的ATP敏感性鉀通道(KATP),該通道是由調(diào)節(jié)亞基磺脲類受體(SUR)和通道形成亞基內(nèi)向整流鉀通道(Kir)按1:1比例組成的異源性八聚體(SUR/Kir6.x),通過促使該通道關(guān)閉促進胰島素釋放是磺脲類藥物的主要作用機制。磺脲類藥物以及葡萄糖(通過轉(zhuǎn)運、磷酸化、氧化代謝產(chǎn)生ATP)均可通過此機制刺激胰腺B細胞釋放胰島素[1,2]。因不同的磺脲類藥物與SUR受體結(jié)合的部位和親和力有所不同,其作用強度和作用時間也不同。現(xiàn)有研究表明,磺脲類藥物刺激胰島B細胞分泌胰島素的分子機制包括以下兩條途徑:①依賴KATP途徑:磺脲類藥物通過特異性結(jié)合于B細胞膜上的SUR受體,使K+通道關(guān)閉,細胞內(nèi)K+外流受阻,細胞內(nèi)K+升高,使細胞膜去極化,從而觸發(fā)L-型電壓依賴性Ca2+通道開放,細胞外Ca2+內(nèi)流增加,胞漿內(nèi)Ca2+濃度升高,促進內(nèi)含胰島素原的囊泡和細胞膜結(jié)合及囊泡內(nèi)容物外吐,從而完成了刺激胰島B細胞向外分泌胰島素的過程。這一過程可能由Ca2+/鈣調(diào)蛋白依賴的蛋白激酶(CaMK)介導(dǎo)。②不依賴KATP通道的途徑:近年來發(fā)現(xiàn)磺脲類藥物對胰島B細胞分泌作用并不僅僅局限于與B細胞膜上SUR結(jié)合的KATP途徑。有研究表明,用[3H]標記的格列美脲和用[3H]標記的格列本脲可與B細胞內(nèi)胰島素分泌顆粒膜上的一種相對分子質(zhì)量為65000的蛋白(gSUR)結(jié)合,使分泌顆粒內(nèi)的pH值明顯降低,引起分泌顆粒的胞吐分泌,從而增加胰島B細胞的胰島素釋放量。通過對B細胞的電壓鉗研究還證實,磺脲類藥物可不通過關(guān)閉KATP而直接加強Ca2+依賴的胰島素分泌作用。這些均提示磺脲類藥物具有不依賴KATP通道的促胰島素分泌作用。Renstrom等[2]認為其分子機制如下:胰島素分泌顆粒膜上的V-型質(zhì)子泵(V-H+-ATPase)負責(zé)將H+泵入分泌顆粒內(nèi)使顆粒內(nèi)環(huán)境酸化,同時顆粒膜上的ClC-3氯離子通道將Cl-轉(zhuǎn)運進入顆粒內(nèi)以保持電中性,磺脲類藥物與胰島素分泌顆粒膜上的gSUR結(jié)合后,引起與之偶聯(lián)的ClC-3氯離子通道活性增加,后者與分泌顆粒膜上的V-H+-ATPase協(xié)同作用,分別將細胞漿中的Cl-和H+轉(zhuǎn)運入分泌顆粒內(nèi),使顆粒內(nèi)的微環(huán)境極度酸化,從而引起胰島素儲存顆粒的胞吐作用增強,增加胰島素分泌。分泌顆粒內(nèi)pH值降低是胰島素分泌顆粒釋放的必要條件。
胰外降糖機制
磺脲類藥物除對B細胞具有直接刺激作用外,還具有很多胰腺外作用。它可以增加脂肪細胞和胰島素的結(jié)合,放大胰島素的外周作用,同時可以減少肝糖輸出[3]。近年采用葡萄糖鉗夾技術(shù)研究發(fā)現(xiàn),磺脲類藥物可使人體外周葡萄糖利用增加10%~52%(平均29%),但也有研究者認為,此作用可能繼發(fā)于葡萄糖毒性作用的改善。臨床試驗也發(fā)現(xiàn),不同磺脲類藥物具有各自獨特的胰外作用途徑。
大量研究表明,格列美脲在離體培養(yǎng)的脂肪細胞和肌肉中具有直接的擬胰島素和胰島素增敏作用[4]。其擬胰島素信號是通過依賴吞飲小泡(Caveolae)/不溶于去污劑的富含糖脂筏(Detergent-insoluble glycolipidenriched rafts,DIGs)介導(dǎo)的。其可能的分子模式[4-6]為:格列美脲以一種不可飽和的和時間依賴的方式直接插入脂肪細胞/肌細胞細胞膜上的Caveolae/DIGs區(qū)緊靠糖基磷脂酰肌醇(GPI)-脂質(zhì)的部位,通過直接影響DIGs的結(jié)構(gòu)/組成和(或)通過誘導(dǎo)糖基磷脂酰肌醇(GPI)-磷脂酶C(PLC)的激活,使GPI-脂質(zhì)/蛋白從DIGs釋放,進而引起特異性的DIG/Caveolae成分的重新分布。結(jié)果,酰化的非受體酪氨酸激酶(non-RTK),如pp59Lyn(一種非受體酪氨酸激酶),從Caveolin分離并遷移至細胞膜的非DIG區(qū)而被解除抑制。這些過程伴隨著Caveolin的酪氨酸磷酸化,進一步使pp59Lyn和Caveolin間的相互作用失去穩(wěn)定或抑制它們重新結(jié)合。被活化non-RTK使胰島素受體底物(IRS)蛋白在特定的酪氨酸殘基磷酸化,進而發(fā)動代謝性的擬胰島素信號,通過磷脂酰肌醇3激酶(PI-3K)通路沿著IRS下游的胰島素信號級聯(lián)傳向脂質(zhì)和糖原合成途徑及葡萄糖轉(zhuǎn)運(GLUT)4轉(zhuǎn)位裝置。格列美脲還可激活細胞內(nèi)特異的蛋白磷酸化酶而促進葡萄糖轉(zhuǎn)運子(GLUT)4/1的轉(zhuǎn)位,激活糖原合成酶,降低糖原合成酶激酶3的活性,從而促進外周組織的葡萄糖利用[6]。
格列喹酮和格列吡嗪可與過氧化物酶體增殖物激活受體(PPAR-?)緊密結(jié)合,并部分激活PPAR-?受體,通過改變外周組織的胰島素抵抗來發(fā)揮降糖作用[7]。
磺脲類藥物與非磺脲類促泌劑降糖機制的區(qū)別
氯茴苯酸類(即格列奈類)為非磺脲類促泌劑,主要包括瑞格列奈、那格列奈和米格列奈,其與磺脲類藥物一樣均通過與胰島B細胞膜上的SUR受體結(jié)合發(fā)揮促進胰島素分泌作用,但格列奈類與磺脲類藥物與受體的結(jié)合位點不同,且格列奈類不進入胰島B細胞內(nèi),不抑制細胞內(nèi)蛋白質(zhì)(如前胰島素原)合成,且不引起胰島素的直接胞泌作用。與磺脲類相比,格列奈類具有“快開-速閉”的作用特點,與SUR結(jié)合、解離的速度均較迅速,因此起效迅速,持續(xù)作用時間短,又稱為“餐時血糖調(diào)節(jié)劑”。此外,格列奈類對胰島B細胞膜上的SUR選擇性較高,而對心血管平滑肌上的SUR親和性相對較低。
磺脲類藥物的其他胰外作用機制
不同組織的KATP具有不同的SUR亞單位。胰島B細胞的KATP由Kir6.2與SUR1組成,心肌的KATP由Kir6.2與SUR2A組成,血管平滑肌的KATP由Kir6.2與SUR2B組成。磺脲類藥物不僅作用于胰腺KATP,也可同時作用于心肌KATP。當磺脲類藥物與心肌Kir6.2/SUR2A受體結(jié)合時,使KATP通道關(guān)閉,影響了心肌的缺血預(yù)適應(yīng)機制,不利于缺血時心臟的自我保護[8]。在生理情況下,由于心肌細胞內(nèi)ATP水平很高,KATP通道保持關(guān)閉。當心肌缺血時,細胞內(nèi)的ATP水平下降,導(dǎo)致KATP通道開放,加快心肌細胞的復(fù)極化,減少Ca2+內(nèi)流,也可以增加Na+與Ca2+交換而增加Ca2+的排出,從而減輕Ca2+超負荷對心肌造成的損害,保護心肌細胞,這個過程稱為心肌的缺血預(yù)適應(yīng)機制。不同的磺脲類藥物對SUR的親和力各不相同。格列本脲與胰島B細胞和心肌的KATP通道都有很高的親和力,且不易與受體解離;甲苯磺丁脲和格列齊特對胰腺的Kir6.2/SUR1受體親和力高,而對心肌的Kir6.2/SUR2A受體親和力低,并且此類藥物與受體的結(jié)合快速可逆;格列美脲對SUR受體的選擇性也很高[9]。對于有缺血性心臟病的2型糖尿病患者,應(yīng)盡量選用對胰島B細胞的KATP通道有高度選擇性的磺脲類藥物。
磺脲類藥物中的格列齊特,由于具有獨特的氨基氮雜雙環(huán)辛烷結(jié)構(gòu),具有清除自由基的能力,從而減少了氧化應(yīng)激反應(yīng),因此除降糖作用外,還可以減少血小板的反應(yīng),刺激血管內(nèi)皮前列環(huán)素的合成,增加纖溶作用,改善血管內(nèi)皮功能[10,11]。
磺脲類藥物對胰島B細胞凋亡的影響
多項基礎(chǔ)和臨床研究認為,第一代和第二代磺脲類藥物對胰島B細胞有誘導(dǎo)凋亡增加的作用,其主要機制是K+通道關(guān)閉后Ca2+內(nèi)流的超負荷和胰島B細胞活化后產(chǎn)生的大量自由基損傷,但目前仍存爭議[12,13]。部分基礎(chǔ)和臨床實驗顯示,新型磺脲類藥物格列美脲具有較為獨特的一面,它與胰島B細胞結(jié)合力較弱,解離較快,能夠在脂肪細胞中激活PPAR-?,改善胰島素抵抗。但是格列美脲對胰島B細胞凋亡是否確實有保護作用還缺乏直接的實驗證據(jù)[14,15]。
[1] Peter P, Frank R, Nick G, et al. Sulfonylurea stimulation of insulin secretion[J]. Diabetes, 2002, 51( Suppl 3): S368-376.
[2] Renstrom E, Barg S, Thevenod F, et al. Sulfonylurea-mediated stimulation of insulin exocytosis via an ATP-sensitive K+channelindependent action[J]. Diabetes, 2002, 51 (suppl 1): S332-336.
[3] Kolterman OG.Longitudinal evaluation of the effects of sulfonylurea therapy in subjects with type 2 diabetes mellitus[J]. Am J Med, 1985,79: 23-33.
[4] Dills DG, Schneider J, Glimepiride/Glyburide Research Group.Clinical evaluation of glimepiride versus glyburide in NIDDM in a double-blind comparative study[J]. Horm Metab Res, 1996, 28(9):426-429.
[5] Muller G. The molecularmechanism of the insulin-mimetic/sensitizing activity of the antidiabetic sulfonylurea drug[J]. Amaryl Mol Med,2000, 6: 907-933.
[6] Muller G. Dynamics of plasma membrane microdomains and cross–talk to the insulin signalling cascade[J]. FEB S Lett, 2002, 531: 81-87.
[7] ScarsiM, Podvinec M, Roth A, et al. Sulfonylureas and glinides exhibit peroxisome proliferator-activated receptor gamma activity:a combined virtual screening and biological assay approach[J]. Mol Pharmacol, 2007, 71(2): 398-406.
[8] Brady PA, Terzic A.The sulfonylurea controversy: more questions from the heart[J]. J Am Coll Cardiol, 1998, 31: 950-956.
[9] Ashcroft FM, Gribble FM.Tissue-specific effects of sulfonylureas:lessons from studies of cloned K(ATP) channels[J]. J Diabetes Complications, 2000, 14: 192-196.
[10] Renier G, Mamputu JC, Serri O.Benefits of gliclazide in the atherosclerotic process: decrease in monocyte adhesion to endothelial cells[J]. Metabolism, 2003, 8: S13-S18.
[11] Jennings PE.Vascular benefits of gliclazide beyond glycemic control[J]. Metabolism, 2000, 10: S17-S20.
[12] Kamp F, Kizilbash N, Corkey BE, et al. Sulfonylureas rapidly cross phospholipid bilayer membranes by a free-diffusion mechanism[J].Diabetes, 2003, 52(10): 2526-2531.
[13] Ling Z, Wang Q, Stange G, et al. Glibenclamide treatment recruits beta-cell subpopulation into elevated and sustained basal insulin synthetic activity[J]. Diabetes, 2006, 55(1): 78-85.
[14] ZabelBA, Ohyama T, Zuniga L, et al. Chemokine-like receptor expression bymacrophages in vivo: regulation by TGF2 beta and TLR ligands[J]. Exp Hematol, 2006, 34(8): 1106-1114.
[15] Roh SG, Song SH, Choi KC, et al. Chemerina new adipokine that modulates adipogenesis via its own receptor[J]. Biochem Biophys Res Commun, 2007, 362(4): 1013-1018.
- 藥品評價的其它文章
- 中國糖尿病患者餐后高血糖的藥物治療
- 降糖藥物安全性評價