BP1在乳腺癌組織中的表達及臨床意義
賀廣珍,李金運,張敬川
(1.徐州市第一人民醫院腫瘤內科,江蘇 徐州221002;2.徐州醫學院附屬醫院腫瘤內科,江蘇 徐州221002)
乳腺癌是女性最常見的惡性腫瘤,全球范圍內病死率僅次于肺癌,居于第2 位,發病率呈逐年上升的趨勢[1]。盡管已發現若干相關分子標志物,但現有證據還不足以充分解釋乳腺癌的發病原因。因此,尋找新的治療靶點,從分子水平探索乳腺癌的發生、發展機制,具有十分重要的意義。
BP1 基因是在研究β 珠蛋白表達調控時被發現并命名的,序列分析表明BP1 是同源盒基因,屬于DLX家族。有研究[2]顯示在白血病中BP1 基因高表達且具有癌基因特性,其高表達增加K562 細胞在體外致白血病的能力。BP1 是DLX 家族中第1 個與乳腺癌密切相關的基因,在乳腺癌分子水平研究中發現BP1直接結合Bcl-2 啟動子并上調Bcl-2 的表達,Bcl-2 是一種抗凋亡基因。為進一步探討BP1 在乳腺癌發生、發展中的作用及初步探討其可能的機制,本研究采用Western blot 及免疫組織化學方法檢測45 例乳腺癌組織、相應癌旁組織中BP1 的表達和乳腺癌組織中Bcl-2的表達,探討BP1 與乳腺癌臨床病理因素及其與Bcl-2表達的相關性。
1 資料與方法
1.1 一般資料 45 例乳腺癌組織取自徐州醫學院附屬醫院普外科2008年3月至9月手術切除組織。所有患者術前均未經放、化療,均為女性,年齡29 ~85歲,中位年齡47.5 歲。取材于手術標本離體20 min內進行,癌組織為腫瘤中心處非壞死組織;相應癌旁組織為距癌灶邊緣至少5 cm 的正常乳腺組織。所有癌組織及相應癌旁組織術后均經病理證實。取材后標本迅速置于液氮中凍存,然后轉至-80 ℃冰箱保存。再切取1 cm×1 cm×1 cm 大小的標本分別放入2 個裝有多聚甲醛液體的廣口瓶中固定。組織學類型依據WHO(2003)對乳腺腫瘤病理學的分類標準;TNM 分期依據AJCC(2010)第7 版《乳腺癌TNM 分類及分期》的標準。雌激素受體(ER)、孕激素受體(PR)、CerbB-2 及Ki-67 為醫院病理科乳腺癌常規檢測指標。
1.2 主要試劑 兔抗BP1 多克隆抗體為Novus Biologicals 公司產品。小鼠抗Bcl-2 單克隆抗體、鼠抗βactin 單克隆抗體、堿性磷酸酶標志的馬抗小鼠抗體、堿性磷酸酶標志的羊抗兔抗體均為Santa Cruz 公司產品。硝酸纖維過濾膜為Sigma Biotechnology 公司產品。NBT/BCIP 顯影劑為Promega 公司產品。即用型SABC 免疫組織化學試劑盒及DAB 顯色試劑盒,均購自北京中杉金橋公司。其他試劑均為國產分析純或化學純。
1.3 實驗方法
1.3.1 Western Blot 測定癌組織中BP1、Bcl-2 和癌旁組織中BP1 表達 將-80 ℃冰箱中凍存的癌組織和相應癌旁組織取出,各稱取100 mg 組織放入EP 管中,剪刀剪碎,加入1 mL 勻漿液后立即用勻漿器在冰水浴中高速勻漿至無肉眼可見的組織塊,然后12 000 r ·min-1、4 ℃離心15 min。小心移取上清液。按改良的Lowary 法,以牛血清白蛋白為標準蛋白,測定蛋白濃度,測定蛋白后分裝,置于-80 ℃冰箱凍存備用。將提取的蛋白質與等體積的上樣緩沖液混勻,煮沸3~5 min 進行蛋白質變性。按Jiang 等[3]方法等量蛋白樣品(每個泳道10-9g)經質量分數10%SDS -聚丙烯酰胺凝膠電泳(SDS-PADE)分離后,以半干轉法電轉移至硝酸纖維素膜上。轉移后的硝酸纖維素膜經質量分數5% 脫脂奶粉封閉1 h,加入兔抗BP1 多克隆抗體(一抗),1∶1 000;鼠抗Bcl-2 單克隆抗體(一抗),1 ∶2 000;鼠抗β-actin 單 克隆抗體(一抗),1∶1 000。4 ℃過夜。次日用緩沖液洗膜3 次,加入相應的二抗(堿性磷酸酶標志的羊抗兔抗體,堿性磷酸酶標志的馬抗小鼠抗體1∶1 000),37 ℃反應2 h。洗膜3 次,以新鮮配制NBT/BCIP 顯色,自來水沖洗終止反應。結果以圖像處理儀(Gene 公司)掃描,Image J軟件進行半定量分析。BP1 蛋白的表達量是以BP1相應條帶的A 值除以β-actin相應條帶的A 值得到的結果;Bcl-2 蛋白的表達量是以Bcl-2 相應條帶的A 值除以β-actin 相應條帶的A 值得到的結果。
1.3.2 免疫組織化學染色測定癌組織中BP1、Bcl-2和癌旁組織中BP1 表達 石蠟包埋乳腺組織標本,以片厚6 μm 連續切片,切片脫蠟至水,體積分數3%H2O2封閉內源性過氧化物酶,微波修復,即用型SABC免疫組化試劑盒A 液封閉,37 ℃1 h;滴加一抗:BP1(1∶300);Bcl-2(1∶500)。4 ℃過夜;滴加B 液,37 ℃1 h;滴加C 液,37 ℃0.5 h。以上各步驟之間均用0.01 mol ·L-1緩沖液沖洗3 次,每次5 min。經DAB 顯色后蘇木精復染,梯度乙醇脫水,二甲苯透明,中性樹膠封片。BP1 主要在上皮細胞的胞質和部分胞核中表達,Bcl-2 在乳腺上皮細胞的胞質中表達,相應部位呈現棕黃色顆粒為陽性反應[4]。細胞計數:在顯微鏡下按統一放大倍數(×40 )進行分析,3 名操作者獨立將每張切片按等距抽樣原則隨機攝取5 個視野。圖像采集后用Image-Pro Plus 6.0 輔助圖像分析系統計數5個視野的陽性細胞數,取其平均數。
1.4 統計學處理 使用SPSS 13.0 進行統計學分析,連續變量以±s 表示,連續變量組間比較采用t 檢驗;兩變量間的關系采用Pearson 相關分析。檢驗水準α=0.05。
2 結果
2.1 BP1 及Bcl-2 蛋白的表達情況 Western blot 方法測定結果:癌組織中BP1 蛋白表達水平為0.949 ±0.593,相應癌旁組織中為0.095 ±0.057(圖1),癌組織中Bcl-2 蛋白表達水平為0.644 ±0.388(圖2)。免疫組織化學染色方法測量結果:癌組織中BP1 陽性細胞數為303.30 ±154.21,癌旁組織中BP1 陽性細胞數為104.08 ±57.97(圖3),癌組織中Bcl-2 陽性細胞數為214.26 ±129.16 (圖4)。經配對t 檢驗分析(表1),BP1 在癌組織的表達明顯高于相應癌旁組織,差異均有統計學意義(P 均<0.01)。采用Pearson 相關分析,乳腺癌組織中Bcl-2 蛋白表達水平與BP1 蛋白表達水平,兩者呈正相關關系(r =0.678,P <0.05)(表2);乳腺癌組織中Bcl-2 陽性細胞數與BP1 陽性細胞數表達水平,兩者表達呈正相關關系(r =0.653,P <0.05)。
2.2 BP1 的表達與乳腺癌臨床病理因素的關系BP1 高表達與ER、PR 及C-erbB-2 有關(P <0.05),而與患者年齡、絕經狀況、病理類型、腫瘤大小、淋巴結轉移、臨床分期、Ki-67 無關(P >0.05)(表3)。
3 討論
BP1 是在研究β 珠蛋白表達調控時發現的,已克隆的BP1 cDNA 全長為1 251 bp,開放讀碼框長約720 bp,編碼240 個氨基酸,具有螺旋狀的同源異型結構域[5]。BP1 屬于DLX 亞家族,又被稱為DLX9,與DLX4 和DLX7 互為異構重整體[6]。
圖4 免疫組織化學法檢測BP1 與Bcl-2在乳腺癌組織中的表達(A:Bcl-2 蛋白,B:BP1 蛋白,×400)
表1 BP1 在乳腺癌組織與相應癌旁組織中的表達
表2 乳腺癌組織中BP1 與Bcl-2 表達的相關性
Man 等[7]發現BP1 蛋白在81%浸潤性乳腺癌中表達,而在原位癌、增生性病變及正常組織中表達分別為46%、21%和0%,表明BPl 蛋白可能是腫瘤形成過程中一個重要的上調因子。Man 等[8]研究發現炎性乳腺癌組織中BP1 陽性細胞的百分比和免疫染色強度均明顯高于非炎性乳腺癌組織,BP1 蛋白有促進腫瘤進展、侵襲和轉移的可能性。本文結果顯示:癌組織BP1 蛋白表達水平為0.949 ±0.593,相應癌旁組織為0.095 ±0.057;癌組織BP1 陽性細胞數為303.30 ±154.21,癌旁組織陽性細胞數為104.08 ±57.97。經配對t 檢驗分析,BP1 在癌組織中的表達明顯高于相應癌旁組織。提示BP1 蛋白可能促進乳腺癌的發生、發展。
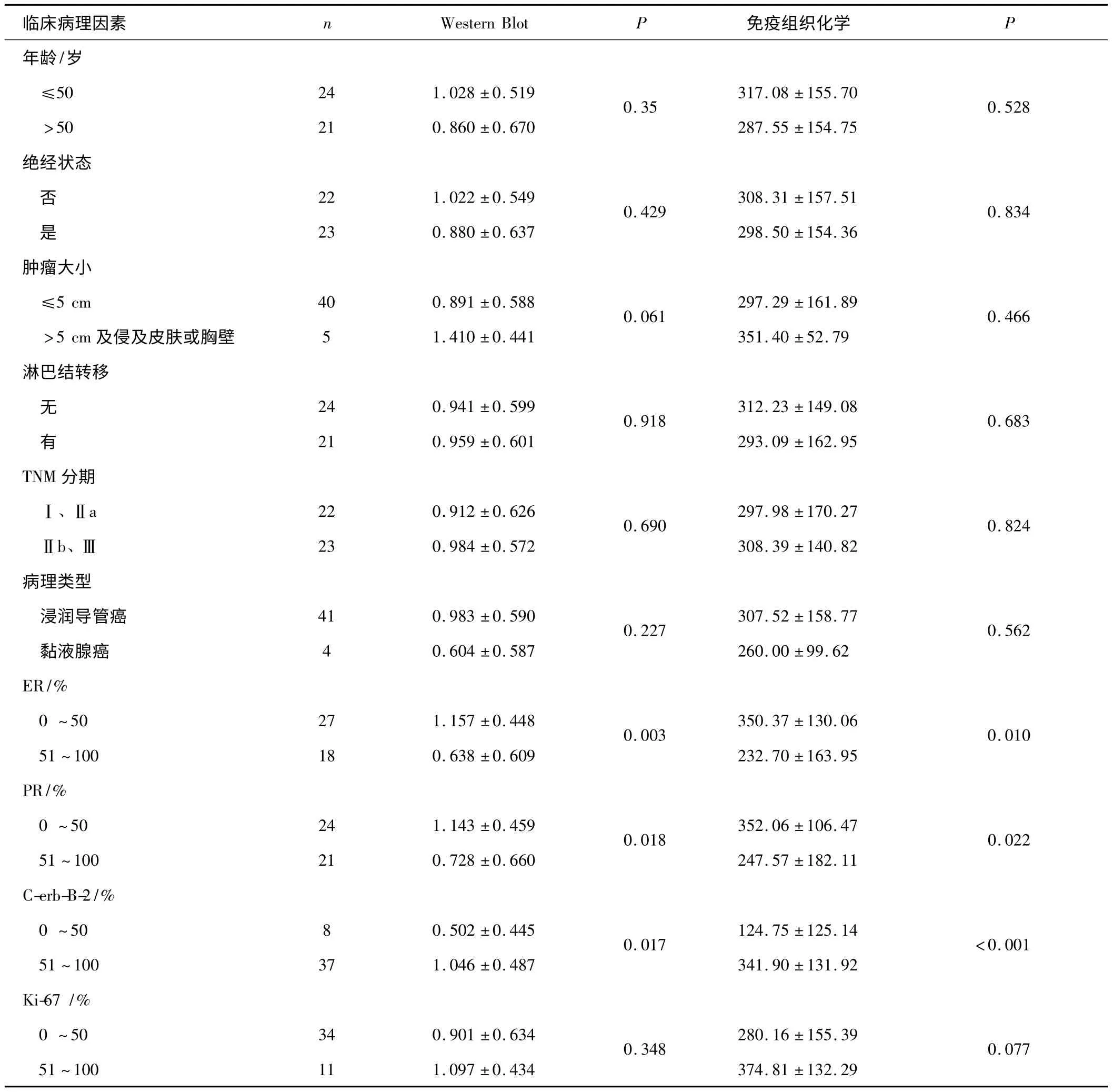
表3 BP1 蛋白表達與乳腺癌臨床病理因素的關系
ER、PR 及C-erbB-2 是判斷乳腺癌內分泌敏感性的重要的臨床病理指標,對指導臨床治療和判斷預后有重要意義。本研究發現:1)BP1 與患者年齡、絕經狀況、病理類型、腫瘤大小、淋巴結轉移、臨床分期、Ki-67均無關;2)BP1 與ER、PR 及C-erbB-2 有關(P <0.05),隨著ER、PR 陽性率的增加,BP1 表達水平降低。Fu 等[9]利用RT-PCR 方法證實BP1 的表達率在ER 陽性組顯著低于陰性組。本文結果與之一致。Stevenson 等[10]的研究結果顯示當應用TNF-α 針對性治療MCF7 細胞(ER 陽性的乳腺癌細胞株)時,BP1 高表達的MCF7 細胞存活率增加約2 倍。Fu 等[11]發現在ER 陰性的乳腺癌Hs578T 細胞株中,BP1 高表達顯著增強細胞的增殖和轉移的潛能;隨C-erbB-2 陽性率的增加,BP1 表達水平升高,分析可能的原因為:1)BP1 基因圖譜與C-erbB-2 臨近,定位于17q21 ~22[6];2)BP1 蛋白與C-erbB-2 蛋白都共定位在乳腺癌細胞的亞型中,且共定位的細胞數隨原位癌至浸潤癌的進展而增加[10];3)BP1 基因擴增與HER2/NEU 基因擴增有顯著的相關性[12]。ER、PR 低表達與C-erbB-2 高表達的腫瘤通常與更高的治療抵抗和更差的預后有關。因此,BP1 高表達可能與臨床難治腫瘤的預后和治療有關,檢測BP1 在乳腺癌組織中的表達可以更好地指導臨床治療和判斷預后。由于BP1 的高表達,在所有ER 陰性的乳腺癌中,BP1 可能成為一個新的治療靶點。
抑制細胞凋亡是腫瘤形成與發展的一個關鍵步驟,腫瘤細胞逃避凋亡歸因于抑癌基因的失活以及癌基因的激活。Vaux 等[13]首先報道了Bcl-2 有延長細胞生存時間、抑制細胞凋亡的作用。非整倍體腫瘤較整倍體腫瘤更過度表達Bcl-2,說明Bcl-2 可通過抑制凋亡而加強基因不穩定性[14],過度表達的Bcl-2 在不影響細胞增殖的情況下阻止細胞凋亡。Oh 等[15]研究發現Bcl-2 通過抗細胞凋亡和自噬抑制作用2 個途徑抑制腫瘤的發生。Bcl-2 參與了多種腫瘤的發生、發展,其中包括乳腺癌。Stevenson 等[10]研究發現在MCF-7 乳腺癌細胞中,BP1 通過直接結合Bcl-2 P1 啟動子區域上游,轉錄激活Bcl-2 基因,導致Bcl-2 蛋白增加。本文結果:乳腺癌組織中BP1 蛋白表達水平為0.949 ±0.593,Bcl-2 蛋白表達水平為0.644 ±0.388(r=0.678,P=0.00);免疫組織化學檢測顯示癌組織中BP1 陽性細胞數為303.30 ±154.21,Bcl-2 陽性細胞數為214.26 ±129.16(r =0.653,P =0.001)。BP1與Bcl-2 在癌組織中的表達存在正相關關系,BP1 可能亦轉錄激活Bcl-2 基因,增加Bcl-2 蛋白的表達。王洋等[16]的研究結果顯示,在乳腺癌組織中,BP1 mRNA陽性組凋亡細胞數少于BP1 mRNA 陰性組。由此可見,BP1 可能通過上調Bcl-2 抑制乳腺癌細胞凋亡,這可能是其發揮致癌作用機制之一。
[1]Jemal A,Murray T,Ward E,et al.Cancer statistics,2005[J].CA Cancer J Clin,2005,55(1):10 -30.
[2]Haga SB,Fu S,Karp JE et al. BP1,a new homeobox gene,is frequently expressed in acute leukemias [J]. Leukemia,2000,14(11):1867 -1875.
[3]Jiang Q,Gu Z,Zhang G.Nuclear translocation of extracellular signal-regulated kinases in neuronal excitotoxicity[J]. Neuroreport,2001,12(11):2417 -2421.
[4]Lewis MT. Homeobox genes in mammary gland development and neoplasia[J].Breast Cancer Res,2000,2(3):158 -169.
[5]Berg PE,Williams DM,Qian RL,et al.A common protein binds to two silencers 5’to the human beta-globin gene[J].Nucleic Acids Res,1989,17(21):8833 -8852.
[6]Fu S,Stevenson H,Strovel JW ,et al.Distinct functions of two isoforms of a homeobox gene,BP1 and DLX7,in the regulation of the beta-globin gene[J].Gene,2001,278(1 -2):131 -139.
[7]Man YG,Fu SW,Schwartz A,et al.Expression of BP1,a novel homeobox gene,correlates with breast cancer progression and invasion[J].Breast Cancer Res Treat,2005,90(3):241 -247.
[8]Man YG,Schwartz A,Levine PH,et al. BP1,a putative signature marker for inflammatory breast cancer and tumor aggressiveness[J].Cancer Biomark,2009,5(1):9 -17.
[9]Fu SW,Schwartz A,Stevenson H,et al.Correlation of expression of BP1,a homeobox gene,with estrogen receptor status in breast cancer[J].Breast Cancer Res,2003,5(4):R82 - R87
[10]Stevenson HS,Fu SW,Pinzone JJ,et al .BP1 transcriptionally activates bcl-2 and inhibits TNFalpha-induced cell death in MCF7 breast cancer cells[J].Breast Cancer Res,2007,9(5):R60.
[11]Fu Y,Lian Y,Kim KS,et al .BP1 homeoprotein enhances metastatic potential in ER-negative breast cancer[J].J Cancer,2010,1:54-62.
[12]Cavalli LR,Man YG,Schwartz AM,et al.Amplification of the BP1 homeobox gene in breast cancer [J]. Cancer Genet Cytogenet,2008,187(1):19 -24.
[13]Vaux DL,Cory S,Adams JM. Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize pre-B cells[J].Nature,1988,335(6189):440 -442.
[14]Zapata JM,Krajewska M,Krajewski S,et al.Expression of multiple apoptosis-regulatory genes in human breast cancer cell lines and primary tumors[J]. Breast Cancer Res Treat,1998,47(2):129-140.
[15]Oh S,Xiaofei E,Ni D,et al.Downregulation of autophagy by Bcl-2 promotes MCF7 breast cancer cell growth independent of its inhibition of apoptosis[J].Cell Death Differ,2011,18(3):452 -464.
[16]王洋,鄭唯強,倪燦榮.BP1 mRNA 在乳腺癌中的表達及其臨床意義[J].中華病理學雜志,2005,34(9):602.

