EGCG 改善高濃度TNF-α對人皮膚創傷愈合中成纖維細胞的抑制作用
余紅梅, 胡宏鴦, 吳 霞, 方海云△
(浙江大學醫學院附屬邵逸夫醫院1 普外科,2 皮膚科,浙江 杭州310006)
皮膚創口愈合是一個復雜的生物學過程。成纖維細胞是創口愈合的主要修復細胞,它在創口修復過程中的增殖、遷移以及膠原的合成,直接影響其愈合[1]。創口局部的炎癥反應有助于創口愈合過程的啟動和完成,但過度的炎癥反應可導致傷口的遷延不愈[2],表現為愈合遲緩性皮膚傷口(delayed wound healing,DHW)。腫瘤壞死因子α(tumor necrosis factor alpha,TNF-α)是由多種細胞分泌的炎癥因子,對早期炎癥細胞的遷移和聚集等起到重要作用。但是目前它對于皮膚成纖維細胞的作用尚存爭議,認為低濃度的TNF-α 可以促進成纖維細胞的增生[3],而另有研究認為局部TNF-α顯著增高可抑制皮膚創口的愈合[4-5]。
表沒食子兒茶素沒食子酸酯(epigallocathechin-3 gallate,EGCG)是一種茶多酚的提取物單體,它具有顯著抗炎和抗氧化作用,可以抑制皮膚成纖維細胞MMP 的合成和表達,延緩細胞老化,促進傷口愈合[6-7]。但其對創口愈合中成纖維細胞的影響國內外研究較少。本實驗旨在通過觀察高濃度TNF-α 對人皮膚成纖維細胞增殖、遷移和膠原蛋白合成的作用以及EGCG 預處理的影響,探討EGCG 對過度炎癥反應延遲的創口愈合是否有改善作用。
材 料 和 方 法
1 主要試劑和儀器
人TNF-α(PeproTech);EGCG(Sigma);低糖DMEM 培養基(Gibco);胎牛血清(杭州四季青生物工程材料研究所);0.25%胰酶(Gibco);0.25%dispaseII 酶(Gibco);山羊抗Ⅰ型膠原蛋白抗體(Santa Cruz);HRP 標記的山羊Ⅱ抗(杭州聯科生物公司);蛋白定量試劑盒(Bio-Rad)。Cell Counting Kit-8(CCK-8)試劑盒(Dojindo)。
2 細胞培養與傳代
取健康男性青少年包皮環切術切除的包皮,剪去皮下組織,成0.5 cm×0.5 cm×0.5 cm 的皮片,碘伏浸泡5 min,PBS漂洗3 次。加入0.25% dispaseⅡ于4 ℃消化16 ~20 h,分離表、真皮,然后用0.25%胰酶37 ℃反復消化,以含10%胎牛血清的DMEM 培養液中和。200 目細胞篩過濾,1 000 r/min離心,接種至25 cm 細胞培養瓶,置于37 ℃、5%CO2細胞培養箱。待細胞貼壁生長到80%融合,用0.25%胰酶消化傳代。取4 ~8 代細胞進一步實驗。
3 實驗分組
調整細胞密度為2 ×108/L,接種于6 孔板,待90%融和,予以干預分組。(1)正常對照組:未予以任何干預,含10%胎牛血清的低糖DMEM 培養液培養;(2)TNF-α 干預組:在培養液中加入人TNF-α 至終濃度為10 μg/L,作用24 h;(3)TNF-α+EGCG 干預組:EGCG 預處理1 h 后,加入TNF-α 10 μg/L,作用24 h。
4 細胞增殖實驗
細胞接種于96 孔板,每孔5 ×103個。待細胞貼壁后予以相應的干預,24 h 后向每孔加入10 μL CCK-8 溶液,繼續在培養箱孵育4 h 后,用酶標儀測定在450 nm 處的吸光度值。
5 細胞劃痕愈合實驗
細胞接種于6 孔板至90%融合并予以相應干預后,用20 μL 槍頭在單層細胞上垂直劃出一細痕,制作出細胞傷口模型。劃痕后用PBS 清洗2 次,換用含1%胎牛血清的低糖DMEM 培養液以排除細胞增殖的影響,繼續培養24 h 和48 h后倒置顯微鏡觀察細胞劃痕創面愈合程度。細胞平行遷移率(%)=(1-剩余劃痕區面積/原劃痕區面積)×100%。實驗重復3 次。
6 Western blotting 檢測
將6 孔板上的細胞用PBS 清洗3 次后,加入細胞裂解液冰上裂解30 min,離心后取上清以Lowery 法蛋白定量。按每孔50 μg 蛋白上樣于10% SDS-聚丙烯酰胺凝膠,電泳后轉移至PVDF 膜,室溫下封閉1 h 與Ⅰ抗結合(1∶1 000 稀釋),4 ℃過夜,TBST 洗膜后再與Ⅱ抗室溫結合1 h,滴加ECL 液,用Image Quant LAS-4000(Fujifilm)曝光儀曝光。條帶灰度分析采用Image Multi-Gauge 軟件(Fujifilm)。
7 統計學處理
結 果
1 TNF-α 抑制細胞增殖以及EGCG 干預的作用
如圖1 所示,TNF-α 抑制成纖維細胞的增殖,較對照組差異顯著,而EGCG 預處理后顯著改善TNF-α 的增殖抑制作用,并呈濃度依賴性,在40 μmol/L 時即達到最大效應。
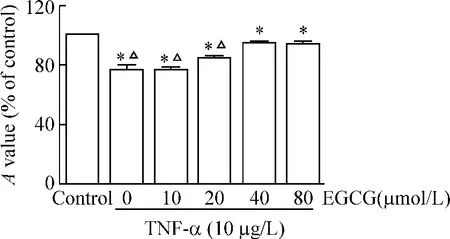
Figure 1. The A value detected by CCK-8 assay. The A value decreased in the cells treatment with TNF-α,and it was improved by EGCG pre-treatment in a dose-dependent manner. ± s. n =5. * P <0.05 vs control;△P <0.05 vs EGCG(40 μmol/L)+ TNF-α.圖1 各干預組對成纖維細胞增殖的影響
2 TNF-α 延遲細胞劃痕愈合以及EGCG 干預的作用
如圖2 所示,成纖維細胞從細胞劃痕邊緣向中心移動。TNF-α 10 μg/L 作用24 h 后,成纖維細胞的遷移率即出現顯著抑制(P <0.05),而EGCG(40 μmol/L)干預后則在24 h即能改善TNF-α 的延遲愈合作用(P <0.05);48 h 后,對照組與EGCG 干預組基本愈合(遷移率分別為91.50% 和88.83%),而TNF-α 組愈合仍顯著延遲,遷移率為46.01%(P <0.05)。
3 TNF-α 抑制I 型膠原蛋白表達以及EGCG 干預的作用
如圖3 所示,TNF-α 組Ⅰ型膠原蛋白的表達水平明顯低于對照組,而EGCG(40 μmol/L)干預后顯著改善collagen I的表達。
討 論
傷口愈合是一個非常復雜的生物學過程。其延遲愈合容易引起局部感染,甚至發展為慢性非愈合傷口。成纖維細胞在皮膚創口愈合中起到重要作用,它經過增殖、遷移,分泌膠原蛋白、細胞外基質和大量的生長因子,與新生血管等構成肉芽組織,填補創面,幫助表皮細胞覆蓋。
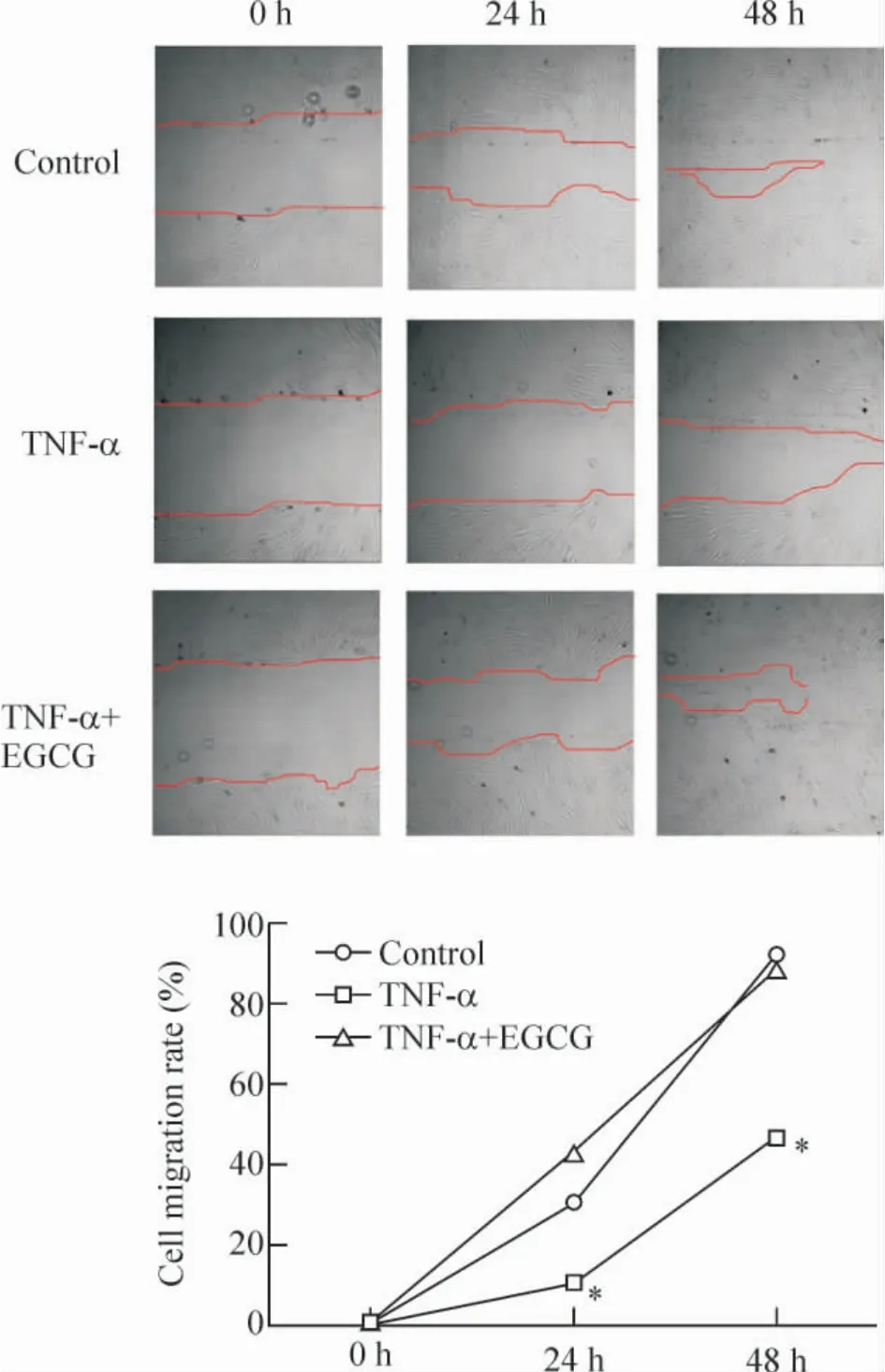
Figure 2. The migration of dermal fibroblasts measured by wound healing assay. A:cell migration at 0 h,24 h and 48 h from the scrape margin;B:quantitative analysis of the migration rates. ±s.n=3. * P <0.05 vs control.圖2 各干預組對成纖維細胞遷移的影響
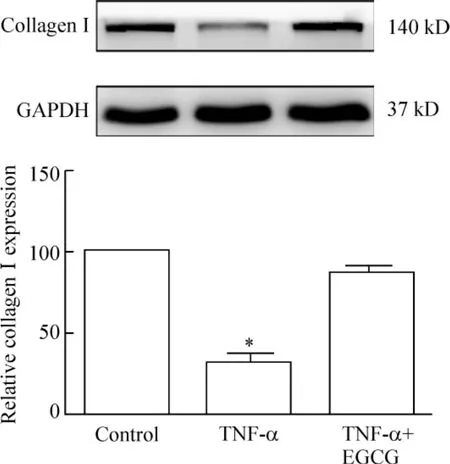
Figure 3. The expression of collagen I in each group measured by Western blotting. ±s.n=3. * P <0.05 vs control.圖3 各干預組對成纖維細胞Ⅰ型膠原蛋白表達的影響
在創口修復的早期,局部的炎癥反應有助于清除細菌和細胞碎片,募集單核/巨噬細胞,分泌多種細胞因子如IL-1β、TGF-β 等,刺激成纖維細胞進入創面[7]。Ezoe 等[3]曾指出低濃度的TNF-α可以促進整合素α2β1的表達。整合素α2β1作為膠原和層黏連蛋白的受體,其表達增加有助于創傷愈合中成纖維細胞的黏附[8]。但是延遲愈合的傷口也常伴隨炎癥細胞的過度浸潤和膠原沉積的減少。過度的炎癥也容易引起基質脆性增加和疤痕收縮異常[4,9]。Lai 等[5]發現局部的TNF-α 濃度增加可以延遲傷口愈合,也有人報道TNF-α 能拮抗TGF-β1誘導的成肌纖維細胞的分化和平滑肌α-肌動蛋白的表達[4,10],而這兩者在傷口愈合后期起關鍵作用。針對目前的爭議,本實驗采用了10 μg/L 的TNF-α作用于體外培養的皮膚成纖維細胞。我們發現高濃度的TNF-α 顯著抑制成纖維細胞的增殖。而且在細胞劃痕愈合實驗中,TNF-α 組劃痕24 h 后即出現明顯差異,48 h 后仍未完全愈合,與對照組相比細胞遷移能力顯著受到抑制。Western blotting 也提示TNF-α 組的I 型膠原蛋白明顯下降,這也將不利于皮膚傷口的愈合。實驗結果說明高濃度的TNF-α對成纖維細胞的功能學表現有明顯抑制作用,從而影響皮膚創口的愈合。
近年來,茶多酚的研究越來越受到人們的重視。EGCG屬于茶多酚中提取的單體,由于其顯著的抗炎抗氧化作用,在諸多疾病如心血管疾病[11]、腫瘤[12]、炎癥性腸病[13]等中有廣泛應用。有研究發現[14],EGCG 能阻斷由紫外線B 照射誘發的皮膚白細胞浸潤,減少氧自由基的生成,并調控角質細胞分化。動物實驗[7]也提示EGCG 可以加快小鼠皮膚的創口愈合,抑制小鼠傷口附近IL-1β 和MMP-1 的過度分泌。然而EGCG 對于傷口愈合的細胞學機制在國內外未見明確報道。由于皮膚成纖維細胞在傷口愈合中起關鍵作用,本研究將高濃度TNF-α 干預的成纖維細胞用EGCG 預處理1h。我們發現EGCG 處理后,TNF-α 對成纖維細胞的功能學抑制明顯得到改善,增殖和遷移能力顯著恢復,被抑制的膠原蛋白表達也有增加,表明EGCG 可以抑制皮膚創口中過度的炎癥反應,恢復正常的成纖維細胞功能,從而促進傷口愈合。
本實驗通過觀察EGCG 和高濃度TNF-α 對成纖維細胞的功能學影響,闡述了高濃度TNF-α 對皮膚成纖維細胞增殖、遷移和膠原蛋白表達的抑制作用以及EGCG 的保護作用,從細胞學機制說明了過度炎癥反應延遲皮膚創口愈合,并提出了可能的治療手段。
[1] Diegelmann RF,Evans MC. Wound healing:an overview of acute,fibrotic and delayed healing[J]. Front Biosci,2004,9:283-289.
[2] 朱 平,嚴 勵,陳黎紅,等. MMP-9/TIMP-1 表達在糖尿病鼠皮膚傷口愈合過程中的變化及意義初探[J].中國病理生理雜志,2008,24(11):2204-2208.
[3] Ezoe K,Horikoshi T. Tumor necrosis factor-α increased the integrin α2β1expression and cell attachment to type I collagen in human dermal fibroblasts[J]. Biochem Biophys Res Commun,1993,192(1):281-287.
[4] Goldberg MT,Han YP,Yan C,et al. TNF-α suppresses α-smooth muscle actin expression in human dermal fibroblasts:an implication for abnormal wound healing[J]. J Invest Dermatol,2007,127(11):2645-2655.
[5] Lai JJ,Lai KP,Chuang KH,et al. Monocyte/macrophage androgen receptor suppresses cutaneous wound healing in mice by enhancing local TNF-α expression[J]. J Clin Invest,2009,119(12):3739-3751.
[6] Song XZ,Xia JP,Bi ZG. Effects of (-)-epigallocatechin-3-gallate on expression of matrix metalloproteinase-1 and tissue inhibitor of metalloproteinase-1 in fibroblasts irradiated with ultraviolet A[J]. Chin Med J (Engl),2004,117(12):1838-1841.
[7] 申羽佳,李衛國,張 惠,等. 綠茶多酚對小鼠皮膚傷口愈合時白介素-1β 表達的影響[J]. 分子細胞生物學報,2009,42(3-4):179-185.
[8] Werner S,Grose R. Regulation of wound healing by growth factors and cytokines[J]. Physiol Rev,2003,83(3):835-870.
[9] Martinez-Ferrer M,Afshar-Sherif A,Uwamariva C,et al. Dermal transforming growth factor-β responsiveness mediates wound contraction and epithelial closure[J]. Am J Pathol,2010,176(1):98-107.
[10] Leask A,Abraham DJ. TGF-β signaling and the fibrotic response[J]. FASEB J,2004,18(7):816-827.
[11] Townsend PA,Scarabelli TM,Pasini E,et al. Epigallocatechin-3-gallate inhibits STAT-1 activation and protects cardiac myocytes from ischemia/reperfusion-induced apoptosis[J]. FASEB J,2004,18(13):1621-1623.
[12] Spinella F,Rosano L,Decandia S,et al. Antitumor effect of green tea polyphenol epigallocatechin-3-gallate in ovarian carcinoma cells:evidence for the endothelin-1 as a potential target[J]. Exp Biol Med (Maywood),2006,231(6):1123-1127.
[13] Danesi F,Philpott M,Huebner C,et al. Food-derived bioactives as potential regulators of the IL-12/IL-23 pathway implicated in inflammatory bowel diseases[J].Mutat Res,2010,690(1-2):139-144.
[14] Kim J,Hwang JS,Cho YK,et al. Protective effects of(-)-epigallocatechin-3-gallate on UVA-and UVB-induced skin damage[J]. Skin Pharmacol Appl Skin Physiol,2001,14(1):11-19.

