菊芋葉總黃酮提取工藝優化及含量動態變化
鄭曉濤,隆小華,劉 玲 ,陳 良,劉兆普
南京農業大學資源與環境科學學院 江蘇省海洋生物學重點實驗室,南京210095
菊芋(Helianthus tuberosus L.),俗名洋姜,是菊科向日葵屬多年生草本植物。原產北美洲,十七世紀傳入歐洲,后傳入中國。它分布廣,適應性強,極易種植,產量頗高,成本低廉[1]。其塊莖可用于發酵產乙醇[2],也可水解生產高果糖漿[3],其葉片提取物具有良好的殺菌活性,可用于開發植物源抑菌劑[4]。
黃酮類化合物具有多種的生物活性和藥用價值[5,6],應用價值廣泛,市場開發潛力很大。從上世紀六、七十年代開始,國內外就有科研人員開展了對向日葵屬植物化學成分的研究,已從該屬的H. microcephali、H.angustifolii、H. corona-solis、H. grosseserrats、H. annuus 等 中 分 離 出 豐 富 的 黃 酮 類 化 合物[7-12]。本研究以菊芋葉為原料,采用回流法對菊芋葉總黃酮提取工藝進行優化,并對不同采集時間的菊芋葉總黃酮含量進行測定,旨在確定菊芋葉總黃酮的最佳提取工藝條件和最佳采樣時間,為菊芋資源的綜合開發利用提供科學依據。
1 材料與方法
1.1 材料與試劑
菊芋葉:分別于2010 年5、7、9 和11 月的中旬采集于南京農業大學大豐試驗基地,菊芋品種為南芋1 號。單因素及正交試驗所有葉片材料為9 月份所采。60 ℃烘干,粉碎后過40 目篩備用;蘆丁對照品(中國藥品生物制品檢定所);其余試劑均為國產分析純;水為重蒸水。
1.2 儀器與設備
AUY 120 型分析天平(日本島津科學儀器公司);101A-Z 型電熱鼓風干燥箱(上海市實驗儀器總廠);FZ102 微型粉碎機(天津泰斯特有限公司);UV-2450 紫外可見分光光度計(日本島津科學儀器公司);HH-4 數顯恒溫水浴鍋(國華電器有限公司)。
1.3 方法
1.3.1 提取工藝流程
菊芋葉→60 ℃烘干→粉碎→準確稱取一定質量→甲醇熱回流→過濾→定容至50 mL,即為提取液。
1.3.2 標準曲線的繪制
稱取蘆丁對照品12.35 mg,用70%甲醇(體積分數)溶解,轉入50 mL 量瓶中,用70%甲醇定容,配成0.247 mg/mL 的蘆丁對照品溶液。分別吸取對照品溶液0、2.0、4.0、6.0、8.0、10.0 mL 于50 mL容量瓶中,各加水至25 mL;加入5%NaNO2溶液2 mL,搖勻;加入10% Al(NO3)3溶液2 mL,搖勻,放置6 min;加入4% NaOH 溶液10 mL,用70%甲醇定容,搖勻[13]。以第一管為空白,于510 nm 下檢測吸光值。以吸光值為縱坐標,濃度為橫坐標,繪制標準曲線。用最小二乘法作線性回歸,其回歸方程為:A= 8.369C + 0.008(r2=0.9972)。
1.3.3 總黃酮含量的測定
吸取2 mL 提取液置于50 mL 容量瓶中,按上述蘆丁標準曲線繪制方法配制溶液,并以試劑空白為參比液調零,510 nm 測取其吸光度。通過標準曲線計算提取液中的總黃酮含量,總黃酮含量為:
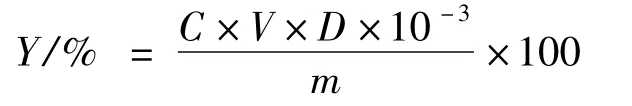
式中:Y 為總黃酮含量;C 為由標準曲線計算得出的待測試液的總黃酮質量濃度(mg/mL);V 為待測試液的體積(mL);D 為待測試液的稀釋倍數;m為菊芋葉粉末質量(g)。
1.4 因素水平設定
1.4.1 單因素試驗
1.4.1.1 甲醇體積分數對總黃酮含量的影響
稱取1.00 g 菊芋葉,以不同的體積分數(10%、30%、50%、70%、90%)的甲醇溶液為溶劑,料液比為1∶30,提取溫度為70 ℃,提取時間1 h。
1.4.1.2 提取時間對總黃酮含量的影響
稱取1.00 g 菊芋葉,以體積分數為70%的甲醇溶液,料液比為1∶30,溫度70 ℃,回流提取0.5、1、2、3、4 h。
1.4.1.3 固液比對總黃酮含量的影響
稱取1.00 g 菊芋葉,用體積分數70%的甲醇溶液,溫度70 ℃,按不同固液比(1 ∶5、1 ∶10、1 ∶20、1∶30、1∶40),回流提取1 h。
1.4.1.4 提取溫度對總黃酮含量的影響
稱取1.00 g 菊芋葉,分別用不同的溫度(40、50、60、70、80 ℃),以體積分數70%的甲醇為提取劑,回流提取時間為1 h,固液比為1∶30,
1.4.2 正交試驗設計
根據單因素試驗結果,確定以甲醇體積分數(A)、提取時間(B)、固液比(C)、提取溫度(D)四個因素及其對應的3 個較優水平,選用L9(34)正交設計表進行試驗(表1),優化菊芋葉總黃酮的提取工藝,每個處理三次重復。
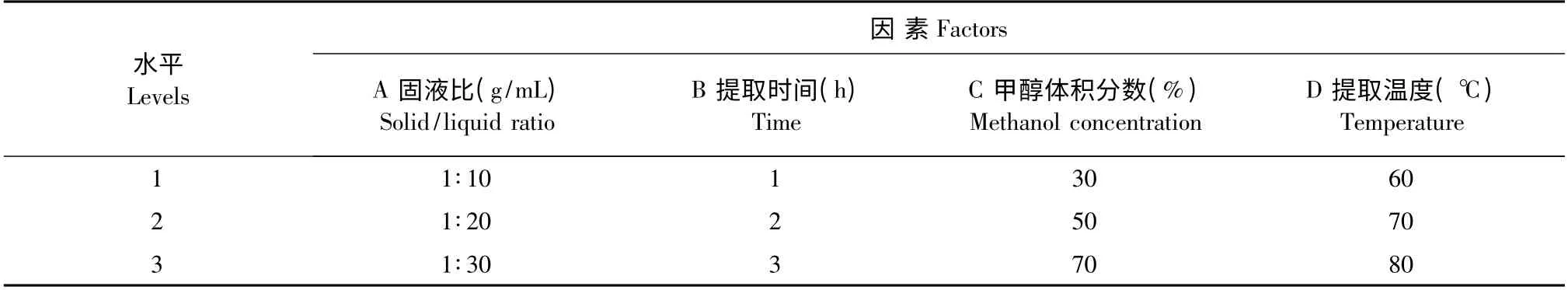
表1 L9(34)因素水平表Table 1 Factors and levels of the test L9(34)
2 結果與分析
2.1 單因素試驗結果
2.1.1 甲醇體積分數對總黃酮含量的影響
隨著甲醇體積分數的增大,提取的總黃酮含量逐漸增加,甲醇體積分數從10%增加到70%時,測得的總黃酮含量從4.36%提高到5.91%,在70%時達到最大,其后隨著甲醇體積分數的增大,測得的總黃酮含量反而降低,造成這種現象可能是由于甲醇體積分數過高時,水溶性黃酮的溶出減少而脂溶性雜質如色素、鞣質等溶出增多,由于雜質與脂溶性黃酮競爭溶劑,從而使黃酮提取量下降[14]。因此甲醇體積分數選70%為宜。
2.1.2 提取時間對總黃酮含量的影響
隨著提取時間的增加,提取的總黃酮含量逐漸增加,提取時間從0.5 h 增加至3 h 時,測得的總黃酮含量由5.16%增加至6.63%,而3 h 過后隨著時間的延長,菊芋葉總黃酮的含量有所下降,這表明不同提取時間對總黃酮含量的影響很大,時間過短,目標成分不能充分溶出,時間太長,則可能造成部分對熱不穩定的黃酮分解損失,使得總黃酮含量下降[15]。因此,提取時間選擇3 h 為宜。
2.1.3 固液比對總黃酮含量的影響
隨著固液比的增加,提取的總黃酮含量逐漸增加,當固液比從1∶5 增加到1∶20 時,測得的總黃酮含量由3.53%增加至5.89%。當固液比為1 ∶20時,提取就可以達到比較好的效果。再增加提取溶劑的量對總黃酮含量增加效果影響不大,考慮到生產成本,固液比以1∶20 為宜。
2.1.4 提取溫度對總黃酮含量的影響
隨著提取溫度的升高,提取的總黃酮含量也逐漸升高,當溫度由40 ℃升高到70 ℃時,測得的總黃酮含量由4.97%增加到6.71%,當溫度升高到80℃時,測得總黃酮含量為6.72%。這是因為隨著提取溫度升高,分子的運動速度增加,滲透和擴散作用增強,使得菊芋葉片中的黃酮類化合物更容易溶出。同時考慮到能耗,選擇70 ℃為宜。
2.2 正交試驗結果
精確稱量干燥的菊芋葉每份1.00g,按表1 的因素水平,用L9(34)正交試驗方法優化菊芋葉總黃酮提取工藝結果見表2,并對試驗結果進行方差分析(表3)。結果表明:四個因素都對總黃酮含量有極顯著影響。其中甲醇體積分數(C)對總黃酮含量影響最大,提取溫度(D)、固液比(A)次之,提取時間(B)影響最小。經極差分析和方差分析確定最佳工藝組合為A3B2C3D3,即用70%甲醇以1∶30 的固液比在80 ℃條件下提取2 h。
2.3 正交優化驗證性試驗
由極差及方差分析得到的最佳提取工藝條件并不在正交試驗表安排的試驗中,需做驗證性實驗。用上述確定的最佳提取工藝條件進行3 次平行實驗,總黃酮含量為7.03%,RSD 0.3%,比3 號試驗的提取率稍高,說明所選取的工藝確為最佳工藝。
2.4 不同采收期菊芋葉總黃酮含量變化
精確稱量不同采收期菊芋葉干粉1.00 g,按正交試驗確定的最佳工藝條件制備供試樣品溶液,按1.3.3 方法測定,每份樣品平行測定3 次。結果如圖1 所示,5~9 月份菊芋葉總黃酮含量呈上升趨勢,9 月份達到最高,11 月份含量下降。
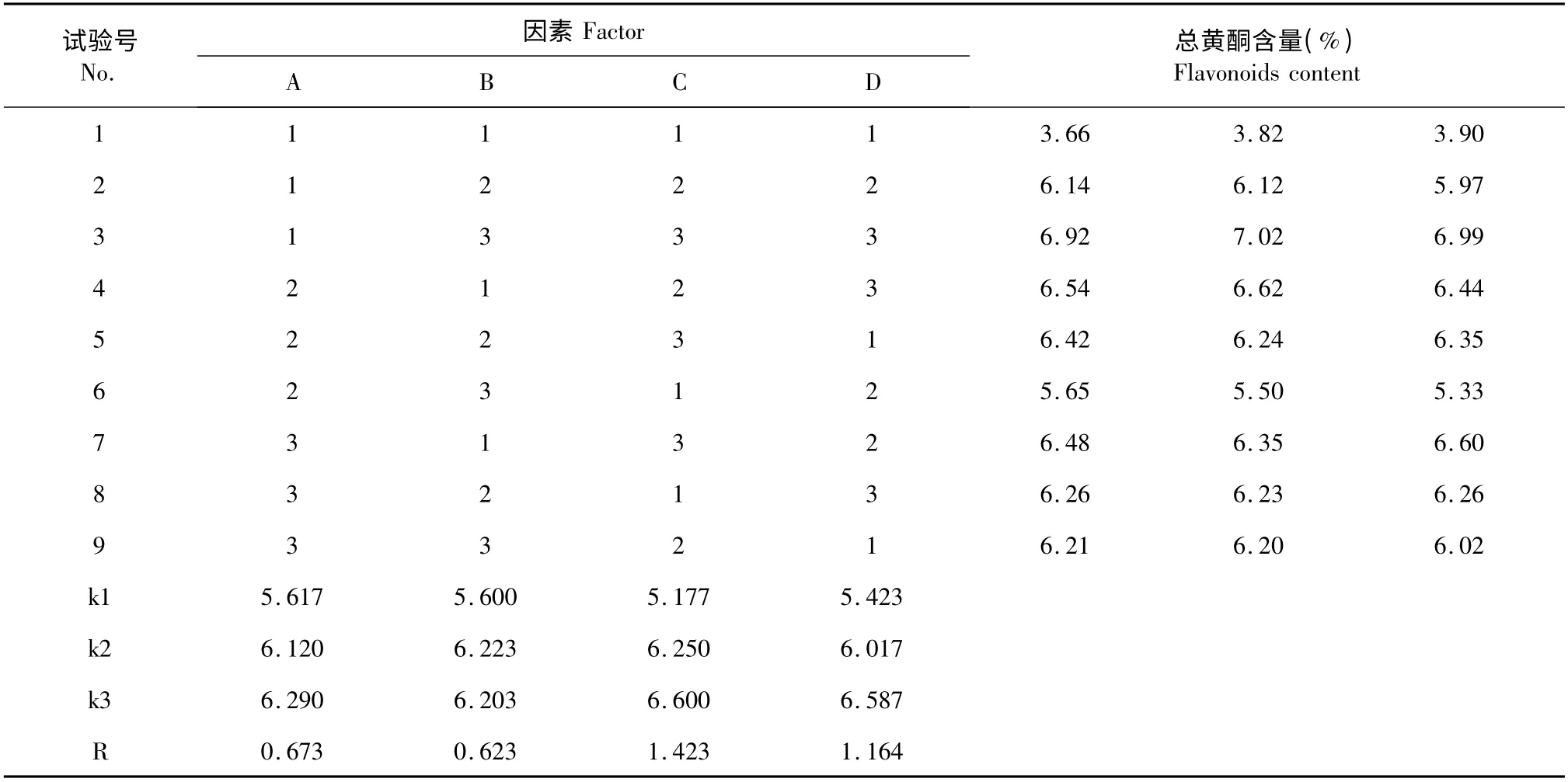
表2 L9(34)正交試驗設計及結果Table 2 L9(34)orthogonal array design arrangement and results
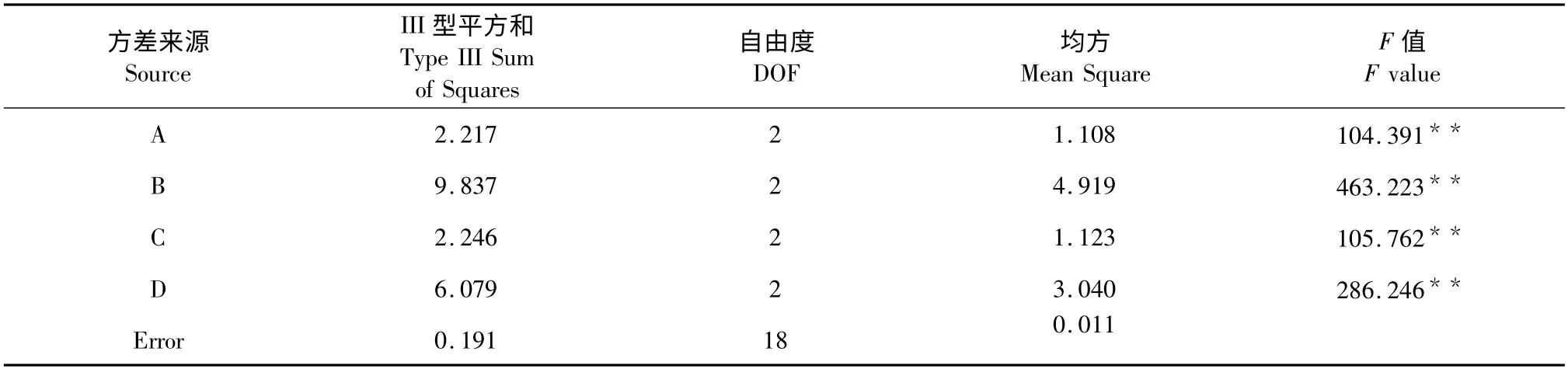
表3 方差分析Table 3 Analysis of variance for the total flavonoids content with different extraction conditions
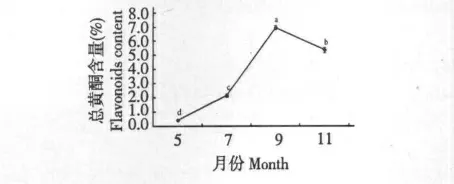
圖1 不同采收時期對總黃酮的影響Fig.1 Total flavonoids content in different harvest time
3 結論
采用單因素及L9(34)正交試驗設計對菊芋葉總黃酮的提取工藝進行了優化,確定菊芋葉總黃酮提取的最佳工藝條件為:選用甲醇體積分數70%、提取溫度80 ℃,固液比1∶30,回流時間2 h 時,總黃酮含量最大。驗證試驗表明,在此條件下,回流提取菊芋葉總黃酮含量可達7.03%。研究為菊芋葉黃酮的開發利用提供了科學依據。
黃酮含量動態變化研究發現,不同季節采摘的菊芋葉其總黃酮含量呈動態積累的趨勢,在9 月份最高,于11 月份下降。通過對菊芋葉總黃酮含量的動態監測,可確定其最佳的采收時間為9 月份。
1 Tian HT(田洪濤),Zhong K(種克),Ma W(馬雯),et al.The optimization of reproducible Jerusalem artichoke juice medium for bifidobacteria.J Chin Ins Food Sci Technol (中國食品學報),2007,7(4):38-41.
2 Lv YG(呂躍鋼),Ma JJ(馬家津),Gu TC(顧天成). The study on ethanol fermentation by immobilized inulinase and yeast cell using inulin as raw material.Food Ferm Ind (食品與發酵工業),2003,29(5):66-68.
3 Bai M(白妹),Sun Y(孫彥),He LZ(何利中). Ion exchange column prepared by hydrolysis of high fructose syrup from Jerusalem artichoke. Food Sci (食品科學),1999,2:31-33.
4 Liu HW(劉海偉),Liu ZP(劉兆普),Liu L(劉玲),et al.Studies on the antifungal activities and chemical components of extracts from Helianthus tuberosus leaves. Nat Prod Res Dev (天然產物研究與開發),2007,19:405-409.
5 Gao JM(高錦明). Phytochemistry (植物化學). Beijing:Science Press,2003:191-193.
6 Wu XY(吳小勇),You G(游耿),Yang GM(楊公明).Study on the extraction condition and antioxidant activity of total flavonoids in Mungbean skin.Food Ferm Ind(食品與發酵工業),2010,36:214-216.
7 Edward E.Schilling.Flavonoids of Helianthus series Angustifolii.Biochem Sys Ecol,1983,11:341-344.
8 Edward E Schilling,Jose L Panero,Timothy A.Storbeck.Flavonoids of Helianthus series Microcephali.Biochem Sys Ecol,1987,15:671-672.
9 Edward E Schilling,Tom J Mabry. Flavonoids of Helianthus series Corona-solis.Biochem Sys Ecol,1981,9:161-163
10 Werner Herz,Narendra Kumar. Sesquiterpene lactones from Helianthus grosseserrats.Phytochemistry,1981,20:99-104.
11 Ohno S,Tomita-Yokotani K,Kosemnura S. A species-selective allelopathic substance from germinating sunflower(Helianthus annuus L.)seeds. Phytochemistry,2001,56:577-581.
12 Macias F A,Molinillo J,Torres A,et al.Bioactive flavonoids from Helianthus annuus cultivars. Phytochemistry,1987,45:683-687.
13 Du FY(杜芳艷),Fu KQ(付凱卿). Study on total flavonoids contents in peanut vines of different plant organs.Food Sci (食品科學),2008,29:137-140.
14 Chen ND(陳乃東),Zhou SB(周守標),Wang CJ(王春景),et al. Study on flavonoids extraction and function of scavenging hydroxy free radical from Lespeda. dunnii. Food Sci (食品科學),2007,28:86-91.
15 Li RL(李瑞麗),Qiao WZ(喬五忠),Wang YH(王艷輝),et al.The extraction of grape seed proanthocyanidin using ulrasonic wave. Food Res Dev(食品研究與開發),2006,27(2):64-66.

