豬細小病毒和豬圓環病毒2 型多重PCR檢測方法的建立與應用
樊振華,王娟萍,孟 帆,吳 忻,劉文俊,米瑞娟,姚敬明,程海龍
(1.山西省農業科學院畜牧獸醫研究所,山西太原030032;2.太谷縣畜牧中心,山西太谷030800)
豬圓環病毒2 型(PCV2)、豬細小病毒(PPV)是導致豬繁殖障礙病的主要病原體。其中,豬圓環病毒(PCV)是1974 年德國學者發現的新病毒[1],1982 年命名為豬圓環病毒。PCV 有PCV1和PCV2 這2 種血清型。PCV2 具有較強的致病性,其經鼻、口腔侵入不同日齡的豬體內,在扁桃體局部淋巴結增殖后,向其他淋巴組織、肺、肝、腎傳播,懷孕母豬感染后,經胎盤垂直感染給仔豬,初產母豬和新豬群產生繁殖障礙;PCV2 可引起斷奶仔豬多系統衰竭綜合征(PMWS)以及增生性壞死性肺炎、皮炎和腎病綜合征、仔豬先天性震顫,該病多發生于5~12 周齡的仔豬。豬群患病率3%~50%,死亡率8%~35%,該病發展緩慢,豬群一次發病可持續12~18 個月。
豬細小病毒(PPV)于1967 年首次報道[1-2]。母豬初產或首次感染者會發生流產、死胎,仔豬大量死亡,育成豬發生皮炎、腹瀉、關節炎,豬場一旦感染,3 個月內100%感染,會造成80%~100%死亡,感染豬很長時間帶毒、排毒。這2 種疾病在臨床上呈現出相似的癥狀,又常常發生混合感染,使臨床診斷非常困難,必須依靠實驗室檢測技術進行鑒別診斷[3]。
以往的血清學診斷準確率低,病毒分離診斷方法雖然準確,但操作復雜,費時、費力。多重PCR 技術是在同一PCR 體系中加入多對引物,對多個目的基因同時進行擴增的分子生物學診斷方法,具有快速、敏感、特異、易于操作的優點,可用一個樣品同時檢測多種病原體或多個基因型,達到對多種疾病的同步診斷,進而縮短檢測時間,減少試劑消耗。王宏魁等[4]曾建立了檢測PCV2 和PCV1 的多重PCR 方法,周海范等[5]曾建立了檢測PRRSV,PCV2 的多重PCR 方法。
本試驗利用多重PCR 技術對PPV 和PCV2進行了檢測研究,建立同時快速鑒別診斷這2 種病毒的方法,并應用于臨床實踐中,初步查明了山西這2 種豬病毒的感染情況。
1 材料和方法
1.1 病毒株、組織病料、陽性對照
豬細小病毒株(PPV)、豬圓環病毒2 型毒株(PCV2)由軍事醫學科學院軍事獸醫研究所提供,2 種病毒PCR 陽性對照由北京世紀元亨動物疫病防疫技術有限公司提供,臨床組織病料是山西省農科院畜牧獸醫研究所動物基礎醫學研究課題組從疑似病豬體內采集。
1.2 主要試劑和引物
1.2.1 試劑 TaKaRa Ex Taq Taq DNA 聚合酶、DNA Marker DL 2 000 等試劑購自寶生物工程(大連)有限公司,病毒DNA 抽提試劑盒、PPV 和PCV2 病毒單項PCR 診斷試劑盒購自北京世紀元亨動物疫病防疫技術有限公司。
1.2.2 引物設計與合成 通過計算機網站(http://www.ncbi.nlm.nih.gov/)查找出PPV,PCV2 的基因序列,利用Primer Premier 5.0 軟件按照引物設計原則,最后選擇PPV 的VP2 基因、PCV2 的ORF2 基因為其擴增靶序列[6],借助計算機篩選設計出符合多重PCR 要求的2 對引物,引物由寶生物工程(大連)有限公司合成(表1)。

表1 多重PCR 引物
1.3 試驗方法
1.3.1 病毒模板DNA 的提取
1.3.1.1 病料采集與處理 取病、死豬有明顯病變與健康部交界處的淋巴結、扁桃體、脾臟、肺、肝、腎等組織,-70 ℃保存。
1.3.1.2 病毒模板DNA 的提取(按總DNA 抽提試劑盒操作步驟進行) (1)稱取待檢病料0.1 g置組織研磨器中剪碎并研磨,加入1.5 mL PBS(pH 值7.2)繼續研磨成勻漿后,8 000 r/min 離心5 min,取其上清液100 μL,加入500 μL 消化液、10 μL 蛋白酶K 混勻,置55 ℃水浴中過夜。病毒細胞液、血清、陽性對照液、陰性對照液(滅菌去離子水)可直接取100 μL,加入500 μL 消化液、10 μL 蛋白酶K 混勻,置于室溫下10 min。(2)從水浴鍋中取出樣品,加入酚300 μL(用前不要晃動,不要吸到上層保護液)、氯仿/異戊醇混合液(24/1)300 μL,顛倒10 次,12 000 r/min 離心10 min。(3)取500 μL 上清液置于滅菌離心管中,加入500 μL 異丙醇混勻,置液氮中3 min 或-70 ℃冰箱中30 min。取出樣品管,室溫下融化,13 000 r/min 離心15 min。(4)棄上清,倒扣在衛生紙上吸干(1 min),沿管壁緩緩加入1 mL 75%乙醇(凍存),13 000 r/min 離心15 min。(5)棄上清,倒扣在吸水紙上吸干(1 min),再將離心管開口置50 ℃恒溫金屬浴中15 min 或真空抽干15 min(以無乙醇為準)。(6)取出樣品管,用30 μL 滅菌去離子水溶解沉淀,模板-20 ℃保存備用。
1.3.2 單相PCR 檢測方法的建立 分析測定PCR 反應最適條件,包括退火溫度、引物濃度、MgCl2濃度等因素[7],首先確定每種病毒單相PCR反應最佳條件。
1.3.3 多重PCR 檢測方法的建立 在單相PCR的基礎上,進行多重PCR 試驗,其反應總體積、各引物和試劑的劑量不變,各模板比例按等劑量加入,減少滅菌雙蒸水的用量,擴增條件統一以退火溫度較低的循環參數為準,試驗結果較好[8]。
1.3.4 PCR 檢測敏感性試驗 將提取的2 種病毒DNA 模板,用Gene Quant Ⅱ核酸定量儀測定其含量,然后將2 種病毒模板分別進行10 倍系列稀釋,各取1 μL,按照優化的PCR 反應條件進行PCR 檢測,以其模板最高稀釋倍數擴增呈陽性為其PCR 的敏感度。
1.3.5 PCR 特異性試驗 將病料作DNA 提取后,用多重PCR 檢測方法,擴增體系中加入2 種被檢測病毒的引物與DNA 模板,同時設豬瘟病毒(CSFV)、豬流感病毒(SIV)及陰性對照,按以上條件進行相同的PCR 擴增。
1.3.6 PCR 產物檢測 采用1.5 g/L 瓊脂糖凝膠,PCR 產物15 μL,與上樣緩沖液3 μL 混合加樣,用TAE 電泳緩沖液,電壓5 V/cm,單相PCR電泳30 min;多重PCR 電泳40 min,紫外凝膠成像系統中觀察結果并拍照、記錄。
1.3.7 自然感染病料的檢測 用建立的多重PCR 方法,與北京世紀元亨動物疫病防疫技術有限公司提供的2 種病毒PCR 檢測試劑盒,對采集的82 份病料進行2 種病毒的單相PCR 檢測與多重PCR 檢測對比試驗,以多重PCR 檢測陽性數與單相PCR 檢測陽性數之比為其二者的陽性符合率。
1.3.8 臨床樣品檢測應用試驗 從10 個發病豬場和門診病例的病豬無菌采血樣,分離血清于1.5 mL 離心管中-70 ℃保存備用。剖檢病死豬取有明顯病變與健康部交界處的淋巴結、扁桃體、脾臟、肺、肝、腎等組織,-70 ℃保存。共收集血樣和病料211 份。
2 結果與分析
2.1 單相PCR 檢測擴增結果
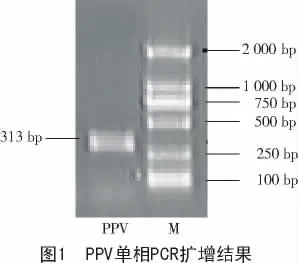
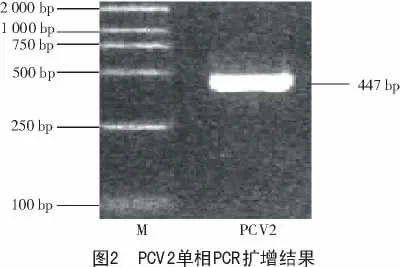
按照2 種病毒單相PCR 優化后的反應條件,分別進行PCR 擴增,結果如圖1、圖2 所示。
2.2 多重PCR 反應條件的優化結果
多重PCR 反應條件為總體積20 μL:MgCl2(150 μmol/L)2 μL,dNTP(2.5 mmol/L)2 μL,10×PCR Buffer 2 μL,2 種病毒的上下游引物混合液各2 μL(每條引物濃度10 pmol/mL),2 種病毒模板各2 μL,Taq 酶(0.5 U/μL)2 μL,滅菌雙蒸水4 μL。
多重PCR 的擴增條件:94 ℃3 min;94 ℃30 s,55 ℃30 s,72 ℃30 s,循環35 次;72 ℃延伸7 min。
2.3 PCR 敏感性試驗結果
測定出所用模板的DNA 含量是:PPV 為16 ng/μL,PCV2 為19 ng/μL;10 倍稀釋2 種病毒模板后,分別進行100~10-5的單相PCR 與多重PCR 擴增,結果如表2 和圖3 所示。

表2 PCR 敏感性結果

由表2 可知,多重PCR 比單項PCR 病毒的最低核酸檢測量降低了約100.5~102個數量級,但仍然具有很強的敏感性,達到了pg(微微克,10-12g)級別,表明建立的多重PCR 反應具有很高的敏感性。
2.4 多重PCR 特異性試驗結果
經過一次擴增,可檢測出多重PCR 相應病毒的特異條帶,目的基因全部擴出,CSFV,SIV,陰性對照全部為陰性,而且無交叉反應。多重PCR重復性及特異性與單相PCR 結果完全一致。
2.5 多重PCR 對自然感染病料的檢測結果
單相PCR 與多重PCR 的陽性符合率平均為100%,建立的多重PCR 檢測方法具有良好的特異性和重復性,診斷條帶清晰、無交叉反應,在臨床診斷中準確率可達98%以上,可用于臨床診斷。
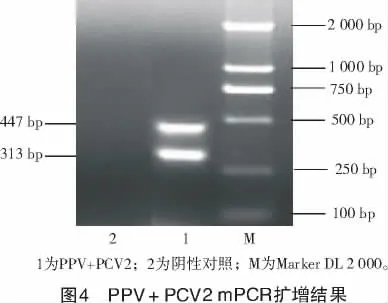
PPV+PCV2 mPCR 擴增結果如圖4 所示。
2.6 臨床樣品檢測結果
211 份樣品中檢出豬圓環病毒2 型(PCV2)陽性56 份,陽性率為27%;豬細小病毒病(PPV)陽性42 份,陽性率為20%;二者混合感染17 份,陽性率為8%(圖5 和表3)。

表3 多重PCR 檢測PPV,PCV2 病原結果
3 結論與討論
(1)在建立多重PCR 體系中,引物的設計是關鍵,經分析PPV,PCV2 基因組信息后,在單相PCR 引物的基礎上,設計出了適于多重PCR 的2 對引物。利用2 對特異性引物,在一次PCR 中擴增出豬細小病毒(313 bp)、豬圓環病毒2 型(447 bp)的特異性片斷,成功地建立了PPV,PCV2 的多重PCR 檢測方法,試驗證實了該方法特異性強、敏感性高和重復性好,可節省40%的檢測成本和時間,適用于臨床鑒定豬細小病毒和圓環病毒2 型,為鑒定這2 種豬病毒提供了一種準確、快速的技術手段。
(2)應用山西省農科院畜牧獸醫研究所動物基礎醫學研究課題組建立的多重PCR 檢測技術,在211 份樣品中檢測出豬圓環病毒2 型陽性56 份,感染率為27%;豬細小病毒陽性42 份,感染率為20%;二者混合感染陽性17 份,混合感染率為8%。證明山西豬群已比較嚴重地感染了這2 種疫病,今后應加強防疫免疫等綜合措施。
(3)在我國,PCV2 和PPV 造成的豬繁殖障礙最為普遍和嚴重,特別是這2 種病原常混合感染;病毒既可水平傳播,又可垂直傳播;可以引起70%以上的初產母豬發生流產、產死胎、弱仔,仔豬死亡,免疫抑制等危害,造成巨大的經濟損失。現在豬細小病毒和圓環病毒2 型疫苗已經在生產中廣泛應用,通過大家不懈的努力,一定能夠有效地控制這2 種病毒的流行。
[1]Barbara E Straw,Syilvie D’Allaire.豬病學[M].趙德明,張仲秋,沈建忠,譯.8 版.北京:中國農業大學出版社,2003.
[2]殷震.動物病毒學[M].北京:科技出版社,1985:810-814.
[3]王澤洲,于勇,吳越,等.豬生殖障礙疾病的研究概況[J].中國獸醫科技,2007,37(9):823-826.
[4]王宏魁,彭志鋒,孫彥婷,等.豬圓環病毒復合PCR 檢測方法的建立及應用[J].河南農業科學,2009(1):109-111.
[5]周海范.豬繁殖與呼吸綜合征、豬圓環病復合PCR 診斷方法的建立及應用[J].河南農業科學,2007(1):106-109.
[6]孫明,李衛紅,高顯明,等.應用多聯PCR 對引發豬繁殖障礙有關病毒的檢測1.JEV,PPV,PRRSV,PRV 多聯PCR 引物設計[J].中國獸醫學報,2000,20(1):10-14.
[7]Joseph Sambrook,David W Russell.分子克隆實驗指南[M].黃培堂,譯.3 版.北京:科學出版社,2005:698-699.
[8]趙麗,崔寶安.豬偽狂犬病病毒及豬細小病毒復合PCR 檢測方法的建立[J].華北農學報,2009,24(2):206-209.

