早春短命植物綿果薺無菌苗組織培養相關因素研究
曼蘇爾·那斯爾,譚敦炎,廖 康
(新疆農業大學,新疆 烏魯木齊830052)
短命植物是生長在干旱荒漠地帶的一類生活周期或年生長期很短的特殊植物類群的總稱[1-4]。我國短命植物僅分布于新疆北部荒漠及其毗鄰的草原帶[5],是新疆北部地區沙漠穩定沙面的主要貢獻者和沙漠受干擾破壞后植被恢復的先鋒植物[6]。短命植物是光合效率高、物質積累快、營養周期短的植物資源,是一類優良的春季牧草[7]。綿果薺(Lachnolomalehmannii)隸屬于十字花科綿果薺屬,分布于亞洲中部,在我國僅分布于新疆北部準噶爾荒漠。每年4月上旬種子開始萌發,5月上旬進入花期,6月上旬進入果熟期,生活周期為60~70d,是典型的一年生早春短命植物[8]。該物種具有生活周期短、萌發期早、染色體數少(2n=2x=14)、較強的抗鹽、耐旱及耐高溫等特性,是一種潛在的特殊遺傳資源,可作為模式植物的篩選物種。因而,其組織培養再生體系的建立對于從細胞水平探討該物種對準噶爾荒漠環境適應的機制和演變規律具有重要的理論價值,并對采用現代生物技術開發特殊遺傳資源和保存種質具有十分重要的意義。無菌苗的獲得是植物生物技術尤其是組織培養的首先步驟和關鍵技術。但目前為止,該物種的此類研究尚未見報道。綿果薺種子自然萌發率低、植株矮小、全身著生綿毛等的生理和形態特征,給外植體消毒帶來不便。本試驗以綿果薺種子為研究材料,研究無菌苗獲得的相關因素,以期探索高效且穩定的消毒方法和培養條件,為綿果薺植株再生體系的建立提供技術基礎。
1 材料與方法
1.1 試驗材料 2008年6月,在新疆阜康彩南的自然種群(44°22′24.7″N,88°08′30.1″E,海拔459 m)采集成熟的綿果薺果實,在室溫(25℃)下貯藏備用。
阜康彩南位于新疆準噶爾盆地東部沙漠覆蓋區,進入古爾班通古特沙漠腹地,受西風帶及北冰洋水汽的影響,是內陸冷荒漠,典型的溫帶荒漠氣候。年平均氣溫為6.4℃,最高溫為40.9℃,最低溫為-40.3℃,年降水量為134.3mm,年潛在蒸發量1 965mm,無霜期175d[9]。
1.2 方法
1.2.1 種子表面消毒處理 流水沖洗種子15min后,在無菌條件下無菌水清洗4次,設置31種不同的消毒方法處理(表1),再用無菌水清洗4次,接種到 MS[10]培養基上,在溫度為(25±1)℃、全黑暗中培養3d后轉入16h·d-1光下進行培養,14d后進行統計分析。
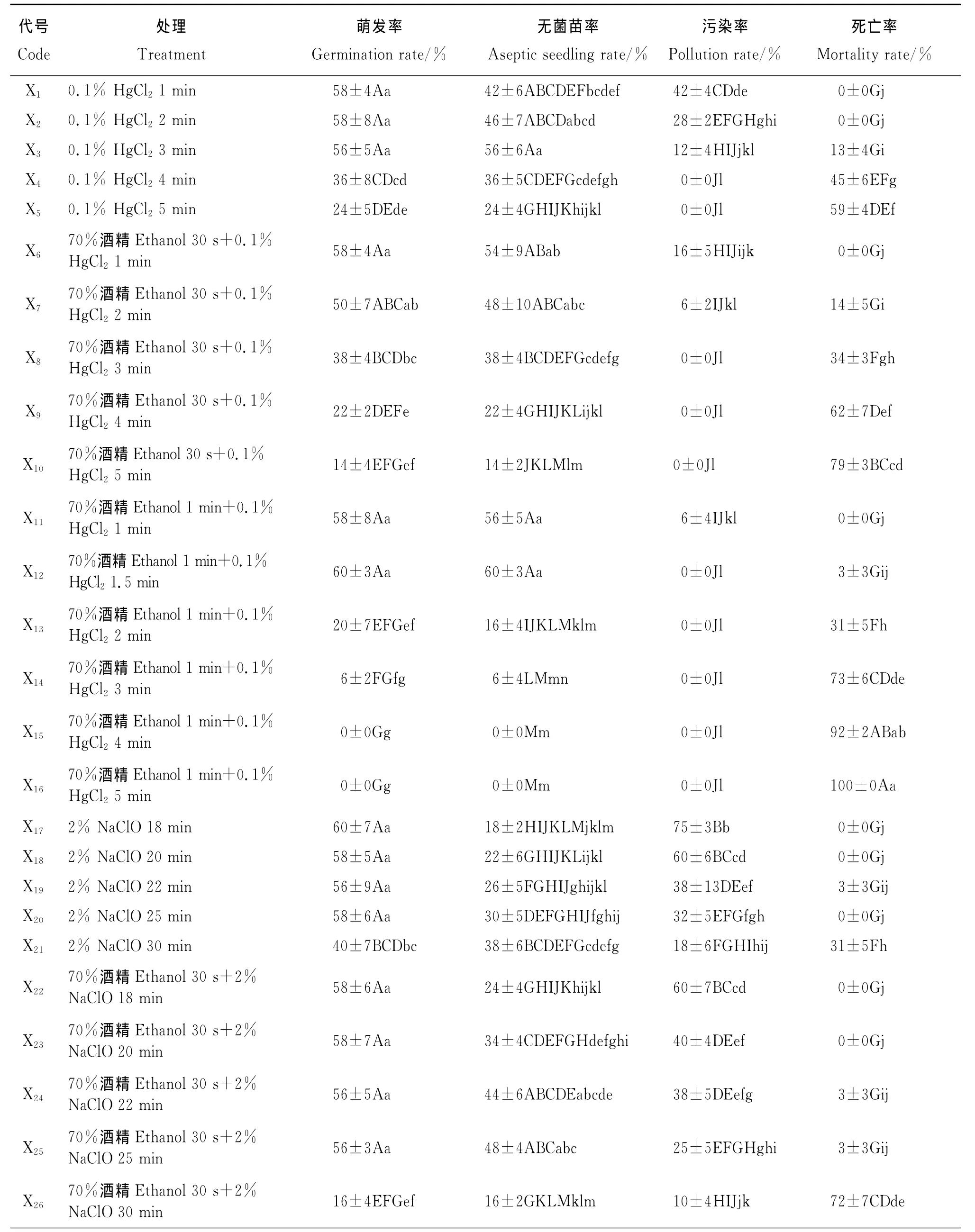
表1 不同消毒處理對綿果薺種子發芽率和污染率的影響Table 1 Effects of different disinfection methods on seed germination and pollution rate of Lachnoloma lehmannii
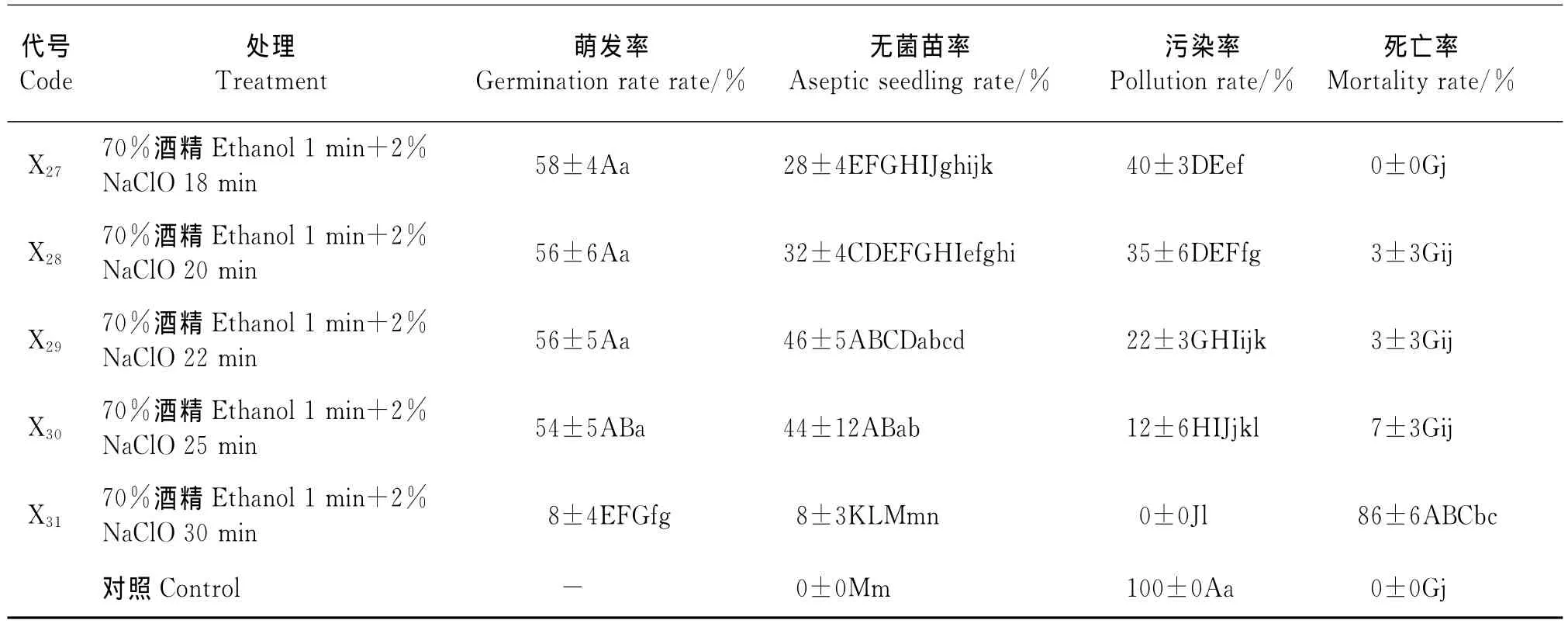
續表1
1.2.2 消毒前流水沖洗的影響 種子分別用流水沖洗處理0min、1~2min(W1)、10min(W2)、20min(W3),并用X12方法進行消毒后接種到MS培養基上培養14d(表1),培養條件同1.2.1。
1.2.3 光照對種子萌發和幼苗生長的影響 種子經W1方法流水沖洗和X12方法表面消毒后接種到MS培養基上,全黑暗培養0、3、6、10和14d,處理后再轉至光照周期下培養。14d后進行統計分析,培養溫度均為(25±1)℃,光照培養的光周期為16h·d-1。
1.2.4 培養溫度對種子萌發率和幼苗生長的影響同樣方法種子消毒后接種于MS培養基上,置于對照(25℃±1℃)、T1(15℃/5℃)、T2(20℃/10℃)和T3(25℃/15℃)4種不同溫度的光照培養箱內進行14d的培養。光周期為16h·d-1,光照強度均為2 000lx。
1.2.5 植物生長調節劑對種子萌發和幼苗生長的影響 將種子15min流水沖洗和X12方法消毒后,接種于對照(無生長調節劑的 MS)、GR1(MS+0.5 mg·L-1IBA)、GR2(MS+1.0mg·L-1IBA)、GR3(MS+1.0mg·L-1IBA+0.1mg·L-1BAP)、GR4(MS+1.0mg·L-1IBA+0.2 mg·L-1BAP)和GR5(MS+1.0mg·L-1IBA+0.5mg·L-1BAP)5種培養基上,在溫度為(25±1)℃、光周期為16h·d-1的培養室內進行14 d的培養。
1.2.6 培養方式的篩選 種子W1方法流水沖洗和X12方法表面消毒后接種到MS基本培養基上,并在變溫為15℃/5℃(白天/晚上)、光照為16h·d-1的培養箱培養5d,種子萌發后轉移到溫度為(25±1)℃、光照為16h·d-1的培養室內培養;對照始終在(25±1)℃、光照為16h·d-1的培養室內培養,14d后比較幼苗生長情況。
1.3 觀察與測定
1.3.1 種子萌發和污染狀況的觀察 種子接種48h后開始觀察,隔24h記錄該天萌發瓶數、該天萌發外植體數目、種子起始萌發(胚根露白至胚根伸長0.05 cm)的天數和持續的天數,并記錄污染瓶數和污染外植體數目及其持續天數等指標。培養到第14天后統計種子萌發率、無菌苗率、污染率和死亡率等指標。
1.3.2 幼苗生長的觀察和測定 萌發到第14天后測定子葉、下胚軸和根的鮮質量及子葉面積、下胚軸和根的長度等指標。子葉面積用葉形紙稱量法測定[11]。
1.4 數據處理 試驗中同一個處理為5瓶,每瓶接種10粒種子,重復3次。數據采用SPSS 16.0軟件進行分析和繪圖。
2 結果與分析
2.1 不同消毒劑和消毒方法對種子消毒效果的影響 不同處理種子萌發起始時間無明顯差異,均為3~5d,但細菌的發生時間不同,在幼苗后期也出現長菌現象(表1),31種消毒方法中,單獨使用NaClO或HgCl2的消毒效果比與酒精配合使用的明顯要差。NaClO和HgCl2兩種消毒劑中,雖然NaClO與酒精配合處理外植體的死亡率較低,種子初始萌發率較高,但其消毒效果不徹底,出現外植體和幼苗后期發霉。隨著消毒時間的延長,雖然其污染率開始下降,但同時死亡率也呈直線上升趨勢,因此獲得無菌苗率仍然很低。NaClO和酒精的配合中消毒效果較好的為X25,14d后該處理的無菌苗率為48%、種子萌發率為56%、污染率為25%、死亡率為3%。雖然種子對HgCl2與酒精配合消毒的反應較敏感,不同處理時間的消毒效果差異顯著,但該配合的消毒效果徹底,無菌苗率高。HgCl2與酒精配合處理中處理X12的消毒效果最好,也是本試驗中最理想的配合。該處理的無菌苗率為60%、種子萌發率為60%、污染率為0、死亡率為3%;其次為X11。而無消毒處理(對照)的外植體第2天開始細菌生長至第5天徹底污染(100%),無法記錄種子萌發率。
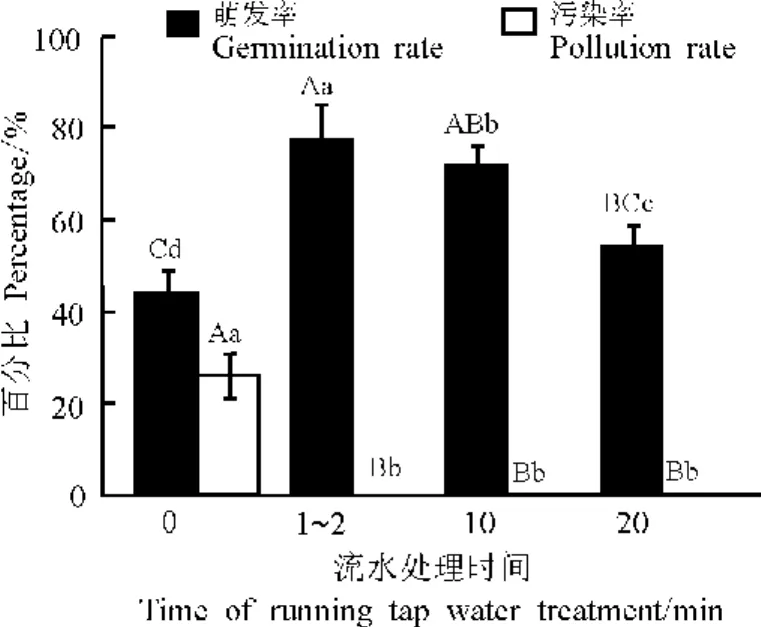
圖1 流水處理對綿果薺種子萌發和污染的影響Fig.1 Effects of running tap water treatment on seed germination and pollution rate of Lachnoloma lehmannii
2.2 流水處理對種子消毒效果的影響 不同處理中種子萌發起始時間無明顯差異,均為3~5d。污染的外植體出現在3~7d。自來水處理的外植體污染率明顯低于對照(圖1),二者間存在極顯著差異(P<0.01),即對照的污染率為26%,處理的外植體污染率均為0。自來水處理的種子萌發率極顯著高于對照,隨著自來水沖洗時間的延長種子萌發率呈下降的趨勢,培養到第14天后處理W1的最后萌發率最大,為78%,比對照高34%。
2.3 光照對種子萌發率和幼苗生長影響 在黑暗條件下種子萌發起始時間推遲(第4-7天),持續時間較長(3~4d),到第14天未出現真葉。光照條件下種子萌發起始時間較早(2~4d),持續時間較短(2~3d),真葉發生也較早(11~13d)。不同的全黑暗處理種子萌發率有極顯著差異(P<0.01)。隨著全黑暗天數的延長種子萌發率呈下降趨勢(圖2),14d培養后對照的種子萌發率為73%,比14d全黑暗處理的高40%。
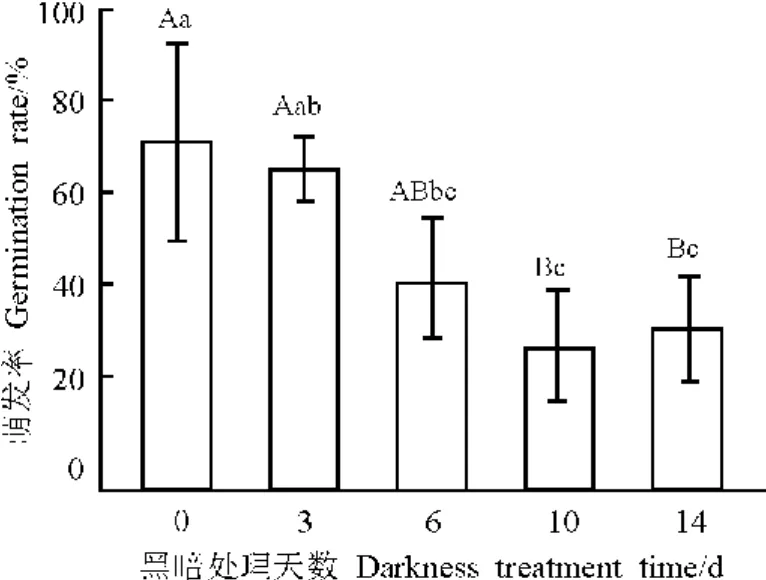
圖2 黑暗培養對綿果薺種子萌發的影響Fig.2 Effects of darkness culture on seed germination rate
不同處理的無菌苗子葉面積有極顯著差異(P<0.01)。隨著黑暗處理天數的延長子葉面積呈下降趨勢。培養14d后對照(暗處理天數為0d)的子葉面積為0.8cm2,是14d黑暗處理的2.5倍(圖3)。同樣隨著黑暗處理天數的延長子葉鮮質量也呈現下降趨勢。不同處理間差異極顯著(P<0.01)。對照子葉鮮質量為35mg,是14d黑暗處理的2.5倍(圖3)。不同處理的無菌苗下胚軸長度也有極顯著差異(P<0.01),下胚軸長度隨著黑暗培養天數的延長大致呈上升趨勢。14d黑暗處理的無菌苗下胚軸長度為4.4cm,是對照的1.95倍(圖3)。同樣下胚軸鮮質量也隨黑暗處理天數的延長呈上升趨勢,不同處理間差異極顯著(P<0.01),14d黑暗處理的下胚軸鮮質量為76mg,是對照的2.1倍(圖3)。不同處理的無菌苗根長度有極顯著差異(P<0.01)。隨黑暗處理天數的延長,根長呈上升趨勢,14d黑暗處理的無菌苗根長度為16.4cm,是對照的1.95倍(圖3)。無菌苗根鮮質量隨黑暗處理天數的延長呈下降趨勢,不同處理的根鮮質量有顯著差異(P<0.05)。對照的胚根鮮質量為25mg,是14d黑暗處理的2.4倍(圖3)。
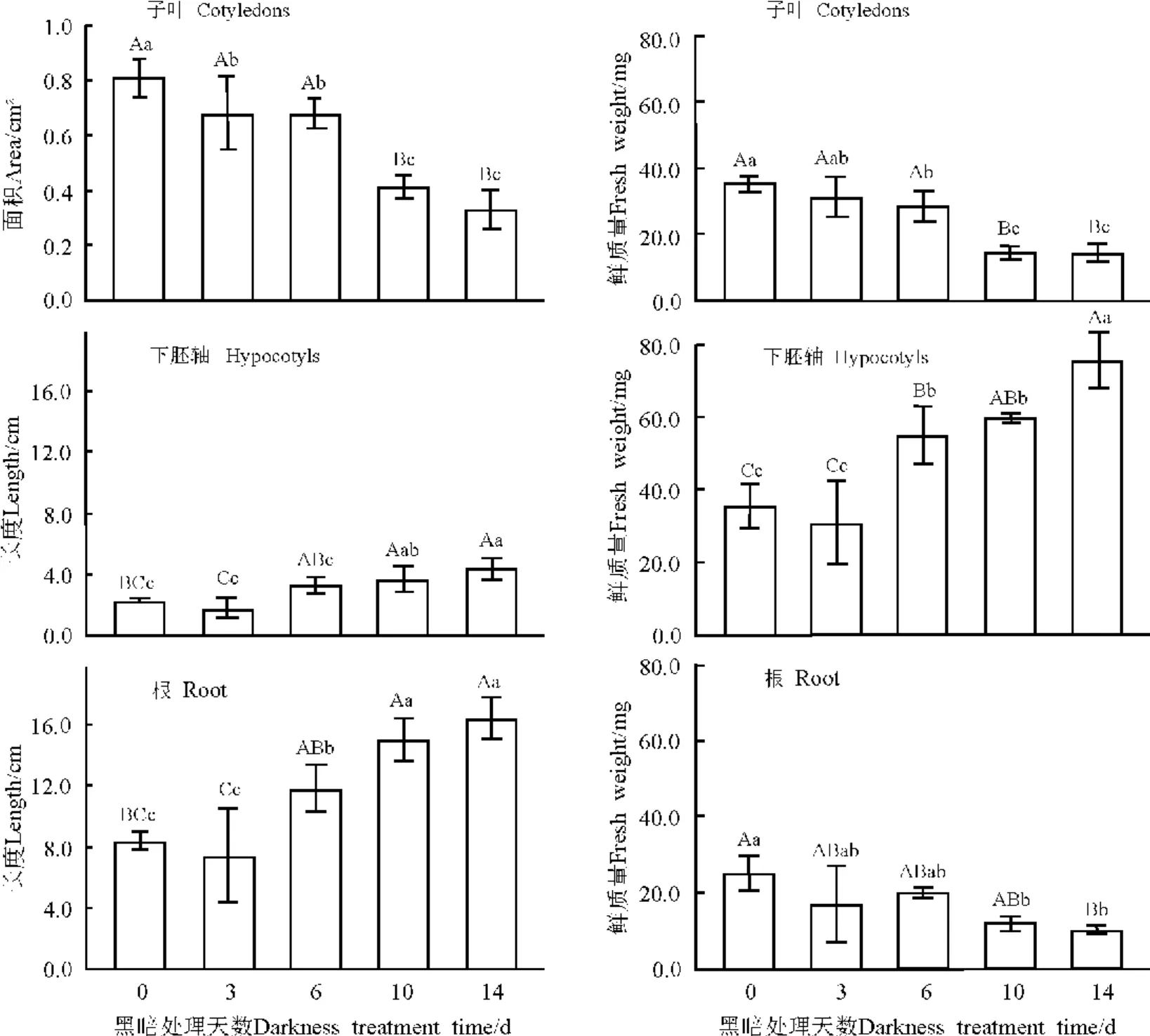
圖3 黑暗培養天數對綿果薺幼苗生長的影響Fig.3 Effects of time of darkness culture on the seedling growth
2.4 溫度對種子萌發和幼苗生長的影響 不同溫度下種子萌發起始的早晚和幼苗生長勢有一定的差異。處理T1的種子萌發起始時間為4~6d,培養到14d未出現真葉。與對照的幼苗相比,處理T1的株高較矮、子葉面積較小、整株顏色較深。處理T2和T3與對照的種子萌發起始時間和幼苗生長勢無顯著差異,萌發起始時間均為3~5d。對照和T3在第11-13天開始發生真葉。不同溫度處理的種子萌發率之間無顯著差異(P>0.05)(圖4)。對照與T2和T3處理間種子萌發率無顯著差異,但與處理T1間顯著差異(P<0.05),14d后處理T1的最后種子萌發率達到了90%,比對照種子萌發率高16%。
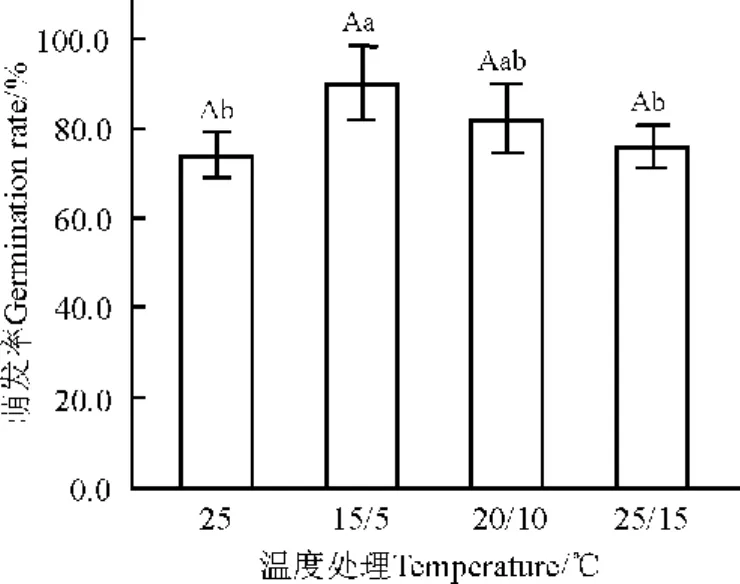
圖4 溫度對綿果薺種子萌發的影響Fig.4 Effects of temperature on seed germination
2.5 植物生長調節劑對種子萌發和幼苗生長的影響 生長素的單獨使用(GR1、GR2)對種子萌發無明顯影響,而生長素與細胞分裂素配合使用有顯著影響,隨著細胞分裂素質量濃度的提高,種子萌發率呈下降趨勢(圖5)。處理GR3的種子萌發率達到了83%,比對照高23%。
不同處理間子葉面積有極顯著差異(P<0.01)。生長素單獨使用的子葉面積均明顯小于對照。而生長素與細胞分裂素配合使用的子葉面積均明顯大于對照。處理GR3的子葉面積最大,為1.21 cm2,是對照的1.6倍。但是,隨著配合使用的細胞分裂素質量濃度的提高子葉面積呈下降趨勢(圖5)。
生長素單獨使用對綿果薺無菌苗下胚軸長度無顯著影響(圖6)。與生長素配合使用的細胞分裂素的不同質量濃度處理之間雖然無顯著差異,但下胚軸長度明顯小于對照,對照的下胚軸長為2.3cm,是處理GR5的2.9倍。
不同處理和對照的無菌苗根長的變化趨勢表現為對照>生長素單獨使用>生長素和細胞分裂素配合使用,彼此間存在極顯著差異(P<0.01)。不同質量濃度生長素的單獨處理之間無顯著差異,但與對照相比差異極顯著,對照的根長度為8.39cm,是GR2的1.9倍。生長素配合使用的細胞分裂素的不同質量濃度處理之間也無顯著差異,但與對照相比差異極顯著,對照的下胚軸長度為GR5的9.7倍(圖6)。
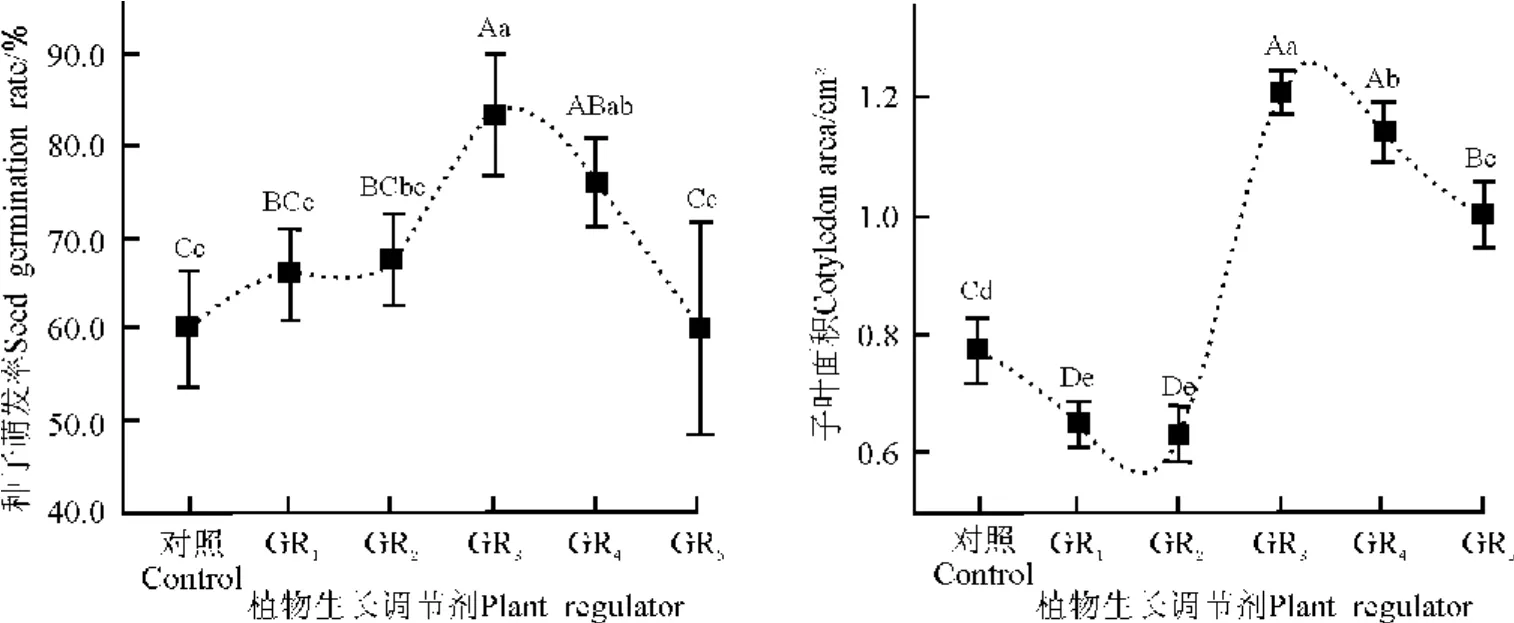
圖5 植物生長調節劑對綿果薺種子萌發和子葉面積的影響Fig.5 Effects of plant growth regulator on seed germination and cotyledons area
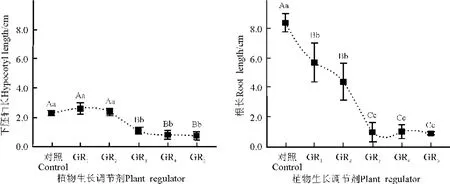
圖6 植物生長調節劑對綿果薺幼苗下胚軸和根長的影響Fig.6 Effects of plant growth regulator on fresh weight of seedling hypocotyl and root
2.6 培養方式的篩選 觀察得知,將種子先放在變溫15℃/5℃、光照為16h·d-1的培養箱培養5 d,種子萌發后轉移到溫度為(25±1)℃、光照為16 h·d-1的室內培養的種子萌發起始時間比對照遲1 d,但是種子萌發率卻明顯高于對照,且幼苗生長較整齊(圖7)。
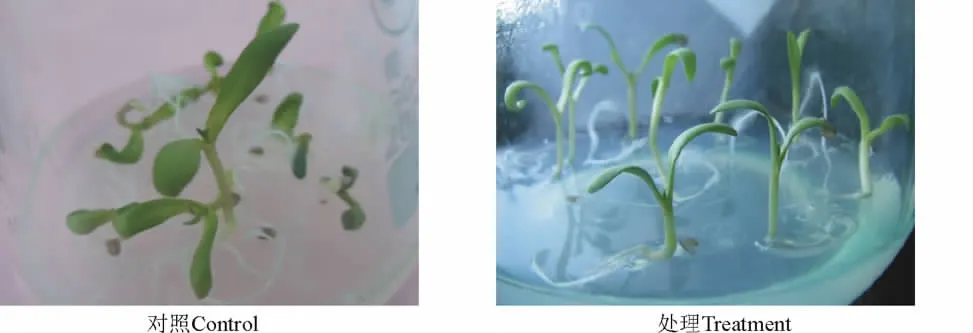
圖7 不同培養方式下綿果薺的幼苗生長(14d的幼苗)Fig.7 Seedling growth of Lachnoloma lehmannii in different culture way(14-d-seedling)
3 討論
獲得無菌材料時,外植體消毒的基本要求是既要殺死表面的全部微生物,使污染率降到最低,又要使外植體保持活力[12-13]。因此,應當正確選擇消毒劑的濃度和處理時間,以盡量減少組織的死亡。據Muralidharan和 Mascarenhas[14]的報道,在常用的幾種消毒劑中,HgCl2的消毒效果最好。同樣本試驗也發現HgCl2的消毒效果比NaClO好。此外,先用70%酒精進行表面消毒,再用NaClO或HgCl2消毒的效果明顯高于直接用NaClO和HgCl2消毒,說明在種子預處理中,使用酒精對種子表面進行消毒是必要的,這些結果與李勁峰等[15]的研究結果一致。種子預先用水沖洗能提高種子表面消毒的效果。本研究結果表明,綿果薺種子經自來水沖洗1~2min后再用消毒劑處理的外植體帶菌率比直接用消毒劑處理的明顯低,這可能是沖洗使種皮松軟,消毒劑易滲入所致。但隨著自來水預處理時間的延長,種子萌發率呈下降趨勢。說明,因種子流水處理時間過長,種皮過松軟或被破壞,消毒劑直接深入種胚,而消毒后的無菌水沖洗不徹底或消毒劑直接毒害種子。
溫度是影響種子萌發的重要生態因子之一,嚴重影響種子的發芽率和萌發速率,適宜溫度會促進種子的萌發和幼苗的生長。但生境和種類的不同,種子最適萌發溫度也有差異[16-17]。早春短命植物常在3月底至4月初萌發出土,此時氣溫從0℃以下開始升高,日照時間也越來越長。因此,溫度對早春短命植物的影響尤為重要[18]。本研究結果表明,綿果薺種子萌發對不同溫度的響應有明顯的差異,種子萌發率在15℃/5℃下明顯高于(25±1)℃,說明高溫對綿果薺種子的萌發具有一定的抑制作用,而綿果薺種子的萌發對低溫有較強的依賴性。萌發后的幼苗生長勢對不同溫度的響應與種子萌發相反,即低溫(15℃/5℃)下綿果薺幼苗生長較緩慢,到第14天還未出現真葉,植株和子葉都很小,而在高溫(25℃±1℃)下幼苗真葉發生較早,植株和子葉都很健壯。說明低溫對綿果薺幼苗的生長有明顯的抑制作用。由此可見,綿果薺在準噶爾荒漠嚴酷環境的長期進化過程中產生如此的特殊生態適應機制而保持了其生存的持續性。此結論與其他短命植物生態適應對策研究結果相符合[19-20]。
在自然環境中,光照條件通過影響種子的萌發率和萌發速率進而影響到幼苗的形成和生長,最終影響到物種的適合度[21]。由于植物所處的生境以及本身的生物學特性差異,不同植物種子的萌發及其幼苗生長對光照具有不同的要求[22-24]。許多荒漠植物的種子無論在光照下還是在暗中都萌發很好[25],或者在暗中的萌發較在光下好[26],但也有部分植物種子的萌發對光照有嚴格依賴性[27-28]。本研究結果表明,光照對綿果薺種子萌發有顯著的影響。在全黑暗下種子可以萌發,但種子萌發起始時間延遲、持續時間較長,而且最終萌發率也很低,光照條件下的種子萌發率明顯高于黑暗條件下的,而且種子萌發起始時間較早、持續時間較短。說明光照對綿果薺種子萌發有明顯的促進作用。但幼苗的不同部位對光照處理有不同響應,且不同處理之間存在極顯著差異。說明光照不僅影響綿果薺種子萌發,而且更影響受體材料的質量。
適宜的植物生長調節劑可打破種子休眠、破壞妨礙種子萌發的活性物質,提高種子萌發率、改善幼苗形態建成。康冰等[29]的研究結果發現,用適宜濃度的GA3、6-BA及IAA浸種可有效提高香椿(Toona sinensis)種子發芽率、幼苗生長量及干物質積累。朱霞等[30]在幾種植物生長調節劑對決明(Cassiaobtusifolia)種子萌發及幼苗生長的影響研究也得到同樣的結果。一定量的生長調節劑配合對綿果薺種子萌發和無菌苗的子葉面積均有促進作用。GR3的種子萌發率和子葉面積顯著高于不處理。但根和下胚軸長度隨著生長調節劑濃度的提高呈下降趨勢,處理顯著低于不處理。由此可知,生長調節劑對不同器官的影響有所不同,根據該結論,可以按需求培育定向的器官材料。但是,附加培養基中的植物生長調節劑除了直接影響種子萌發和母株的生長狀況外,還會在試管苗的器官中積累,使外植體的內源激素含量產生差異,從而影響后續的研究結果[12]。因此,該結論還需要進一步研究和詳細的探討。
4 結論
1)綿果薺種子消毒適宜的方法為:種子流水沖洗1~2min,70%酒精浸泡1min,0.1%HgCl2消毒1.5min。
2)光照對綿果薺種子萌發有促進作用。在25℃下,周期性光照的種子萌發率為73%,比全黑暗的高40%。而幼苗的不同部位對光照有不同的響應,且不同處理之間存在極顯著差異。
3)綿果薺的種子萌發對低溫有依賴性。光照條件下,15℃/5℃的種子萌發率達到了90%,比對照的高16%。而幼苗生長需要一定的高溫。
4)適宜的植物生長調節劑對綿果薺種子萌發有促進作用。在周期性光照和25℃條件下,MS+1.0mg·L-1IBA+0.1mg·L-1BAP的種子萌發率為83%,比對照的高23%。但綿果薺幼苗不同的部位對生長調節劑的反應不同。
因此,綿果薺種子萌發和幼苗生長的適合培養體系是將種子消毒后接種于無激素的MS培養基先放在溫度為15℃/5℃(白天/夜晚)、光照為16 h·d-1、濕度為70%~80%的培養箱內培養4~5 d,種子萌發后轉移到溫度為(25±1)℃、光照為16 h·d-1的培養室內培養,發芽率達到90%,比對照的高16%。誘導出來的無菌苗很健壯,可為愈傷組織誘導和植株再生或其他遺傳學和分子生物學方面的研究提供良好材料。
[1]Risser P,Cottam G.Influence of temperature on the dormancy of some spring ephemerals[J].Ecology,1967,48(3):500-503.
[2]Mulroy T W,Rundel P W.Annual plants:adaptations to desert environments[J].Bioscience,1977,27:109-114.
[3]張立運.新疆莫索灣地區短命植物的初步研究[J].植物生態學與地植物學叢刊,1985,9:213-221.
[4]黃培祐.干旱區免灌植被及其恢復[M].北京:高等教育出版社,2002:38-81.
[5]潘偉斌,黃培佑.四種短命植物若干生態學特性的研究[J].新疆環境保護,1991,13(3):22-27.
[6]王雪芹,蔣進,雷加強,等.古爾班通古特沙漠短命植物分布及其沙面穩定意義[J].地理學報,2003,58(4):598-605.
[7]張立運.新疆的短命植物 Ⅲ.群落學意義和資源價值[J].植物雜志,2002(3):4-5.
[8]馬素卿,潘秀敏.中國植物志:第13卷[M].北京:科學出版社,1987:110.
[9]Wang L,Huang Z Y,Baskin C C,etal.Germination of dimorphic seeds of the desert annual halophyteSuaeda aralocaspica(Chenopodiaceae),a C4plant without kranz anatomy[J].Annals of Botany,2008,102:757-769.
[10]Murashige T,Skoog F.A revised medium for rapid growth and bioassays with tobacco tissue culture[J].Plant Physiology,1962,15:473-497.
[11]彭強,梁銀麗,陳晨,等.土壤含水量對結果期溫室辣椒生長及果實品質的影響[J].西北農林科技大學學報(自然科學版),2010,38(1):154-160.
[12]Trigiano R N,Cray D J.Plant tissue culture concepts and laboratory exercises[M].Second edition.USA:The Chemical Rubber Company Press,2000:45-86.
[13]Razdan M K.Introduction to plant tissue culture[M].Second edition.USA:Science Publishers,Inc,2003:87-367.
[14]Muralidharan E M,Mascarenhas A F.Invitroplantlet formation by organogenesis inEucalyptuscamaldulensisand by somatic embryogenesis inEucalyptuscitriodora[J].Plant Cell Reports,1987,6:256-259.
[15]李勁峰,鄭樹松,蔣海玉,等.油菜無菌苗最佳生長條件的探討[J].貴州農業科學,2006,34(1):34-35.
[16]田宏,劉洋,張鶴山,等.扁穗雀麥種子萌發條件的研究[J].草業科學,2009,26(7):88-93.
[17]Qu X X,Huang Z Y,Baskin J M,etal.Effect of temperature,light and salinity on seed germination and radicle growth of the geographically widespread halophyte shrubHalocnemumstrobilaceum[J].Annals of Botany,2008,101:293-299.
[18]馬生軍,劉曉風,譚敦炎.8種十字花科短命植物的物候及其對荒漠環境的適應[J].新疆農業大學學報,2006,29(4):1-4.
[19]Lu J J,Tan D Y,Baskin J M,etal.Fruit and seed heteromorphism in the cold desert annual ephemeralDiptychocarpusstrictus(Brassicaceae)and possible adaptive significance[J].Annals of Botany,2010:1-16.
[20]袁素芬,唐海萍.短命植物生理生態特性對生境的適應性研究進展[J].草業學報,2010,19(1):240-247.
[21]路寧娜,崔現亮,王桔紅,等.不同貯藏條件和光照對5種蒺藜科植物種子萌發的影響[J].中國沙漠,2008,8(6):1130-1135.
[22]Khan M A,Gulzar S.Light,salinity and temperature effects on the germination of perennial grasses[J].A-merican Journal of Botany,2003,90(1):131-134.
[23]李雪華,李曉蘭,蔣德明,等.畫眉草種子萌發對策及生態適應性[J].應用生態學報,2006,17(4):607-610.
[24]王云,唐書國,陳巧敏,等.土荊芥種子貯藏與萌發特性的研究[J].草業科學,2008,25(2):103-106.
[25]黃振英,Gutterman Y,胡正海.白沙蒿種子萌發特性的研究Ⅱ.環境因素的影響[J].植物生態學報,2001,25(2):240-246.
[26]Small J G C,Gutterman Y.Effect of sodium chloride on prevention of thermodormancy,ethylene and protein synthesis and respiration in Grand Rapids lettuce seeds[J].Physiologia Plantarum,1992,84:35-40.
[27]Sen Y,Chatterji F.Dormancy ofHordeumspontaneum caryopses from a population on the Negev Desert High lands[J].Journal of Arid Environments,1996,33:337-345.
[28]黃振英,張新時,Gutterman Y,等.光照、溫度和鹽分對梭梭種子萌發的影[J].植物生理學報,2001,27(3):275-280.
[29]康冰,陳彥生,張小紅.GA3、6-BA及IAA對香椿種子發芽及幼苗生長的影響(簡報)[J].植物生理學通訊,2001,37(5):399-400.
[30]朱霞,胡勇,王曉麗,等.幾種植物生長調節劑對決明種子萌發及幼苗生長的影響[J].作物雜志,2010(1):46-48.

