“班菲”臍橙果皮油斑病相關(guān)基因的分析
魏召新,程春振,程昌鳳,吳純清,朱世平,漆巨容,洪 林,*
(1.重慶市農(nóng)業(yè)科學(xué)院果樹研究所,重慶 402260;2.西南大學(xué)柑桔研究所,重慶 400712)
柑橘油斑病(又稱油胞病)在世界各地柑橘果皮上普遍發(fā)生,田間觀察發(fā)現(xiàn),重慶的多個甜橙品種上均有不同程度的表現(xiàn),其中晚熟臍橙上表現(xiàn)較為突出,7月底在臍橙果實膨大期果皮上有微小病斑出現(xiàn),成熟期和采后貯藏條件下果皮發(fā)病情況加劇。病斑的存在嚴(yán)重影響了果實外觀,大大降低了商品價值。目前,國內(nèi)外業(yè)界多數(shù)認(rèn)為,油斑病是由于柑橘成熟期間果皮油胞破裂香精油外滲而引起的生理病害[1],病癥的出現(xiàn)與濕度變化[2]、品種[3]、砧木[4]和營養(yǎng)條件[3]、病蟲危害[5]和機械傷害[6-7]等有關(guān),采取相應(yīng)的 農(nóng)業(yè)技術(shù)措施有助于減輕病狀的發(fā)生程度[5,8],但至今尚沒有確切的油斑病發(fā)生的基因調(diào)控本質(zhì)和有效的防控措施,進(jìn)一步在分子水平上開展相關(guān)方面的研究,有助于揭示油斑病發(fā)生的分子機理,也有助于從生產(chǎn)上制定更為有效的防治措施,這對于柑橘增效、農(nóng)民增收具有重要的現(xiàn)實意義。抑制性差減雜交(SSH)技術(shù)是一種簡便的可用于分離兩個mRNA樣品間差異表達(dá)基因的生物學(xué)手段,自其被提出以來,已在小麥[9]、水稻[10]、玉米[11]等植物中得到廣泛的應(yīng)用。SSH技術(shù)在柑橘研究中應(yīng)用也較為廣泛,其中高雪[12]、葉慶亮[13]、程春振[14]等以果皮作為實驗材料分別構(gòu)建了臍橙果皮褐變差減文庫椪柑果皮與果肉差減cDNA文庫和紫外線誘導(dǎo)的梁平柚果皮差減文庫。
為從分子水平上了解柑橘油斑病發(fā)生的機理,應(yīng)用抑制性差減雜交技術(shù)[15],分別以臍橙無病斑果皮和有病斑果皮為材料,提取mRNA合成雙鏈cDNA,再分別以二者作為實驗方和驅(qū)動方,構(gòu)建了表達(dá)基因的正反向文庫,獲得了一些油斑病誘導(dǎo)的“班菲”臍橙果品差減文庫,以期為柑橘油斑病研究提供一定的分子基礎(chǔ)。
1 材料與方法
1.1 材料與試劑
班菲爾臍橙(Citrus sinesisOsbeck)果實于2010年4月5日采于重慶市奉節(jié)縣康樂鎮(zhèn)鐵佛村恒河果業(yè)果園,將果實用自來水清洗后用無菌水清洗3遍,拭干后分別削取健康果皮和具油斑病病癥果皮,馬上置于液氮中,作為RNA 提取材料。
RNA提取試劑盒 美國Invitrogen公司;Oligotex mRNA Mini Kit 德國Qiagen公司;PCR-SelectTMcDNA Subtraction Kit 美國Clontech公司;TaqDNA聚合酶、pMD19-T載體、M-MLV反轉(zhuǎn)錄試劑盒、實時熒光定量PCR試劑盒、SYBR Premix ExTaqTM II(Perfect Real Time)、DNA Fragment Purification Kit Ver2.0 Cat TaKaRa生物工程(大連)有限公司。
1.2 儀器與設(shè)備
LMS-26E凝膠成像系統(tǒng) 美國UVP公司;AE-6111電泳系統(tǒng) 日本ATTO公司;T-I Thermoblock PCR儀德國Biometra公司;iCycler Thermal Cycler 熒光定量PCR儀 美國Bio-Rad公司。
1.3 文庫構(gòu)建
采用Trizol法提取總RNA,使用Oligotex mRNA Mini Kit分離純化mRNA。按照PCR-SelectTMcDNA Subtraction Kit說明書,分別以感病果實果皮/正常果實果皮雙鏈cDNA作為實驗方,以正常果實果皮/感病果實果皮作為驅(qū)動方構(gòu)建cDNA差減文庫。第2次PCR產(chǎn)物用產(chǎn)物回收試劑盒回收后,將純化的PCR產(chǎn)物連接到pMD19-T載體,轉(zhuǎn)化大腸桿菌,經(jīng)藍(lán)白斑篩選后挑取白斑以試劑盒中提供的引物進(jìn)行菌液PCR、AE-6111系統(tǒng)電泳、LMS-26E凝膠成像系統(tǒng)觀察,排除假陽性及非單克隆,檢測插入片段長度。分3批共從正反向文庫中各隨機挑選了150個陽性克隆,送華大基因科技股份有限公司進(jìn)行測序。
1.4 實時定量分析
采用M-MLV反轉(zhuǎn)錄試劑盒,以20μL標(biāo)準(zhǔn)反轉(zhuǎn)錄體系進(jìn)行反轉(zhuǎn)錄合成cDNA第1鏈。以反轉(zhuǎn)錄產(chǎn)物為模板,進(jìn)行實時定量RT-PCR驗證,以β-actin基因作為內(nèi)參基因,分別對3個衰老相關(guān)基因(基因1、2和3)、DNA結(jié)合蛋白基因(基因4)利用實時定量RT-PCR進(jìn)行了表達(dá)驗證,引物序列見表1。

表1 實時定量RT-PCR分析所用的引物Table 1 Primers used for real-time RT-PCR
2 結(jié)果與分析
2.1 RNA 提取
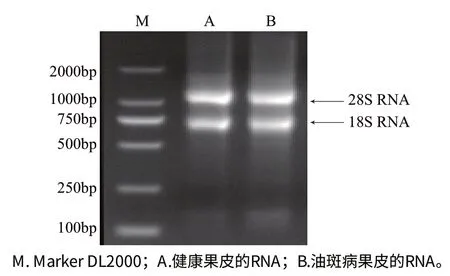
圖1 總RNA凝膠電泳圖Fig.1 Electrophoresis of total RNA
由圖1可知,實驗所得的RNA濃度較高,28S、18S rRNA條帶清晰可見,且無雜帶和拖尾。用Oligotex mRNA Mini Kit純化得到的mRNA呈彌散狀,彌散帶清晰可見,質(zhì)量較高,可用于文庫構(gòu)建。
2.2 兩次PCR檢測
對第1次和第2次PCR效果進(jìn)行檢測,并分別以各自未差減的材料為對照,結(jié)果如圖2所示,差減效果明顯,達(dá)到文庫構(gòu)建的質(zhì)量需要。
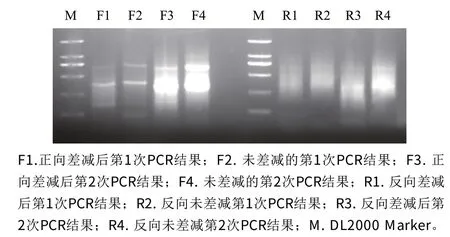
圖2 差減產(chǎn)物的兩次PCR結(jié)果電泳檢測Fig.2 Electrophoresis of subtraction products in two rounds of PCR
2.3 cDNA文庫構(gòu)建情況
電泳結(jié)果顯示差減之后的PCR產(chǎn)物為彌散狀,大小位于200~700bp之間,且多集中于100~500bp。產(chǎn)物分離純化后連接到pMD19-T載體上,轉(zhuǎn)化大腸桿菌,經(jīng)藍(lán)白斑篩選后挑取單菌落進(jìn)行培養(yǎng),并進(jìn)行菌液PCR驗證,電泳檢測結(jié)果見圖3。隨機挑的300個陽性克隆,測序成功獲得292條ESTs序列。

圖3 陽性重組子PCR檢測電泳圖Fig.3 Electrophoresis of positive clones detected by PCR
2.4 序列分析結(jié)果
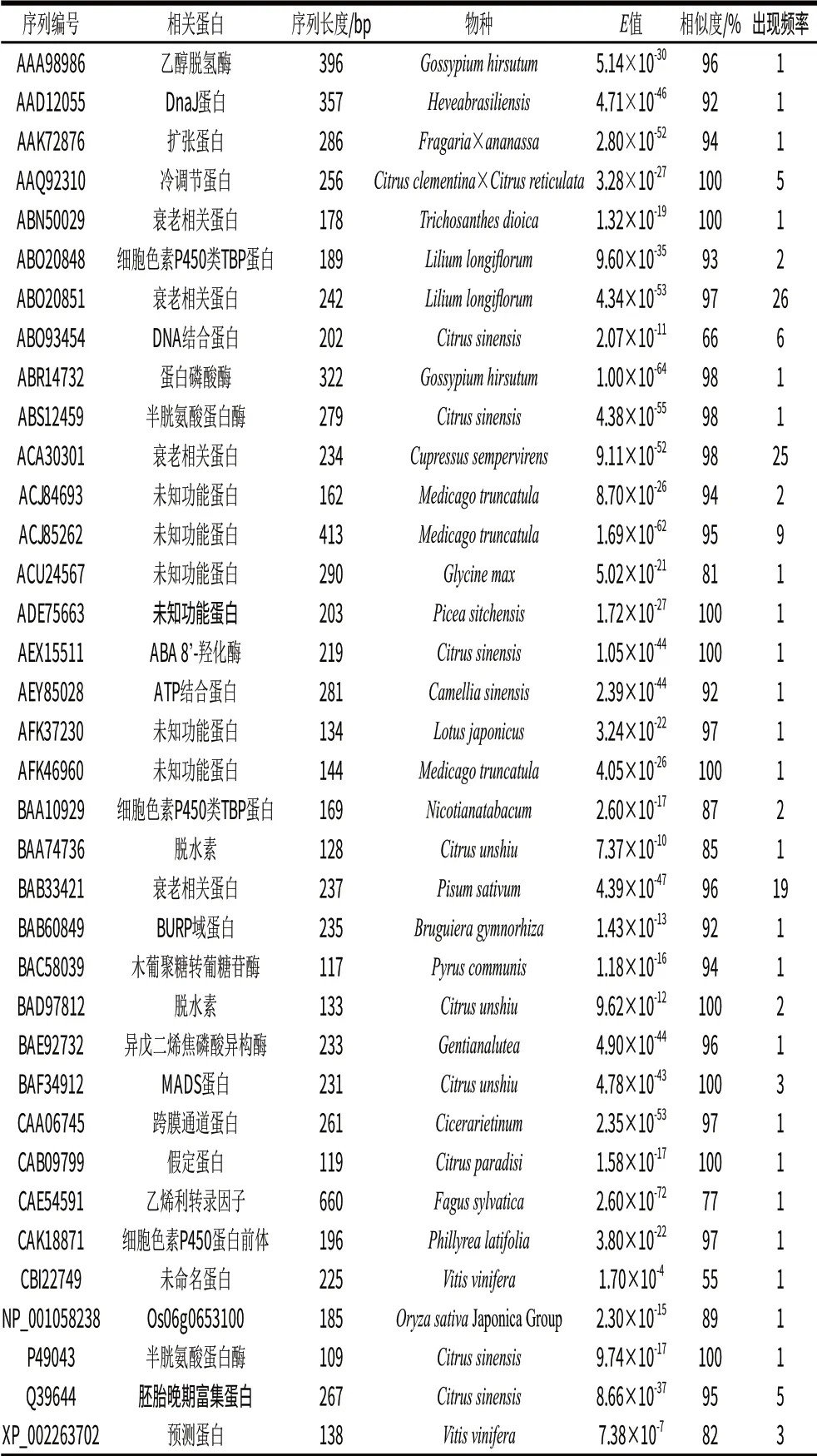
表2 ESTs在核酸數(shù)據(jù)庫BLASTx搜索結(jié)果Table 2 BLASTx results of the ESTs
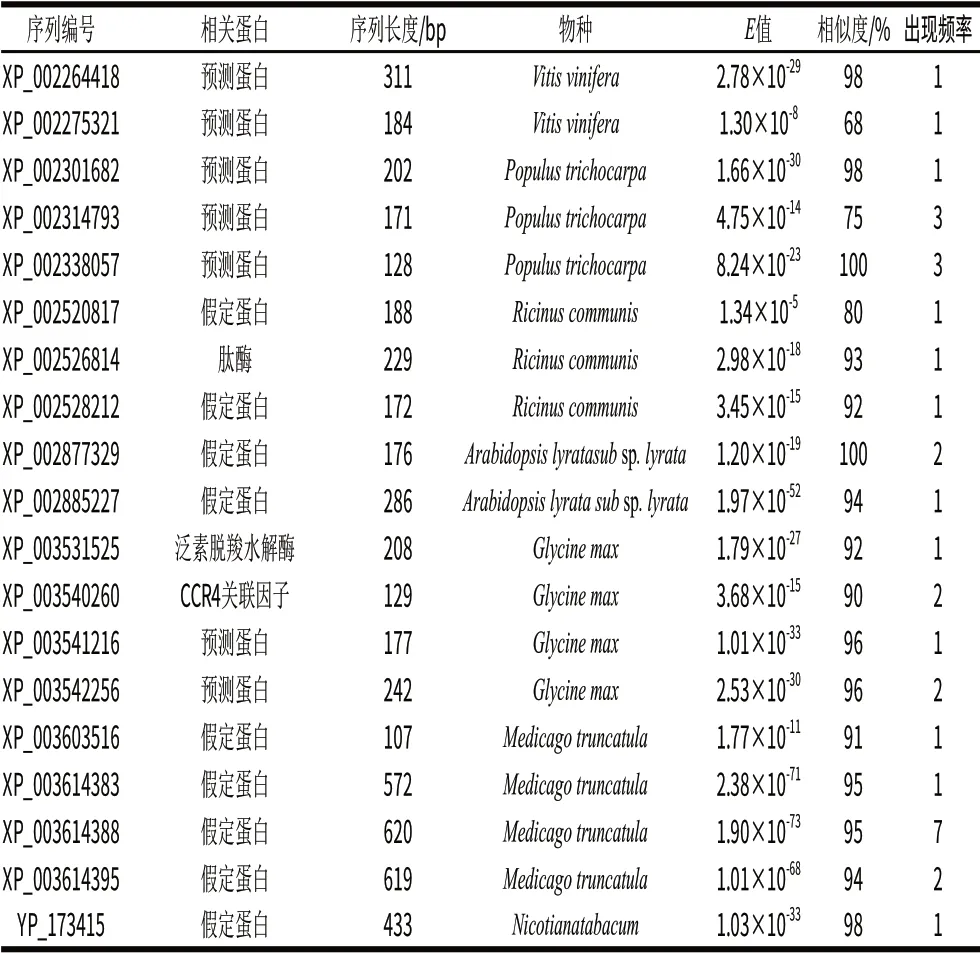
續(xù)表2
由表2可知,所得片段最短為78bp,最長734bp,且大多集中于100~500bp之間,與電泳檢測結(jié)果相似。利用CAP3對所得序列進(jìn)行拼接,獲得19個重疊群和78條單一序列。把所有ESTs利用BLASTx進(jìn)行比對分析,在所獲得的292條ESTs序列中,有165條ESTs與已知植物物種基因相似度較高,它們分屬于55個基因。這些差異表達(dá)基因出現(xiàn)頻率較高的主要有衰老相關(guān)蛋白、DNA結(jié)合蛋白、胚胎晚期富集蛋白、MADS蛋白、脫水素、細(xì)胞色素P450類TBP蛋白和未知功能的蛋白。其中,出現(xiàn)頻率在19次以上的共有3個衰老相關(guān)基因,出現(xiàn)頻率達(dá)70次,占總數(shù)的42.4%;其余的基因出現(xiàn)頻率不超過9次。在出現(xiàn)頻率2~9次之間的基因中,有9個未知功能基因和預(yù)測基因出現(xiàn)33次,占總數(shù)的20.0%,后續(xù)有必要重點對其進(jìn)一步研究,另有8個已知功能基因出現(xiàn)27次,占總數(shù)的16.4%,這8個基因是用于油斑病分析的主要基因。出現(xiàn)一次的基因共35個,占總數(shù)的21.2%,其中有19個已知功能基因,盡管這些基因出現(xiàn)的頻率低,但也可能是反應(yīng)體系重要基因,有進(jìn)一步用于油斑病分析的潛力,如蛋白磷酸酶基因。
2.5 實時定量RT-PCR結(jié)果

圖4 Real-time RT-PCR結(jié)果Fig.4 Results of real-time RT-PCR
采用M-MLV反轉(zhuǎn)錄試劑盒,以20μL標(biāo)準(zhǔn)反轉(zhuǎn)錄體系進(jìn)行反轉(zhuǎn)錄合成cDNA第1鏈,以此產(chǎn)物為模板,以在正向文庫中獲得差異表達(dá)的3個衰老相關(guān)基因(基因1、2、3)、DNA結(jié)合蛋白基因(基因4)序列分別設(shè)計引物,以β-actin基因作為內(nèi)參基因,進(jìn)行了實時定量PCR驗證,各基因的相對表達(dá)情況見圖4。
2.6 序列結(jié)果分析
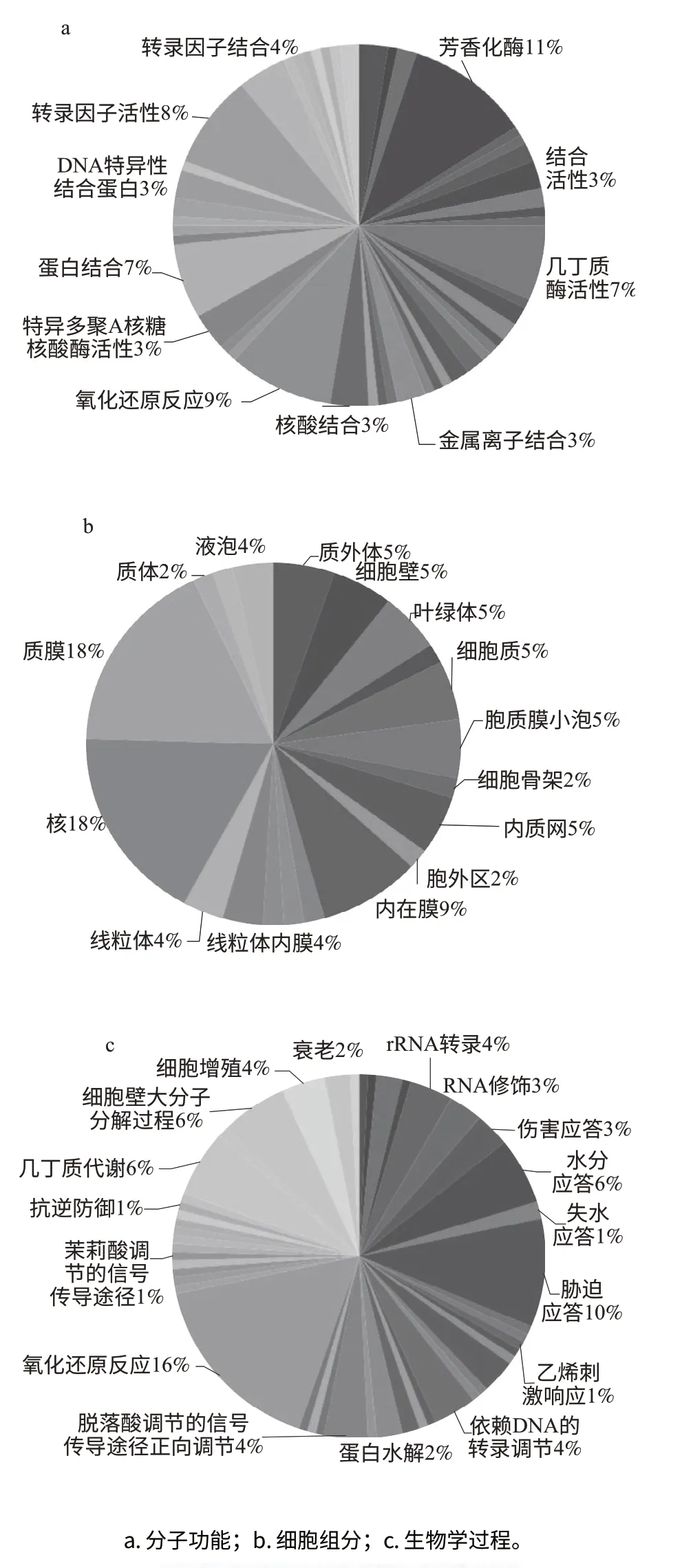
圖5 GO分析的聚類分析結(jié)果Fig.5 Gene Ontology annotation as assigned by BLAST2GO
利用BLAST2GO軟件對獲得基因進(jìn)行分析,根據(jù)分析結(jié)果的基因注釋統(tǒng)計作圖,結(jié)果如圖5所示。從分子功能分類分析結(jié)果可見,參與芳香化酶反應(yīng)的占11%,參與氧化還原反應(yīng)的占9%,參與轉(zhuǎn)錄因子活性的占8%,參與幾丁質(zhì)酶活性的占7%,參與蛋白結(jié)合的占7%,參與轉(zhuǎn)錄因子結(jié)合的占4%,參與核算結(jié)合的占3%,參與金屬離子結(jié)合的占3%,參與特異多聚A核糖核酸酶活性的占3%。實驗所獲得的ESTs對應(yīng)的基因多數(shù)參與抗逆防御、生物和非生物脅迫等多種相關(guān)的生物學(xué)過程,包括參與植物氧化還原反應(yīng)、脅迫應(yīng)答、水分應(yīng)答、細(xì)胞壁大分子分解、幾丁質(zhì)代謝、轉(zhuǎn)錄調(diào)節(jié)、細(xì)胞增殖、衰老、失水應(yīng)答、抗逆防御、細(xì)胞凋亡、轉(zhuǎn)錄與翻譯、信號傳導(dǎo)、能量代謝、糖類及氨基酸代謝以及次生代謝等多種生理生化過程。這些差異表達(dá)基因定位于質(zhì)膜的占18%,細(xì)胞核的占18%,內(nèi)在膜的占9%,定位于細(xì)胞壁、細(xì)胞質(zhì)、胞質(zhì)膜小泡、內(nèi)質(zhì)網(wǎng)、葉綠體、質(zhì)外體上的各占5%,定位于線粒體、線粒體內(nèi)模和液泡的各占4%,還有少量的定位于胞外區(qū)、質(zhì)體和細(xì)胞骨架。對所獲得的ESTs通過提交至Kyoto Encyclopedia of Genes and Genomes(KEGG),獲得了各基因參與的調(diào)控途徑,主要參與次生代謝產(chǎn)物的生物合成、代謝途徑、藥物代謝途徑和脂肪酸代謝途徑等,涉及的酶類主要是單加氧酶、過氧化氫酶、過氧化物酶、幾丁質(zhì)酶和乙醇脫氫酶等。
3 討 論
本研究成功構(gòu)建了晚熟臍橙“班菲”油斑病的正反向差減文庫。隨機挑取了300個克隆進(jìn)行測序,獲得了292條有效ESTs序列,它們分屬19個重疊群和78條單一序列,且均與植物高度同源。實時定量RT-PCR結(jié)果表明,4個基因在感病果皮中均上調(diào),與差減結(jié)果相一致,說明差減效果可靠。
差減獲得ESTs多與抗逆直接相關(guān),從生物學(xué)過程分析和調(diào)控途徑分析的結(jié)果來看,差異基因主要是脅迫響應(yīng)基因。如LEA蛋白是植物體中廣泛存在滲透調(diào)節(jié)有關(guān)的家族蛋白,能有效保持細(xì)胞膜及生物大分子在逆境條件下的穩(wěn)定性,該蛋白的編碼基因在環(huán)境脅迫如干旱、低溫、鹽脅迫等條件下,其mRNA會大量累積[16]。脫水素是LEA蛋白的1種,在水分脅迫條件下,通過與金屬離子結(jié)合,減少金屬離子對細(xì)胞的傷害[17]。幾丁質(zhì)酶是病程相關(guān)蛋白,參與植物逆境脅迫響應(yīng),在植物受傷后,植物體內(nèi)幾丁質(zhì)酶含量迅速升高并大量表達(dá),在植物的防御過程中起著重要的作用。此外,液泡加工酶能夠調(diào)節(jié)液泡中相關(guān)功能蛋白的活性,當(dāng)受到傷害、脅迫等逆境時,該蛋白上調(diào)表達(dá)并誘導(dǎo)衰老相關(guān)蛋白,β-葡糖醛酸酶的表達(dá)[18]乙醇脫氫酶是乙醛生物合成的關(guān)鍵酶之一,在缺氧[19]、傷害[20]條件下迅速增加,它可能是植物在環(huán)境脅迫條件下,植物為適應(yīng)環(huán)境而轉(zhuǎn)換能量代謝的途徑,因而也具有一定的抗非生物脅迫的能力。細(xì)胞色素P450參與一些脂類物質(zhì)如類固醇、脂肪酸的合成和代謝[21]和植物防御次生性物質(zhì)的生物合成過程,還可以催化一些外來物質(zhì)如藥物毒物等的氧化代謝[22],因而具有解毒作用。
活性氧是植物代謝過程中氧氣還原后的副產(chǎn)物[23],也是一種重要的信號分子,其濃度是影響信號調(diào)節(jié)的關(guān)鍵因子[24],過量的活性氧會造成脂質(zhì)的過氧化、膜透性的增加,破壞細(xì)胞組分和結(jié)構(gòu),甚至導(dǎo)致病斑的出現(xiàn)[25-26],而調(diào)節(jié)活性氧濃度的主要是以過氧化氫為電子受體催化底物氧化的過氧化氫酶和過氧化物酶。過氧化氫酶主要存在于細(xì)胞的過氧化物酶體中,是生物防御體系的關(guān)鍵酶之一,也是誘導(dǎo)植物體防御基因表達(dá)中的一個級聯(lián)信號[27],在C3植物降低過氧化氫積累、參與抗逆防御過程中是必需的[28]。過量的過氧化氫能夠誘導(dǎo)細(xì)胞膜透性和組成的變化,從而對細(xì)胞造成傷害,但同時也能促進(jìn)防御基因的表達(dá)[27]。在反向差減文庫中獲得了過氧化氫酶和過氧化物酶表達(dá)基因,可能是這兩個基因的表達(dá)降低引起活性氧的積累,進(jìn)而對細(xì)胞造成傷害,這種情況相關(guān)研究中已有發(fā)現(xiàn)[26]。細(xì)胞色素P450最常見反應(yīng)就是單加氧酶反應(yīng),可以促進(jìn)過氧化氫及其反應(yīng)底物的降解[29],從而減少對細(xì)胞的傷害,在植物的防御反應(yīng)中起著重要的作用。此外,從差減獲得ESTs的定位上來看,超過30%以上的序列定位于各種膜結(jié)構(gòu)上,而且16%的生物學(xué)過程中與氧化還原反應(yīng)直接相關(guān)。因此,可以推測氧化脅迫在油斑病的形成過程中起著舉足輕重的作用。
從差異表達(dá)基因及分子功能可以推測,在柑橘果皮發(fā)生油斑病危害過程中,植株通過乙烯、脫落酸、茉莉酸等信號分子,獲得了系統(tǒng)性抗性,通過調(diào)控基因如脂肪酸合酶、類脂酶、LEA蛋白等基因表達(dá)水平,試圖抵抗和減少病害危害程度,增強自身耐病能力,而在客觀上,油斑病的形成不僅破壞了細(xì)胞結(jié)構(gòu),而且大大增加了果實衰老相關(guān)基因的表達(dá)水平,進(jìn)一步加速了果實衰老。
由上述分析可見氧化脅迫與油斑病的形成有密切關(guān)系,采取相應(yīng)能降低活性氧傷害的措施可能有助于減輕油斑病癥狀、延長果實貨架期、從而提高果實的商品價值。但從實驗結(jié)果來看,仍難以判斷引起氧化脅迫的根源是生物傷害或非生物傷害,盡管也有橘油導(dǎo)致氧脅迫的可能,但仍不足以證明光毒性造成的橘油傷害是油斑病發(fā)生的根本原因[30],需要進(jìn)一步研究以澄清橘油傷害與氧化脅迫之間的關(guān)系。橘油或許也是在細(xì)胞受到傷害后加劇病癥的一種產(chǎn)物,它引起胞外傷害,而氧化脅迫則是自內(nèi)而外對細(xì)胞造成傷害,應(yīng)是油斑病發(fā)生的主要內(nèi)因,從氧化脅迫入手也將有助于油斑病的研究。
[1]SAWAMURA M, MANABE T, OONISHIK S, et al.Effect of rind oils and their components on the induction of rind spot in citrus species[J].J Hort Sci, 1984, 59(4): 575-579.
[2]ALFEREZ F, BUMS J K.Postharvest peel pitting in citrus is induced by changes in relative humidity[J].Proc Fla State Hort Soc, 2004, 117:355-358.
[3]WILD B L.New method for quantitatively assessing susceptibility of citrus fruit to oleocellosis development and some factors that affect its expression[J].Australian Journal of Experimental Agriculture, 1998,38(3): 279-285.
[4]鄭永強, 鄧烈, 何紹蘭, 等.哈姆林甜橙果實油斑病砧穗特異性調(diào)控農(nóng)藝因子篩選[J].中國農(nóng)業(yè)科學(xué), 2010, 43(23): 4877-4885.
[5]丁舜之.柑桔油斑病的發(fā)生原因及預(yù)防措施[J].中國南方果樹,2002, 31(4): 28.
[6]SCHERRER MONTERO C R, SCHWARZ L L, dos SANTOS L C,et al.Oleocellosis incidence in citrus fruit in response to mechanical injuries[J].Scientia Horticulturae, 2012, 134(2): 227-231.
[7]劉麗丹, 吳日章, 曾凱芳.采后橘油誘導(dǎo)及振動脅迫對貯藏期錦橙果皮油胞病的影響[J].食品科學(xué), 2011, 32(16): 365-369.
[8]鄭永強, 鄧烈, 何紹蘭, 等.樹冠噴鈣對柑桔果實油斑病及外觀品質(zhì)的影響[J].西南大學(xué)學(xué)報: 自然科學(xué)版, 2009, 31(12): 63-66.
[9]XIAO Kai, BAI Guihua, BRERR fC.Nylon filter array reveal differential expression of expressed sequence tags in wheat roots under aluminum stress[J].Journal of Integrative Plant Biology Formerly Acta Botanica Sinica, 2005, 47(4): 839-848.
[10]GAO Peng, WANG Guoying, ZHAO Huji, et al.Isolation and identification of submergence induced genes in maize (Zea mays)seedlings by suppression subtractive hybridization[J].Acta Botanica Sinica, 2003, 45(4): 479-483.
[11]LI Huiyong, HUANG Suhua, SHI Yunsu, et al.Isolating soil droughtinduced genes from maize seedling leaves through suppression subtractive hybridization[J].Agricultural Sciences in China, 2007,6(6): 647-651.
[12]高雪, 李正國, 樊晶, 等.奉節(jié)臍橙果皮褐變差減文庫的構(gòu)建及初步分析[J].植物生理與分子生物學(xué)學(xué)報, 2007, 33(1): 71-76.
[13]葉慶亮, 江東, 彭愛紅.‘巖溪晚蘆’椪柑果皮與果肉差減cDNA文庫的構(gòu)建及初步分析[J].園藝學(xué)報, 2009, 36(7): 967-974.
[14]程春振, 朱世平, 吳波, 等.紫外線照射對梁平柚果皮基因表達(dá)的影響[J].園藝學(xué)報, 2011, 38(5): 859-866.
[15]DIATCHENKO L, LAU Y F, CAMPBELL A P.Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNA probes and libraries[J].Proc Natl Sci Acad USA, 1996, 93(12): 6025-6030.
[16]XU Deping, DUAN Xiaolan, WANG Baiyang, et al.Expression of a late embryogenesis abundant protein gene, HVA1, from barley confers tolerance to water deficit and salt stress in transgenic rice[J].Plant Physiology, 1996, 110(1): 249-257.
[17]HARA M, FUJINAGA M, KUBOI T.Metal binding by citrus dehydrin with histidine-rich domains[J].J Exp Bot, 2005, 56:2695-2703.
[18]TETSU K, KENJI Y, NAGAKO H, et al.Vacuolar processing enzyme is up-regulated in the lytic vacuoles of vegetative tissues during senescence and under various stressed conditions[J].The Plant Journal,1999, 19(1): 43-53.
[19]MATTON D P, CONSTABEL P, BRISSON N.Alcohol dehydrogenase gene expression in potato following elicitor and stress treatment[J].Plant Mol Biol, 1990, 14(5): 775-783.
[20]KATO-NOGUCHI H.Wounding stress induces alcohol dehydrogenase in maize and lettuce seedlings[J].Plant Growth Regulation, 2001,35(3): 285-288.
[21]FREY M, CHOMET P, GLAWISHNIG E, et al.Analysis of a chemical plant defense mechanism in grasses[J].Science, 1997, 277:696-699.
[22]FUNK C, CROTEAU R.Induction and characterization of a cytochrome P450: dependent camphor hydroxylase in tissue cultures of common sage (Salvia off icinalis)[J].Plant Physiol, 1993, 101(4):1231-1237.
[23]MOLLER I M, JENSEN P E, HANSSON A.Oxidative modifications to cellular components in plants[J].Annu Rev Plant Biol, 2007, 58:459-481.
[24]MHAMDI A, QUEVAL G, CHAOUCH S, et al.Catalase function in plants: a focus onArabidopsismutants as stress-mimic models[J].Journal of Experimental Botany, 2010, 61(15): 4197-4220.
[25]GARCIA-PEREZ C, ROY S S, NAGHDI S, et al.Bid-induced mitochondrial membrane permeabilization waves propagated by local reactive oxygen species (ROS) signaling[J].Proc Natl Acad Sci USA,2012, 109(12): 4497-4502.
[26]CHEN Shiguo, YIN Chunyan, STRASSER R J, et al.Reactive oxygen species from chloroplasts contribute to 3-acetyl-5-isopropyltetramic acid-induced leaf necrosis ofArabidopsis thaliana[J].Plant Physiology and Biochemistry, 2012, 52: 38-51.
[27]PELLINEN R I, KORHONEN M S, TAURIAINEN A A, et al.Hydrogen peroxide activates cell death and defense gene expression in birch[J].Plant Physiol, 2002, 130(2): 549-560.
[28]HILDE W, SANGPEN C, MARK D, et al.Catalase is a sink for H2O2and is indispensable for stress defence in C3 plants[J].The EMBO Journal, 1997, 16(16): 4806-4816.
[29]HRYCAY E G, BANDIERA S M.The monooxygenase, peroxidase,and peroxygenase properties of cytochrome P450[J].Arch Biochem Biophys, 2012, 522(2): 71-89.
[30]KNIGHT T G, KLIEBER A, SEDGLEY M.The relationship between oil gland and fruit development in Washington navel orange (Citurs sinensisL.Osbeck)[J].Annals of Botany, 2001, 88: 1039-1047.

