發(fā)酵輪葉黨參皂苷對(duì)二乙基亞硝胺致小鼠肝細(xì)胞DNA氧化損傷的保護(hù)作用機(jī)制
俞 星,鄭春姬,韓春姬,,*,姜國(guó)哲,崔成弼
(1.延邊大學(xué)醫(yī)學(xué)院預(yù)防醫(yī)學(xué)教研部,吉林 延吉 133002;2.延邊大學(xué)食品研究中心,吉林 延吉 133002)
二乙基亞硝胺(diethylnitrosamine,DEN)是一種很強(qiáng)的化學(xué)致癌物,通常用于原發(fā)性肝癌動(dòng)物模型的制作,可用于研究肝癌的發(fā)病機(jī)理及其防治。DEN誘發(fā)小鼠肝癌模型,其特點(diǎn)為誘癌成功率高,肝癌細(xì)胞所占比例大[1],且其誘發(fā)的腫瘤多為肝細(xì)胞癌,與人肝細(xì)胞癌相似[2-3]。DEN誘發(fā)大鼠肝癌的過(guò)程要經(jīng)過(guò)3個(gè)階段,即肝硬變前期(1~8周)、肝硬變期(8~14周)、癌變期(14~20周)[4]。
輪葉黨參(Codonopsis lanceolata)又名山海藻,屬于桔梗科黨參屬植物,廣泛分布于中國(guó)、韓國(guó)、朝鮮、日本等地。輪葉黨參主要是作為山野菜食用,未見(jiàn)任何毒副作用。現(xiàn)代藥理學(xué)研究表明,輪葉黨參提取物具有抗氧化、抗衰老、抗突變、抗腫瘤、抗疲勞以及提高機(jī)體免疫力等作用[5-8]。本實(shí)驗(yàn)室前期的研究結(jié)果表明,輪葉黨參提取物具有顯著的預(yù)防化學(xué)性肝損傷的作用[9-10]。最近的研究結(jié)果表明,輪葉黨參經(jīng)活性酵母發(fā)酵后,其抗氧化活性明顯增強(qiáng)[11],但有關(guān)輪葉黨參對(duì)化學(xué)致癌物DEN的早期肝臟損傷的保護(hù)作用尚未見(jiàn)報(bào)道。本實(shí)驗(yàn)旨在探討發(fā)酵輪葉黨參皂苷(fermentedCodonopsis lanceolatasaponin,F(xiàn)CLS)對(duì)DEN致小鼠肝細(xì)胞氧化損傷的保護(hù)作用及其機(jī)制,以期能為肝癌化學(xué)預(yù)防劑的開發(fā)提供參考數(shù)據(jù)。
1 材料與方法
1.1 材料與試劑
輪葉黨參采集自吉林省延邊州安圖縣。
DEN 日本半井化學(xué)藥品株式會(huì)社;肝細(xì)胞中的細(xì)胞色素P4502E(CYP2E)抗體、二氨基聯(lián)苯胺(DAB)試劑盒、SABC免疫組化試劑盒 武漢博士德生物工程有限公司;小鼠8羥基脫氧鳥苷(8-OHdG)ELISA試劑盒、8-羥基鳥嘌呤-DNA糖苷酶(OGG1)ELISA試劑盒 上海研生生物科技有限公司,其他試劑均為市售分析純。
1.2 儀器與設(shè)備
DG5033A酶聯(lián)免疫檢測(cè)儀 南京華東電子集團(tuán)醫(yī)療裝備有限責(zé)任公司;小動(dòng)物IVC飼養(yǎng)系統(tǒng) 蘇杭科技器材有限公司;BM-VI生物組織冷凍包埋機(jī) 孝感電子儀器廠;RM2125切片機(jī) 萊卡公司;BH2生物顯微鏡日本Olympus公司。
1.3 方法
1.3.1 FCLS的制備
輪葉黨參采用活性酵母發(fā)酵,F(xiàn)CLS的制備方法同俞星等[12]的報(bào)道。新鮮輪葉黨參,洗凈浮土,切成2~3cm薄片,在60℃條件下烘干,粉碎成20目的粗粉,用活性酵母發(fā)酵6d[13],用50%乙醇加熱回流提取,濾液回收乙醇后減壓濃縮,用乙酸乙酯萃取后再用正丁醇萃取,將后者上D10l大孔吸附樹脂,依次用30%、50%、75%和95%乙醇洗脫,合并洗脫液,回收乙醇,減壓干燥得到FCLS,采用香草醛-冰醋酸比色法測(cè)定總皂苷含量達(dá)到63%,其主要成分為Codonolaside、Lancemaside、刺囊酸等五環(huán)三萜類皂苷,其苷元為齊墩果酸。輪葉黨參經(jīng)活性酵母發(fā)酵之后,總皂苷含量達(dá)到7.34%(未發(fā)酵輪葉黨參總皂苷含量為3.52%),故本實(shí)驗(yàn)采用發(fā)酵方法處理后提取總皂苷。
1.3.2 動(dòng)物分組及處理
雄性清潔級(jí)昆明種小鼠50只,體質(zhì)量20~22g,由延邊大學(xué)實(shí)驗(yàn)動(dòng)物科提供,在本實(shí)驗(yàn)室IVC系統(tǒng)中飼養(yǎng)并進(jìn)行實(shí)驗(yàn)。實(shí)驗(yàn)前先將動(dòng)物適應(yīng)性喂養(yǎng)3d,然后隨機(jī)分為陰性對(duì)照組、單純DEN組(隔日腹腔注射DEN 20mg/kg,以體質(zhì)量計(jì))、FCLS高、中、低3個(gè)劑量組(分別灌胃200、100、50mg/(kg·d),以體質(zhì)量計(jì)),連續(xù)6周。
1.3.3 OGG1活性及8-OHdG含量測(cè)定
在最后1次給藥后過(guò)24h,脫頸椎處死小鼠,每只小鼠取100mg左葉肝組織,加0.9mL生理鹽水用冰浴勻漿,3000×g離心30min后取上清液,嚴(yán)格按試劑盒說(shuō)明書進(jìn)行操作。肝組織勻漿蛋白含量采用考馬斯亮藍(lán)法測(cè)定。
1.3.4 肝組織中CYP2E1免疫組織化學(xué)染色
動(dòng)物脫頸椎處死后,取肝臟。切取長(zhǎng)寬不超過(guò)5mm,厚度不超過(guò)2mm的組織塊,用4%多聚甲醛固定,石蠟包埋,切片。CYP2E1表達(dá)的免疫組織化學(xué)染色,采用鏈霉素抗生物素蛋白-過(guò)氧化酶免疫組織化學(xué)法(SP法),DAB顯色,一抗CYP2E-BAl774為兔來(lái)源的多克隆抗體,工作濃度為1:100,操作嚴(yán)格按試劑盒說(shuō)明書進(jìn)行。每次實(shí)驗(yàn)均設(shè)陰性對(duì)照,以PBS替代一抗,于光學(xué)顯微鏡下觀察結(jié)果。
結(jié)果評(píng)定標(biāo)準(zhǔn):CYP2E1陽(yáng)性細(xì)胞表現(xiàn)為胞漿/胞膜呈棕黃色。每份切片取5個(gè)高倍視野(×400),按以下方法進(jìn)行半定量的計(jì)數(shù)方法:0級(jí)為陽(yáng)性細(xì)胞數(shù)為0%~5%,Ⅰ級(jí)為陽(yáng)性細(xì)胞數(shù)為6%~25%或染色強(qiáng)度較弱,棕褐色不明顯。Ⅱ級(jí)為陽(yáng)性細(xì)胞數(shù)為26%~50%,染色強(qiáng)度較深,棕褐色較明顯。Ⅲ級(jí)為陽(yáng)性細(xì)胞數(shù)>50%,染色強(qiáng)度深,棕褐色明顯。
1.4 統(tǒng)計(jì)學(xué)分析
用SPSS17.0軟件進(jìn)行數(shù)據(jù)分析,計(jì)量資料的顯著性檢驗(yàn)采用單因素方差分析,組間比較采用LSD-t檢驗(yàn)。CYP2E1表達(dá)結(jié)果顯著性檢驗(yàn)采用秩和檢驗(yàn)。
2 結(jié)果與分析
2.1 小鼠肝組織8-OHdG、OGG1含量
表1 各組肝勻漿中8-OHdG含量及OGG1活性比較(±s,n=10)Table 1 Comparison of 8-OHdG content and OGG1 activity in hepatic tissue from different groups (±s,n=10)
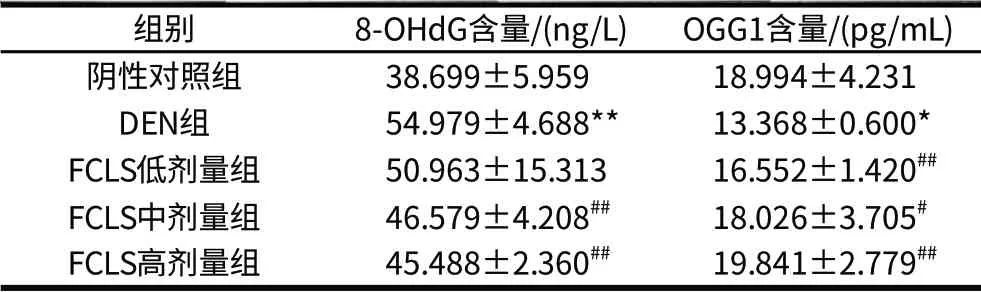
表1 各組肝勻漿中8-OHdG含量及OGG1活性比較(±s,n=10)Table 1 Comparison of 8-OHdG content and OGG1 activity in hepatic tissue from different groups (±s,n=10)
注:*.與陰性對(duì)照組比較,有顯著性差異(P<0.05);#.與DEN組比較,有顯著性差異(P<0.05);##.與DEN組比較,有極顯著性差異(P<0.01)。
組別 8-OHdG含量/(ng/L) OGG1含量/(pg/mL)陰性對(duì)照組 38.699±5.959 18.994±4.231 DEN組 54.979±4.688** 13.368±0.600*FCLS低劑量組 50.963±15.313 16.552±1.420##FCLS中劑量組 46.579±4.208## 18.026±3.705#FCLS高劑量組 45.488±2.360## 19.841±2.779##
由表1可知,DEN組肝組織勻漿中8-OHdG含量明顯高于陰性對(duì)照組(P<0.01);FCLS高、中劑量組肝組織8-OHdG含量明顯低于DEN組,其差異極顯著(P<0.01),并隨著FCLS劑量的增高,8-OHdG含量也隨之減少。DEN組肝組織勻漿中OGG1含量明顯低于陰性對(duì)照組(P<0.05),F(xiàn)CLS高、中、低3個(gè)劑量組肝組織勻漿中OGG1含量明顯高于DEN組,其差異顯著(P<0.05或P<0.01),給藥劑量與OGG1活性呈劑量-效應(yīng)關(guān)系。
2.2 肝組織CYP2E1表達(dá)
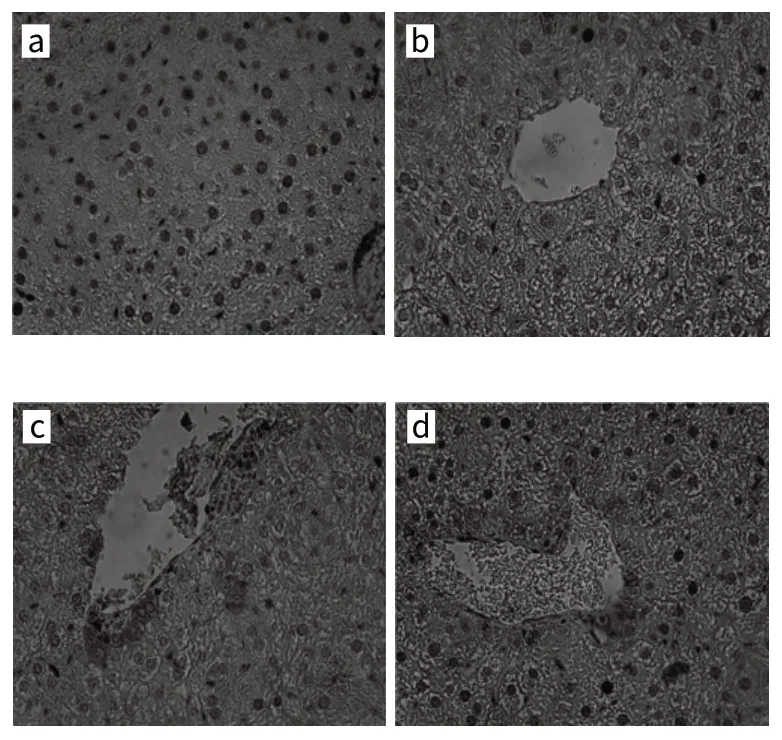
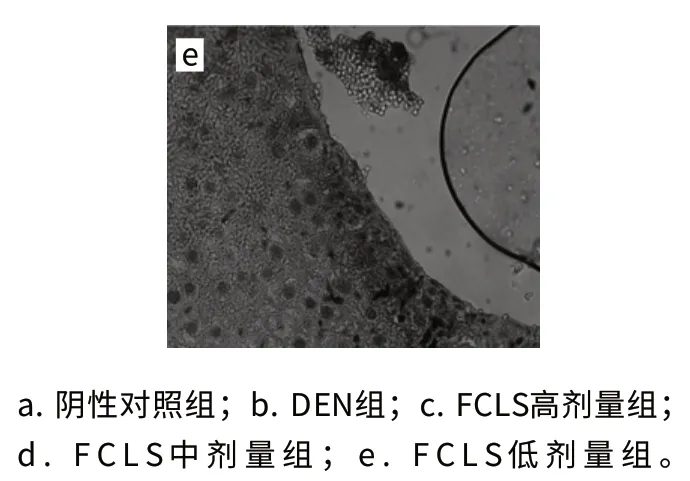
圖1 小鼠肝臟CYP2E1蛋白表達(dá)(SP,×400)Fig.1 Expression of CYP2E1 protein in hepatic tissue (SP,×400)
免疫組化顯示棕黃色顆粒為CYP2E1蛋白表達(dá)陽(yáng)性。由圖1可知,在陰性對(duì)照組中CYP2E1表達(dá)陽(yáng)性細(xì)胞在腺泡Ⅲ區(qū)分布很少,單純給予DEN組CYP2E1表達(dá)陽(yáng)性細(xì)胞從腺泡Ⅲ區(qū)延伸到腺泡Ⅱ區(qū),而給予高劑量和中劑量FCLS的兩個(gè)組CYP2E1表達(dá)陽(yáng)性細(xì)胞主要分布在腺泡Ⅲ區(qū)。統(tǒng)計(jì)評(píng)定結(jié)果如表2所示,DEN組肝組織中CYP2E1蛋白表達(dá)陽(yáng)性率明顯高于陰性對(duì)照組(P<0.01);FCLS中劑量組和高劑量組肝組織CYP2E1蛋白表達(dá)陽(yáng)性率明顯低于DEN組,差異顯著(P<0.05或P<0.01)。
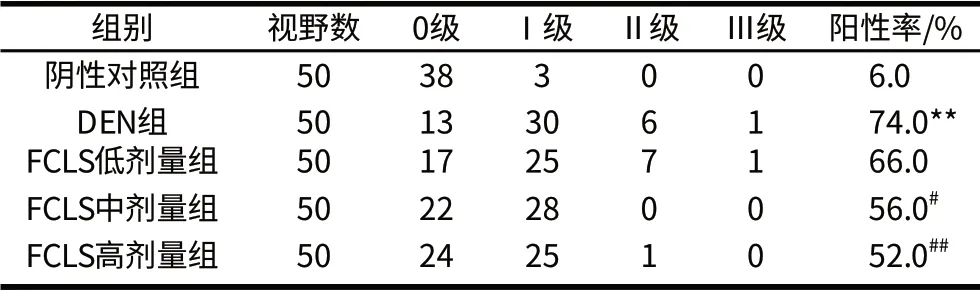
表2 肝組織中CYP2E1蛋白表達(dá)的變化Table 2 Comparison of CYP2E1 protein expression in hepatic tissue from different groups
3 討 論
有研究報(bào)道[14],在DEN誘發(fā)小鼠肝癌實(shí)驗(yàn)中,給予DEN第4、6周時(shí),小鼠肝癌干細(xì)胞標(biāo)志CD133 mRNA的表達(dá)與對(duì)照組無(wú)差異,第8周CD133 mRNA的表達(dá)顯著高于對(duì)照組,因此DEN誘發(fā)小鼠肝癌的過(guò)程中,第1~6周的病理變化主要是藥物性肝炎的表現(xiàn),包括部分肝細(xì)胞出現(xiàn)增生性改變,局部肝細(xì)胞的變性壞死和充血及出血。此階段尚未形成肝癌細(xì)胞,應(yīng)是肝癌預(yù)防的最佳階段。本實(shí)驗(yàn)的前期研究結(jié)果表明輪葉黨參皂苷能明顯提高腹腔注射DEN 6周的小鼠肝組織超氧化物歧化酶(SOD)、谷胱甘肽過(guò)氧化物(GSH-Px)活性,并顯著降低MDA含量,并減少DEN所致肝細(xì)胞DNA鏈斷裂[15],表明FCLS具有明顯的提高抗氧化酶活性作用。8-OHdG是鳥嘌呤的氧化型,是由于DNA鏈上鳥嘌呤堿基的C-8位受到羥自由基及單線態(tài)氧的攻擊,發(fā)生羥化而生成[16-17],其結(jié)果導(dǎo)致G:C突變?yōu)門:A的DNA堿基顛換[18]。在臨床和實(shí)驗(yàn)中8-OHdG常用作檢測(cè)DNA氧化損傷、突變的重要生物標(biāo)志物[19]。本研究結(jié)果表明,小鼠隔日注射DEN,連續(xù)6周,導(dǎo)致肝組織8-OHdG含量明顯高于對(duì)照組,表明DEN導(dǎo)致小鼠肝細(xì)胞DNA氧化損傷。給予DEN的同時(shí)灌胃不同劑量的FCLS,肝組織8-OHdG含量明顯低于單純DEN組,且存在劑量依存性,表明FCLS能夠拮抗DEN對(duì)肝細(xì)胞DNA的氧化損傷作用。由于DEN已被證明誘發(fā)動(dòng)物肝硬變及肝癌,因此可推測(cè)FCLS對(duì)DEN誘發(fā)肝癌具有潛在的預(yù)防作用。
當(dāng)DNA分子受自由基攻擊而發(fā)生氧化損傷時(shí),機(jī)體可通過(guò)自身修復(fù)機(jī)制修補(bǔ)受損的DNA分子,從而維持DNA的穩(wěn)定性。機(jī)體內(nèi)多種DNA氧化損傷修復(fù)方式中堿基切除修復(fù)是最重要的修復(fù)途徑,因?yàn)樽杂苫饕鸱峭榛疍NA損傷,該損傷的修復(fù)需要堿基切除修復(fù)酶。OGG1是參與堿基切除修復(fù)過(guò)程的重要酶之一,并且在修復(fù)的過(guò)程中與個(gè)體對(duì)致癌物作用的敏感性密切相關(guān)。無(wú)論是OGG1基因突變或缺失,都能使細(xì)胞修復(fù)8-OHdG的能力降低或喪失,并且對(duì)個(gè)體患腫瘤的風(fēng)險(xiǎn)也隨之增高[20]。頭頸部鱗狀細(xì)胞癌患者OGG1基因表達(dá)顯著低于健康人,且OGG1基因表達(dá)降低可使患頭頸部鱗狀細(xì)胞癌的風(fēng)險(xiǎn)提高2倍以上[21]。本研究結(jié)果表明,單純DEN組小鼠肝組織OGG1活性明顯低于陰性對(duì)照組,而給予FCLS的小鼠肝組織OGG1活性明顯高于單純DEN組,表明DEN抑制小鼠肝細(xì)胞OGGl活性,減弱對(duì)氧化損傷的DNA的修復(fù)能力。用FCLS干預(yù)后通過(guò)上調(diào)OGGl的活性,提高切除DNA雙鏈中的8-OHdG,恢復(fù)基因組中正常的G:C配對(duì),使受損DNA得到修復(fù)。本研究結(jié)果中,F(xiàn)CLS高劑量組的OGG1活性略高于正常對(duì)照組,但其差異無(wú)統(tǒng)計(jì)學(xué)意義,因此認(rèn)為FCLS在本實(shí)驗(yàn)條件下不發(fā)生OGG1過(guò)表達(dá)。
細(xì)胞色素P450(CYP)是研究較多的Ⅰ相代謝酶,作為肝臟主要代謝酶,該酶系有100多種同工酶,其中細(xì)胞色素P4502E1(CYP2E1)約占P450總量的7%,CYP2E1作為肝臟的重要代謝酶參與其發(fā)生發(fā)展,對(duì)乙醇、亞硝胺等肝毒性物質(zhì)具有特異性的代謝作用,但其過(guò)表達(dá)可促進(jìn)各種肝病的發(fā)生,并參與了多種消化道和呼吸道腫瘤的形成[22]。在外源性化合物和藥物代謝的過(guò)程中,CYP2E1可把無(wú)活性的前致癌物代謝轉(zhuǎn)變?yōu)橛H電子化學(xué)物,親電子化學(xué)物可以攻擊細(xì)胞內(nèi)的大分子,與DNA或蛋白質(zhì)形成加成物,最終引起病變[23]。研究表明,CYP2E1參與肝毒性物質(zhì)的活化,使前毒性物質(zhì)或致癌物質(zhì)與嗜電子衍生物結(jié)合,引起細(xì)胞毒性、死亡甚至癌變[24]。
本研究結(jié)果表明,與陰性對(duì)照組相比,DEN組細(xì)胞的CYP2E1蛋白表達(dá)增加,CYP2E1活性增強(qiáng)。該結(jié)果證實(shí)了DEN誘導(dǎo)CYP2E1蛋白在細(xì)胞內(nèi)的表達(dá),使CYP2E1活性增強(qiáng),進(jìn)而使細(xì)胞內(nèi)的脂質(zhì)過(guò)氧化增加,抗氧化物質(zhì)減少。與DEN組相比,同時(shí)給予FCLS組肝細(xì)胞CYP2E1蛋白表達(dá)降低,說(shuō)明FCLS可以抑制DEN誘導(dǎo)的CYP2E1活性的上調(diào)引起的反應(yīng)性氧自由基產(chǎn)生的增多及其引起的代謝毒性。
Kim等[25]報(bào)道,用乳酸菌發(fā)酵輪葉黨參前后的提取物對(duì)人類癌細(xì)胞生長(zhǎng)抑制作用表現(xiàn)出明顯的差異,即生輪葉黨參提取物對(duì)人胃癌及乳腺癌細(xì)胞的生長(zhǎng)抑制作用優(yōu)于發(fā)酵輪葉黨參提取物,而發(fā)酵輪葉黨參提取物對(duì)人肝癌和肺癌細(xì)胞的生長(zhǎng)抑制作用明顯優(yōu)于生輪葉黨參,并認(rèn)為其抑癌作用主要依賴于三萜皂苷。俞星等[12]用活性酵母發(fā)酵輪葉黨參后提取總皂苷,進(jìn)行體外實(shí)驗(yàn)結(jié)果表明,輪葉黨參總皂苷能明顯抑制人肝癌細(xì)胞HepG-2的增殖,并通過(guò)提高促進(jìn)凋亡基因蛋白Caspase3,8,9活性,誘導(dǎo)HepG-2細(xì)胞凋亡。通過(guò)本次研究及已有的研究,認(rèn)為經(jīng)過(guò)活性酵母發(fā)酵的輪葉黨參總皂苷提取物。本次實(shí)驗(yàn)結(jié)果表明輪葉黨參經(jīng)活性酵母發(fā)酵提取的輪葉黨參皂苷對(duì)DEN誘發(fā)小鼠肝細(xì)胞DNA氧化損傷具有較好的預(yù)防作用,提示輪葉黨參通過(guò)微生物發(fā)酵,其皂苷對(duì)肝癌具有一定的預(yù)防作用。關(guān)于輪葉黨參經(jīng)微生物發(fā)酵后某些藥理活性的變化機(jī)制尚未見(jiàn)研究報(bào)道,有待于今后進(jìn)一步研究。
綜上所述,F(xiàn)CLS預(yù)防DEN致小鼠肝細(xì)胞DNA損傷的機(jī)制為通過(guò)降低CYP2E1活性,降低DEN在肝組織中的活化,通過(guò)提高抗氧化酶活性,清除DEN代謝過(guò)程中產(chǎn)生的過(guò)多的自由基和活性氧,從而阻止了肝細(xì)胞DNA的氧化損傷。同時(shí)通過(guò)提高OGG1基因表達(dá),迅速清除DNA氧化損傷產(chǎn)生的加合物8-OHdG,修復(fù)受損DNA。
[1]GHOSH A, GHOSH D, SARKAR S, et al.Anticarcinogenic activity of nanoencapsulated quercetin in combating diethylnitrosamineinduced hepatocarcinoma in rats[J].Eur J Cancer Prev, 2012, 21(1):32-41.
[2]OKUBO H, MORIYAMA M, TANAKA N, et al.Detection of serum and intrahepatic hepatocyte growth factor during DEN-induced carcinogenesis in the rat[J].Hepatol Res, 2002, 24(4): 385-394.
[3]羅明, 賀平, 吳孟超, 等.苦參堿和氧化苦參堿對(duì)二乙基亞硝胺誘發(fā)大鼠肝癌的預(yù)防阻斷作用[J].腫瘤防治雜志, 2000, 7(6): 561-563.
[4]丁仕義, 蔡金華.大鼠肝細(xì)胞癌模型的建立及MR成像研究[J].第三軍醫(yī)大學(xué)學(xué)報(bào), 2002, 24(6): 643-645.
[5]韓春姬, 樸永泉.輪葉黨參多糖對(duì)小鼠S180肉瘤的抑制作用[J].延邊大學(xué)醫(yī)學(xué)學(xué)報(bào), 2000, 23(4): 249-250.
[6]KIM S H, CHOI H J, CHUNG M J, et al.Antimutagenic and antitumor effects of codonopsis lanceolata extracts[J].J Korean Soc Food Sci Nutr, 2009, 38(10): 1295-1301.
[7]韓春姬, 李蓮姬.輪葉黨參水提取液抗突變作用及其機(jī)理研究[J].預(yù)防醫(yī)學(xué)文獻(xiàn)信息, 1998, 4(3): 204-205.
[8]韓春姬, 李蓮姬, 樸惠善, 等.輪葉黨參對(duì)老年小鼠益智及抗氧化的作用[J].中藥材, 1999, 22(3): 136-138.
[9]白雪松, 韓春姬, 鮑捷.復(fù)方輪葉黨參預(yù)防乙醇性肝損傷作用機(jī)制研究[J].毒理學(xué)雜志, 2008, 22(1): 42-43.
[10]張亮, 韓春姬, 李蓮姬, 等.復(fù)方輪葉黨參對(duì)小鼠乙醇性肝損傷的預(yù)防作用[J].毒理學(xué)雜志, 2007, 21(4): 265-267.
[11]劉婷婷, 韓春姬, 俞星.發(fā)酵輪葉黨參提取物清除DPPH自由基的作用[J].吉林大學(xué)學(xué)報(bào): 醫(yī)學(xué)版, 2011, 37(6): 1087-1089.
[12]俞星, 李林, 韓春姬, 等.輪葉黨參總皂苷對(duì)HepG-2細(xì)胞凋亡的作用[J].吉林大學(xué)學(xué)報(bào): 醫(yī)學(xué)版, 2011, 37(6): 1090-1093.
[13]韓春姬, 樸惠善, 李美子.一種提高輪葉黨參抗癌活性的方法: 中國(guó), 201110032025[P].2011-06-15.http://www.zlptt.com:6060/list.asp?ID=4446261.
[14]唐超莉, 匡志鵬, 楊帆, 等.化學(xué)誘導(dǎo)小鼠肝癌模型中CD133的動(dòng)態(tài)變化[J].腫瘤, 2012, 32(8): 585-591.
[15]鄭春姬, 俞星, 韓春姬.輪葉黨參皂苷對(duì)二乙基亞硝胺致肝細(xì)胞DNA 損傷的保護(hù)作用[J].食品科學(xué), 2013, 34(11): 254-257.
[16]KITCHIN KT, AHMAD S.Oxidative stress as a possible mode of action for arsenic carcinogenesis[J].Toxicol Lett, 2003, 137(1): 3-13.
[17]邢彩虹, 李桂蘭, 紀(jì)之瑩, 等.單細(xì)胞凝膠電泳圖像分析軟件的比較[J].毒理學(xué)雜志, 2005, 19(2): 141-143.
[18]LIU Jing, WANG Yuan, CUI Jinfeng, et al.Ochratoxin a induces oxidative DNA damage and G1 phase arrest in human peripheral blood mononuclear cellsin vitro[J].Toxicol Lett, 2012, 211(2): 164-171.
[19]KU Y P, JIN M, KIM K H, et al.Immunolocalization of 8-OHdG and OGG1 in pancreatic islets of streptozotocin-induced diabetic rats[J].Acta Histochemica, 2009, 111(2): 138-144.
[20]BRAVARD A, VACHER M, GOUGET B, et al.Redox regulation of human OGG1 activity in response to cellular oxidative stress[J].Mol Cell Bio, 2006, 26(20): 7430-7436.
[21]KUMAR A, PANT M C, SINGH H S, et al.Reduced expression of DNA repair genes (XRCC1, XPD, and OGG1) in squamous cell carcinoma of head and neck in North India[J].Tumour Biol, 2012,33(1): 111-119.
[22]FORKERT P G, MILLEN B, LASH L H, et al.Pulmonary bronchiolar cytotoxicity and formation of dichloroacetyl lysine protein adducts in mice treated with trichloroethylene[J].J Pharmacol Exp Ther, 2006,316(2): 520-529.
[23]GONZALEZ fJ.Role of cytochromes P450 in chemical toxicity and oxidative stress: studies with CYP2E1[J].Mutat Res, 2005, 569(1/2):101-110.
[24]BAI J, CEDERBAUM A I.Overexpression of CYP2E1 in mitochondria sensitizes HepG2 cells to the toxicity caused by depletion of glutathione[J].J Biol Chem, 2006, 281(8): 5128-5136.
[25]KIM S S, HA J H, JEONG M H, et al.Comparison of biological activities of fermented codonopsis lanceolata and freshCodonopsis lanceolata[J].Korean J Medicinal Crop Sci, 2009,17(4): 280-285.

