兩個實驗引發的思考
李傳慶
(如皋市搬經中學江蘇如皋226561)
兩個實驗引發的思考
李傳慶
(如皋市搬經中學江蘇如皋226561)
一般認為,鈉與水反應的實質是鈉與水電離出的氫離子(實際上是水合氫離子,下同)相作用生成氫氣。但筆者認為這種看法欠妥,這里就該問題作一個初步探討。
一、兩個實驗引發的思考
1.對這樣一個實驗大家都很熟悉:向硫酸銅(或其他銅鹽)的水溶液中投入一小塊金屬鈉,這時反應會迅速進行,反應后得到氫氣和氫氧化銅,同時得到鈉鹽。我們知道,在硫酸銅水溶液中存在的微粒有銅離子、硫酸根離子、氫離子、氫氧根離子、水分子,它們的濃度大小一般情況下應有H2O>SO42->Cu2+>H+>OH-。從電極電位來看:
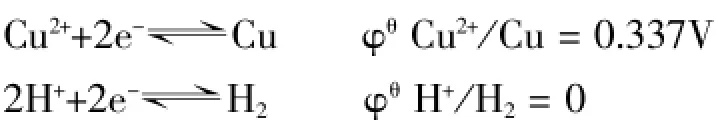
考慮溶液中離子濃度大小對電極電位的影響,根據奈斯特方程,設c(Cu2+)=0.1mol/L;c(H+)=0.1mol/L;p(H2)= 10-10atm,則有:
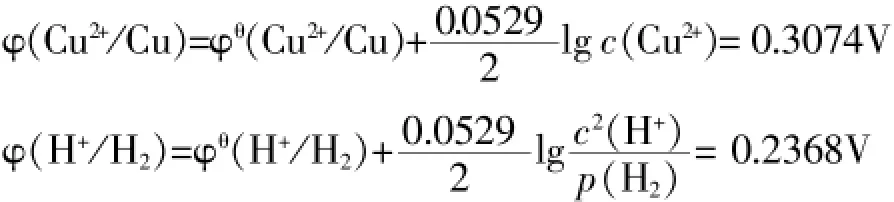
(說明:實際上c(H+)要比c(Cu2+)小,生成H2的分壓要遠大于10-10atm,這里是一種極端假設。也就是說φ H+/H2實際值要比上述數值小。)
從上述分析看,如果鈉跟水反應的實質是鈉跟水電離出的氫離子相作用的話,那么,鈉跟銅鹽溶液反應時得到的則應該是銅,而不是氫氣。與實驗結果相違背。
2.再看一個實驗:取兩塊大小相同的金屬鈉,分別投入純水和1mol/L的NaOH溶液中,發現反應所需的時間非常接近(說明:該反應由于很難準確進行定量測定,故很難給出準確的實驗結果,經過反復實驗,得到測定值約在1∶1.1左右)。如果鈉與水反應的實質是鈉跟水電離出的氫離子相作用,那么,根據質量作用定律,鈉投入氫氧化鈉溶液中的反應要遠比投入水中發生的反應慢。事實并非如此。
二、對兩個實驗的分析
我們知道,在銅鹽溶液中,除了Cu2+和H+能被鈉還原外,另外可以被還原的可能性最大的就是水。從電極電位分析:
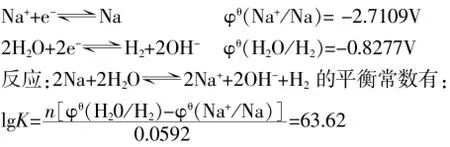
K=4.18×1063,說明該反應可以進行得非常完全。而且,溶液中的氧化還原反應進行的次序也不是完全由電動勢決定的。除電動勢(熱力學因素)以外,決定反應次序的還有動力學因素(反應速率)。對上述反應體系來說,溶液中水的濃度(接近55mol/L)要遠遠大于Cu2+和H+的濃度,鈉投入溶液中,首先與水接觸并反應,反應后生成的OH-又進一步與周圍溶液中的Cu2+和H+相作用,使Cu2+和H+濃度進一步降低(若設此時溶液中與鈉接觸的局部溶液c(OH-)=1×10-6mol/L,則由Ksp[Cu(OH)2]= 5.6×10-20可以求出c(Cu2+)=5.6×10-8mol/L;由Kw可求出c(H+)=1×10-8mol/L),使鈉與水接觸的機會大大超過了與銅離子和氫離子接觸的機會。由此可見,鈉與水反應的實質應是鈉與水分子直接反應,生成鈉離子、氫氧根離子和氫氣。當然,不完全排除鈉與氫離子和銅離子反應的可能性,但這兩個反應在這里相對來說實在是太弱了。類似的,由于在氫氧化鈉溶液中水分子的濃度與純水相比沒有明顯的差距,因此,鈉跟氫氧化鈉溶液的反應與鈉跟水的反應相比,速率上也就不會出現明顯的差異。
從結構上看,在水分子中,由于氧元素的電負性極大,使O-H鍵中的共用電子對強烈向氧原子偏移,O-H鍵上的氫原子受到的束縛力較小,且帶有部分的正電荷,當負極的電極電位遠遠小于-0.8277V時,水也可以獲得電子而被還原。
綜上所述,我認為,鈉跟水反應的實質應該是鈉跟水分子直接作用,而不是跟水電離出的氫離子相作用。
三、由鈉與水反應實質想到的
若上述結論是正確的,那么在氯堿工業中,陰極(其電極電位遠遠小于-0.8277V)的電極反應式就不能寫成而只能寫成2H2O+2e-
這樣,總反應式也就順理成章的寫成中學教材(如人教版普通高中課程標準實驗教科書化學選修4《化學反應原理》等)中將氯堿工業陰極的電極反應式寫成H2↑,在書寫總反應式時總有些別扭,解釋時總有牽強附會的嫌疑。同理,我認為在電解硫酸銅溶液時,其陽極的電極反應式只能寫成而不能
以上看法當否,懇請同行不吝賜教,但愿能起到拋磚引玉的效果。
[1]北師大等三校編.無機化學[M].北京:高等教育出版社,1992
1008-0546(2013)02-0079-01
G633.8
B
10.3969/j.issn.1008-0546.2013.02.031

