交聯(lián)草酸脫羧酶聚集體的制備及其性質(zhì)
梁 躍,林日輝,*,黃文勤,秦 夢(mèng),李香香,何美卿,鄭元博
(1.廣西民族大學(xué)化學(xué)化工學(xué)院,化學(xué)與生物轉(zhuǎn)化過程新技術(shù)廣西高校重點(diǎn)實(shí)驗(yàn)室,廣西 南寧 530006;2.南寧奕德環(huán)境科技有限公司,廣西 南寧 530003;3.東北大學(xué)理學(xué)院,遼寧 沈陽(yáng) 110819)
交聯(lián)草酸脫羧酶聚集體的制備及其性質(zhì)
梁 躍1,林日輝1,*,黃文勤2,秦 夢(mèng)1,李香香1,何美卿1,鄭元博3
(1.廣西民族大學(xué)化學(xué)化工學(xué)院,化學(xué)與生物轉(zhuǎn)化過程新技術(shù)廣西高校重點(diǎn)實(shí)驗(yàn)室,廣西 南寧 530006;2.南寧奕德環(huán)境科技有限公司,廣西 南寧 530003;3.東北大學(xué)理學(xué)院,遼寧 沈陽(yáng) 110819)
為了獲得緩解泌尿系統(tǒng)草酸鹽結(jié)石病癥的酶制劑,用無(wú)載體固定化方法üü交聯(lián)酶聚集體(CLEAs)制備交聯(lián)草酸脫羧酶聚集體。使用基因工程菌E.coli BL21(DE3)/pET32a/YvrK誘導(dǎo)表達(dá)制備草酸脫羧酶粗酶液,用30%的乙醇進(jìn)行沉淀分離提純,純化倍數(shù)為2.7倍,酶活回收率91.2%;在戊二醛添加量為0.06%、pH5、牛血清白蛋白添加量0.5g/L、4℃的條件下處理該酶2h,得到交聯(lián)草酸脫羧酶聚集體(oxdc-CLEAs),酶活回收率達(dá)95.4%;酶學(xué)性質(zhì)研究表明,相對(duì)游離草酸脫羧酶,交聯(lián)草酸脫羧酶聚集體的耐酸性、耐熱性、耐胰蛋白酶降解能力均有提高。
草酸脫羧酶;交聯(lián)酶聚集體(CLEAs);制備;性質(zhì)
草酸(HOOCüCOOH)是自然界中酸性最強(qiáng)的有機(jī)二元酸,它以草酸鹽的形式廣泛的存在于植物、微生物和包括人在內(nèi)的動(dòng)物體內(nèi)[1]。人體內(nèi)沒有降解草酸鹽的相關(guān)酶,人們食用一些高草酸含量的食物后容易的造成草酸在人體內(nèi)的積累,進(jìn)而引發(fā)多種病理狀態(tài),如尿結(jié)石、腎結(jié)石、高草酸尿、低血鈣癥、VB6缺乏等[2-3],對(duì)結(jié)石主要成分的分析表明,80%為難溶的草酸鈣[3]。在西方國(guó)家中,12%的人患有結(jié)石相關(guān)的疾病,而且泌尿系統(tǒng)結(jié)石病人經(jīng)排石治療后易復(fù)發(fā),在中國(guó)復(fù)發(fā)率高達(dá)60%~80%[4]。目前對(duì)草酸水平升高的治療方法都不是非常有效,主要通過限制草酸的攝入量來預(yù)防結(jié)石,而且許多原發(fā)性的高草酸尿患者需要密集的透析和器官移植,這大大增加了患者的痛苦和經(jīng)濟(jì)壓力,因此需要尋求一種安全的從體內(nèi)去除草酸鹽的方法。通過服用某種酶制劑降解攝入體內(nèi)的草酸鹽,是緩解泌尿系統(tǒng)草酸鹽結(jié)石病癥,降低患者痛苦的有效方法[5]。
草酸脫羧酶(EC 4.1.1.2)是一種含錳的金屬酶,它可以催化草酸脫羧為甲酸和CO2,是植物、微生物中草酸代謝降解的主要催化酶之一[6]。它主要來源于木材腐朽真菌,尤其是白腐菌,在動(dòng)物中只有天竺鼠的肝臟中有發(fā)現(xiàn)該酶[7]。草酸脫羧酶在醫(yī)療、食品、工業(yè)生產(chǎn)和生物監(jiān)測(cè)等領(lǐng)域都有非常大的應(yīng)用潛力[8-9]。目前已有交聯(lián)酶晶體法(CLECs)制成草酸脫羧酶酶制劑用于治療草酸鹽結(jié)石癥的報(bào)道[10],但交聯(lián)草酸脫羧酶晶體(oxdc-CLECs)的制備必須首先經(jīng)過酶分子的結(jié)晶,所需的酶純化程度和結(jié)晶條件都很高,操作困難,費(fèi)用較高。2000年,荷蘭Delft大學(xué)的Sheldon小組提出了交聯(lián)酶聚集體(CLEAs)的固定化酶技術(shù),該方法經(jīng)過聚集和交聯(lián)兩個(gè)過程,聚集過程并沒有造成蛋白質(zhì)的失活[11-12]。與交聯(lián)酶晶體法固定化技術(shù)相比,交聯(lián)酶聚集體(CLEAs)方法具有對(duì)酶的純化度要求不高、操作簡(jiǎn)單、成本低廉、設(shè)備簡(jiǎn)單、單位體積活性大、空間效率高的優(yōu)點(diǎn)[11,13]。本實(shí)驗(yàn)對(duì)Bacillus subtilis來源的草酸脫羧酶進(jìn)行誘導(dǎo)表達(dá),制取草酸脫羧酶粗酶液,研究交聯(lián)草酸脫羧酶聚集體(oxdc-CLEAs)制備的最適條件,并對(duì)交聯(lián)草酸脫羧酶的性質(zhì)進(jìn)行研究,為草酸脫羧酶進(jìn)一步的開發(fā)應(yīng)用提供理論基礎(chǔ)。
1 材料與方法
1.1 菌種與培養(yǎng)基
基因工程菌E.coli BL21(DE3)/pET32a/YvrK 本實(shí)驗(yàn)室保存。
LB培養(yǎng)基組成(g/L):培養(yǎng)基含蛋白胨 10、酵母提取物5、氯化鈉10g,pH7.0。LB固體培養(yǎng)基添加18g瓊脂粉。
1.2 試劑與儀器
草酸鉀、甲酸脫氫酶 美國(guó)Sigma公司;氨芐青霉素、異丙基硫代-β-D-半乳糖苷(IPTG)、煙酰胺腺嘌呤二核苷酸磷酸(NAD)、牛血清白蛋白(BSA)、胰蛋白酶生工生物工程(上海)有限公司;無(wú)水乙醇、丙酮、戊二醛、甲酸鈉、硫酸銨、檸檬酸、磷酸氫二鈉、磷酸二氫鈉、磷酸氫二鉀、MnCl2均為國(guó)產(chǎn)分析純。
TU-1901紫外-可見分光光度計(jì) 北京普析通用儀器;CR-22G高速冷凍離心機(jī) 日本日立公司; 1-13高速臺(tái)式離心機(jī) 美國(guó)Sigma公司;超低溫冰箱 美國(guó)Beckman公司;冰箱 中國(guó)海爾公司;JY92-Ⅱ超聲波細(xì)胞粉碎機(jī) 寧波新芝公司;KJMR-Ⅳ血液混勻器、HH-2數(shù)顯恒溫水浴鍋 國(guó)華電器公司。
1.3 方法
1.3.1 草酸脫羧酶的誘導(dǎo)表達(dá)
[14]方法,發(fā)酵培養(yǎng)基因工程菌E.coli BL21(DE3)/pET32a/YvrK,加入0.4mmol/L IPTG誘導(dǎo)表達(dá)草酸脫羧酶,收獲菌體以50mmol/L pH8.0磷酸鹽緩沖液提取獲得粗酶液。
1.3.2 草酸脫羧酶的純化
草酸脫羧酶粗酶液分別加入不同添加量的硫酸銨,無(wú)水乙醇和丙酮,4℃冰箱中過夜沉淀,10000r/min離心5min,收集沉淀,用50mmol/L pH8.0磷酸鹽緩沖液重新溶解,分析酶活力回收及純化效果。
1.3.3 草酸脫羧酶聚集體的制備與交聯(lián)
取純化酶液加入適量沉淀劑,4℃冰箱沉淀過夜,得到草酸脫羧酶聚集體懸浮液。添加戊二醛溶液至一定添加量,置于血液混合器進(jìn)行振蕩反應(yīng),10000r/min離心5min,棄上清液,用50mmol/L pH8.0磷酸鹽緩沖液沖洗沉淀數(shù)次,獲得交聯(lián)草酸脫羧酶聚集體,4℃保存待用。
1.3.4 游離草酸脫羧酶和交聯(lián)草酸脫羧酶聚集體的活性測(cè)定
草酸脫羧酶活力測(cè)定采用終止反應(yīng)法[15]。反應(yīng)液含76mmol/L草酸鉀,50mmol/L pH 4.0 檸檬酸緩沖液,37℃水浴2min,加入草酸脫羧酶液開始反應(yīng),10min后加入等體積的0.2mol/L磷酸氫二鉀使體系pH值上升至中性終止反應(yīng)。反應(yīng)液加入輔酶NAD以及甲酸脫氫酶,分光光度法檢測(cè)分析,計(jì)算甲酸的量。酶活力單位定義為:每分鐘催化轉(zhuǎn)化草酸產(chǎn)生1μmol甲酸的酶量。
蛋白含量采用考馬斯亮藍(lán)法測(cè)定,以BSA作為標(biāo)準(zhǔn)品。
1.3.5 交聯(lián)草酸脫羧酶聚集體的制備與條件優(yōu)化
在不同戊二醛添加量、交聯(lián)pH值、交聯(lián)時(shí)間、BSA添加量條件下,比較制備交聯(lián)草酸脫羧酶聚集體的酶活回收率,以初始草酸脫羧酶酶活力為100%。
1.3.6 游離草酸脫羧酶與交聯(lián)草酸脫羧酶聚集體的性質(zhì)
1.3.6.1 最適pH值
在pH2.5~7.0的不同檸檬酸緩沖液反應(yīng)體系中分別測(cè)定酶活力,以酶活力最高數(shù)據(jù)為100%,計(jì)算相對(duì)酶活力,觀察pH值對(duì)游離酶和交聯(lián)酶聚集體活性的影響。
1.3.6.2 最適反應(yīng)溫度
反應(yīng)檸檬酸緩沖液pH 4.0,在不同溫度條件下分別測(cè)定酶活力,以酶活力最高數(shù)據(jù)為100%,計(jì)算不同溫度條件下的相對(duì)酶活力,觀察游離酶和交聯(lián)酶聚集體反應(yīng)的最適溫度。
1.3.6.3 耐熱性
游離酶與交聯(lián)酶聚集體在不同溫度條件下熱處理30min后測(cè)殘余酶活力,以初始酶活力為100%,觀察處理后酶活力的變化。將游離酶和交聯(lián)酶聚集體置于65℃水浴,每30min取樣檢測(cè)殘余酶活力,以初始時(shí)間的酶活力為100%。
1.3.6.4 對(duì)胰蛋白酶的耐受性
分別取4.5mL游離酶和交聯(lián)酶聚集體,加入2.5g/L的胰蛋白酶溶液0.5mL,37℃水浴,定時(shí)取樣檢測(cè)剩余酶活力,以原始活性數(shù)據(jù)為100%酶活力,觀察游離酶和交聯(lián)酶聚集體對(duì)抗胰蛋白酶消化的能力。
2 結(jié)果與分析
2.1 草酸脫羧酶的表達(dá)
基因工程菌E.coli BL21(DE3)/pET32a/YvrK經(jīng)IPTG誘導(dǎo)及超聲破碎細(xì)胞提取后得到草酸脫羧酶粗酶液,酶活力為7.078U/mL,蛋白含量為1.12mg/mL,酶比活力為6.315U/mg。
2.2 草酸脫羧酶的分離純化
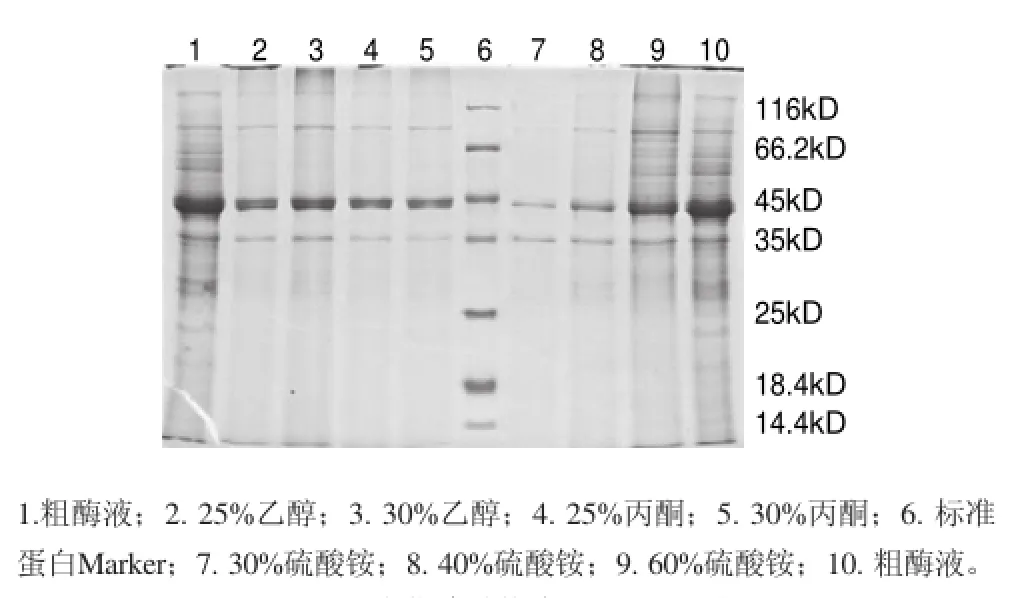
圖 1 沉淀草酸脫羧酶SDS-PAGE結(jié)果Fig.1 SDS-PAGE of crude enzyme solution and different solvent precipitates
用不同質(zhì)量分?jǐn)?shù)的硫酸銨、丙酮和乙醇對(duì)草酸脫羧酶進(jìn)行沉淀分離,重溶沉淀SDS-PAGE結(jié)果如圖1所示。草酸脫羧酶易于被實(shí)驗(yàn)所用3種沉淀劑沉淀釋出,但丙酮和乙醇對(duì)草酸脫羧酶沉淀的選擇性優(yōu)于硫酸銨。其中,使用30%乙醇分離純化草酸脫羧酶效果良好,可去除粗酶液中66.2%的蛋白,酶活回收率達(dá)91.2%,純化倍數(shù)為2.7倍,比30%丙酮純化倍數(shù)提高了17.4%,因此后續(xù)實(shí)驗(yàn)選擇30%乙醇做為沉淀劑。
2.3 交聯(lián)草酸脫羧酶聚集體的制備與條件優(yōu)化
2.3.1 酶聚集體的制備
取適量純化酶液于2mL離心管緩慢滴加無(wú)水乙醇至乙醇體積分?jǐn)?shù)30%,4℃冰箱沉淀過夜得到草酸脫羧酶聚集體懸浮液。
2.3.2 交聯(lián)劑添加量的確定
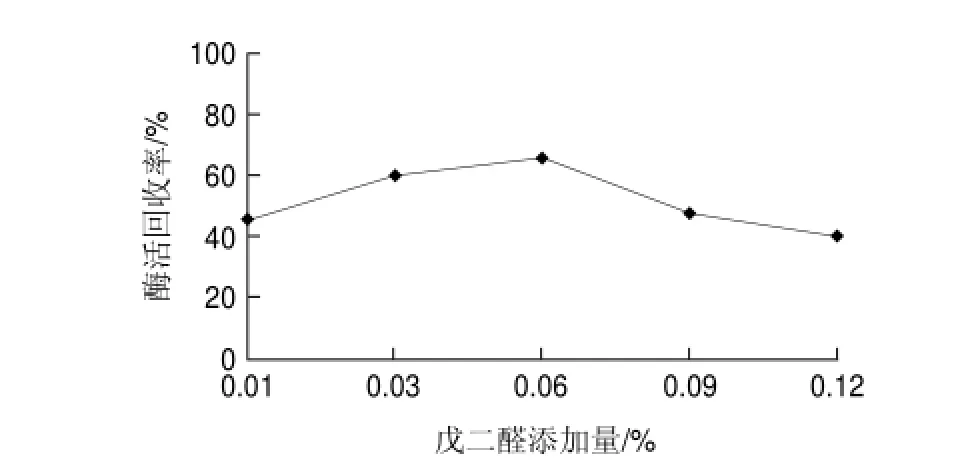
圖 2 戊二醛添加量對(duì)交聯(lián)反應(yīng)的影響Fig.2 Effect of glutaraldehyde concentration on activity recovery
由圖2可知,當(dāng)戊二醛添加量低于0.06%,交聯(lián)酶聚集體活力回收隨戊二醛添加量的增加而增加,但當(dāng)戊二醛添加量到達(dá)0.06%之后,酶活回收率隨戊二醛添加量的增加而顯著降低。推測(cè)是由于戊二醛添加量過高時(shí),會(huì)造成一定的空間范圍內(nèi)酶分子的交聯(lián)過于緊密,產(chǎn)生空間位阻而影響酶的活性[16],而且過高添加量戊二醛對(duì)酶分子的變性失活也是影響因素之一,因此0.06%的戊二醛是進(jìn)行交聯(lián)反應(yīng)的適宜添加量。
2.3.3 交聯(lián)反應(yīng)pH值的確定
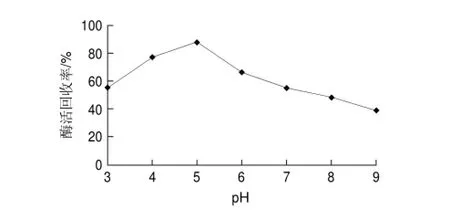
圖 3 不同交聯(lián)pH值對(duì)交聯(lián)反應(yīng)的影響Fig.3 Effect of cross-linking pH on activity recovery
由圖3可知,在磷酸鹽緩沖液pH5條件下獲得交聯(lián)酶聚集體的酶活回收率最高。這是由于草酸脫羧酶的等電點(diǎn)在5附近[17],在此pH值條件下草酸脫羧酶聚集體沉淀較完全,經(jīng)交聯(lián)反應(yīng)后酶活回收率也較高,因此選擇交聯(lián)反應(yīng)pH值為5。
2.3.4 交聯(lián)時(shí)間的確定
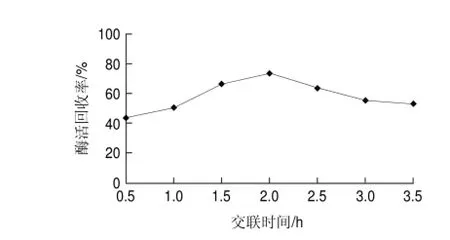
圖 4 不同交聯(lián)時(shí)間對(duì)交聯(lián)反應(yīng)的影響Fig.4 Effect of cross-linking time on activity recovery
由圖4可知,在2h反應(yīng)時(shí)間內(nèi),交聯(lián)酶聚集體的酶活回收率隨著交聯(lián)時(shí)間的增加而增加,2h后,隨著時(shí)間的延長(zhǎng),酶活回收率反而不斷下降,該結(jié)果與董曉毅等[18]在制備交聯(lián)脲酶聚集體研究相似,可見,交聯(lián)反應(yīng)過度反而會(huì)降低交聯(lián)酶聚集體的酶活回收率,因此確定2h為適宜的交聯(lián)反應(yīng)時(shí)間。
陶行知先生說:“先生的責(zé)任不在教,而在教學(xué),而在教學(xué)生學(xué)。”在“學(xué)為中心”的課堂中,教師要設(shè)法將如何“教”的預(yù)設(shè),轉(zhuǎn)化成學(xué)生的“學(xué)”的引導(dǎo),以極大地激發(fā)學(xué)生的學(xué)習(xí)興趣。
2.3.5 添加BSA對(duì)交聯(lián)效果的影響
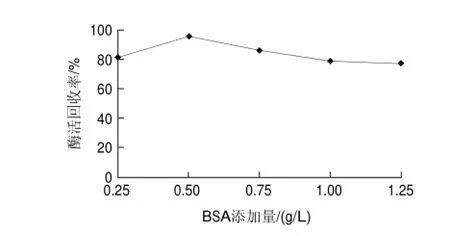
圖 5 BSA添加量對(duì)交聯(lián)反應(yīng)的影響Fig.5 Effect of BSA concentration on activity recovery
Shah等[19]研究表明,對(duì)于酶蛋白濃度較低或戊二醛對(duì)酶活力影響比較大的酶,在制備交聯(lián)酶聚集體的反應(yīng)中加入適量的BSA,可以顯著提高交聯(lián)酶聚集體的酶活回收率。由圖5可知,添加到終質(zhì)量濃度為0.5g/L的效果最佳,過量添加BSA可能會(huì)影響酶活性中心與底物的接觸,而降低交聯(lián)草酸脫羧酶聚集體活性。
2.4 游離酶與交聯(lián)酶聚集體的性質(zhì)比較
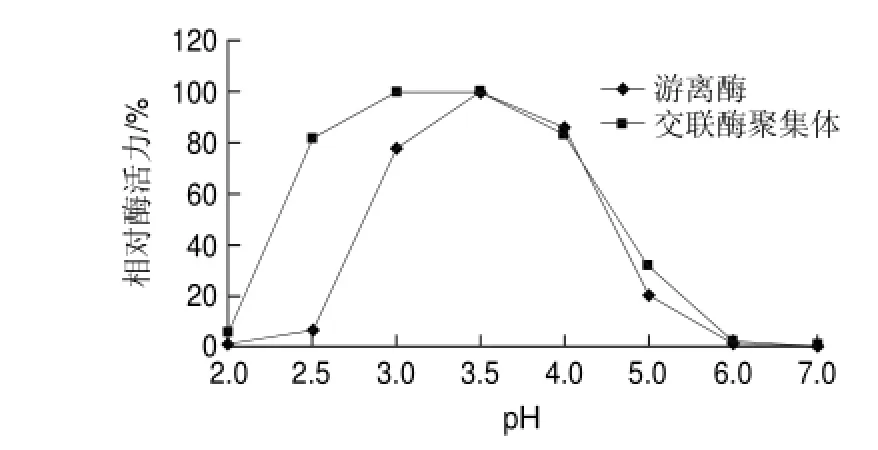
圖 6 游離草酸脫羧酶與交聯(lián)草酸脫羧酶聚集體的最適pH值Fig.6 Optimal reaction pH for oxdc-CLEAs and free oxdc
2.4.1 交聯(lián)酶聚集體的最適反應(yīng)pH值由圖6可知,交聯(lián)草酸脫羧酶聚集體的反應(yīng)pH值范圍比游離草酸脫羧酶寬泛,在pH2.5時(shí)交聯(lián)草酸脫羧酶聚集體還有80%的相對(duì)酶活力,而游離草酸脫羧酶只剩10%不到,這與潘延芳等[20]在交聯(lián)重組枯草桿菌纖溶酶聚集體的制備及其性質(zhì)研究中的結(jié)果相似,說明交聯(lián)聚集后的酶對(duì)酸性環(huán)境耐受能力更強(qiáng)。
2.4.2 交聯(lián)酶聚集體的最適反應(yīng)溫度
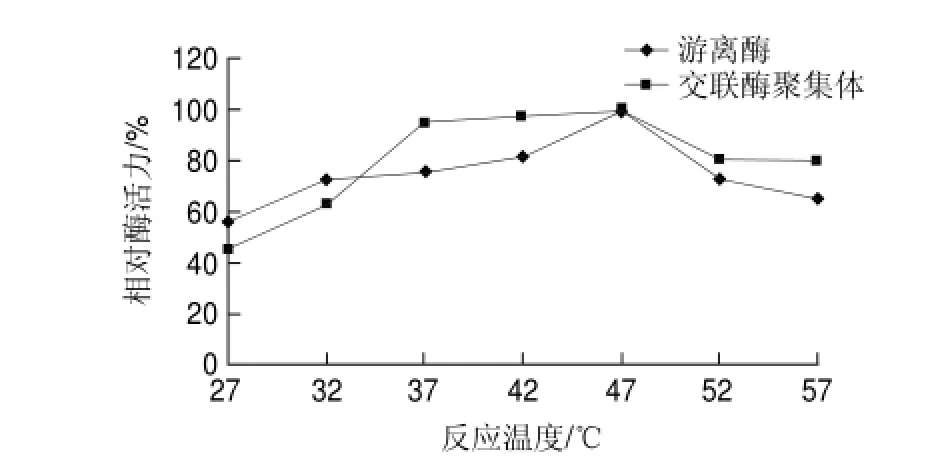
圖 7 游離草酸脫羧酶與交聯(lián)草酸脫羧酶聚集體的最適反應(yīng)溫度Fig.7 Optimal reaction temperature for oxdc-CLEAs and free oxdc
由圖7可知,游離草酸脫羧酶和交聯(lián)草酸脫羧酶聚集體的最適反應(yīng)溫度均在47℃左右。
2.4.3 交聯(lián)酶聚集體的耐熱性
分別在45、50、55、60、65、70、75℃條件下處理游離草酸脫羧酶與交聯(lián)草酸脫羧酶聚集體30min,檢測(cè)殘余酶活力,結(jié)果如圖8所示,交聯(lián)草酸脫羧酶聚集體比游離草酸脫羧酶更耐熱。在實(shí)驗(yàn)條件下,游離草酸脫羧酶的變性失活溫度低于65℃,交聯(lián)草酸脫羧酶聚集體的變性失活溫度高于70℃;其中,在75℃處理30min,游離草酸脫羧酶的殘余酶活力僅為13.4%,而交聯(lián)草酸脫羧酶聚集體的殘余酶活力高達(dá)77.1%。將游離草酸脫羧酶與交聯(lián)酶聚集體分別置于65℃水浴,每隔30min測(cè)酶活力,結(jié)果如圖9所示。3.5h內(nèi),交聯(lián)草酸脫羧酶聚集體酶活力基本無(wú)損失,游離草酸脫羧酶在65℃溫浴酶活逐漸發(fā)生變性失活,半衰期t1/2為2h。推測(cè)是由于酶交聯(lián)后分子質(zhì)量變大,剛性增強(qiáng)進(jìn)而可以耐受較高的溫度。此結(jié)論與交聯(lián)脲酶優(yōu)良的耐熱性有相似之處[18]。
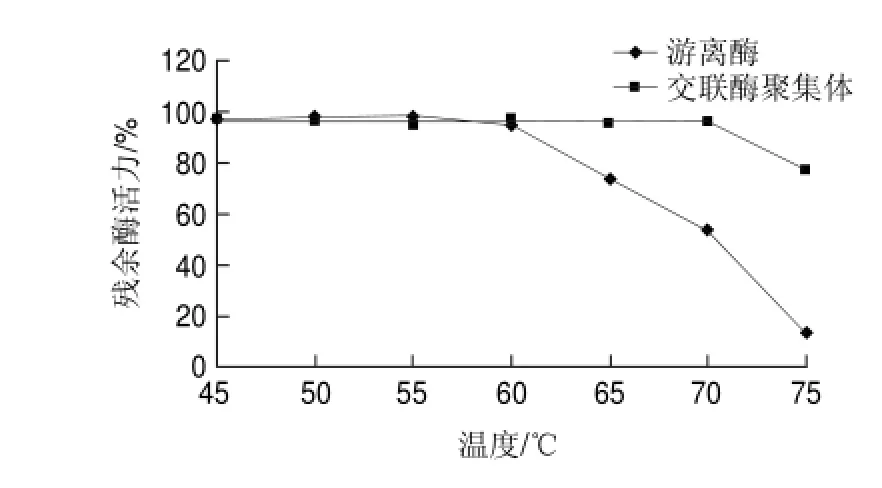
圖 8 游離草酸脫羧酶與交聯(lián)草酸脫羧酶聚集體的耐熱性Fig.8 Heat tolerance of free oxdc and oxdc-CLEAs
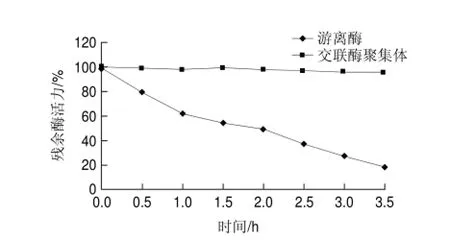
圖 9 65℃游離草酸脫羧酶與交聯(lián)草酸脫羧酶聚集體的熱穩(wěn)定性Fig.9 Thermal stability of free oxdc and oxdc-CLEAs at 65 ℃
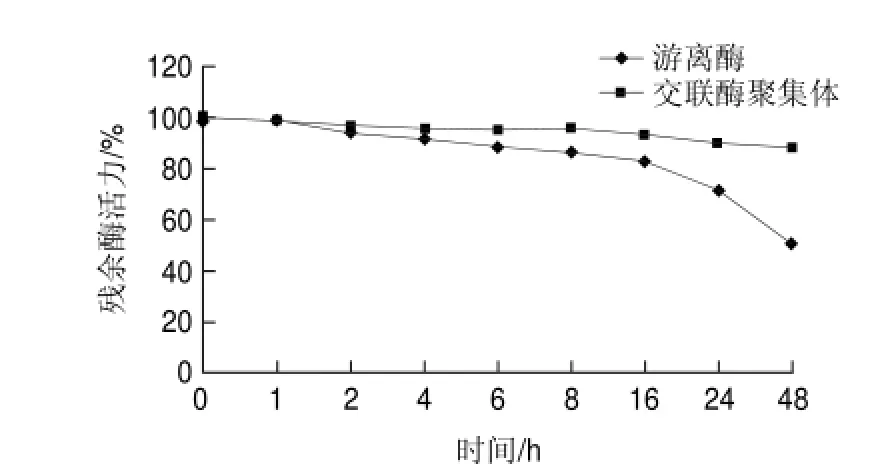
圖 10 游離草酸脫羧酶與交聯(lián)草酸脫羧酶聚集體對(duì)胰蛋白酶的耐受性Fig.10 Tripsin resistance of free oxdc and oxdc-CLEAs
由圖10可知,交聯(lián)草酸脫羧酶聚集體對(duì)胰蛋白酶消化的耐受能力顯著高于游離草酸脫羧酶,其中,使用胰蛋白酶處理48h后,交聯(lián)草酸脫羧酶殘余酶活力大于80%,而游離草酸脫羧酶殘余酶活力低于50%。這是由于交聯(lián)草酸脫羧酶具有相對(duì)有序的蛋白質(zhì)三維結(jié)構(gòu),大分子的蛋白水解酶被排斥在外而降低了它對(duì)酶的水解作用。交聯(lián)草酸脫羧酶聚集體要做成酶制劑藥物作用于人體內(nèi)就必須能夠通過胃酸屏障并對(duì)胃腸道內(nèi)的蛋白水解酶如胰蛋白酶等有一定耐受性,使其藥效不至于損失過快。實(shí)驗(yàn)結(jié)果表明,通過制備交聯(lián)酶聚集體,可體提高草酸脫羧酶抵抗胰蛋白酶消化的能力,適用于開發(fā)藥用酶制劑。
3 結(jié) 論
草酸鹽在人體內(nèi)的積累是形成泌尿系統(tǒng)結(jié)石的主要因素,現(xiàn)有的治療草酸鹽升高的方法如食用高劑量藥物,調(diào)節(jié)飲食和透析等僅僅是部分或暫時(shí)有效的,而且它們還可能產(chǎn)生不利的副作用,因此需要一種安全的從人體去除草酸鹽的方法。草酸脫羧酶是一種極具開發(fā)潛力的酶,它可以高效專一的分解草酸鹽生成無(wú)害的甲酸。為了探索利用草酸脫羧酶制成酶制劑以緩解泌尿系統(tǒng)結(jié)石病患者的痛苦,國(guó)外已有學(xué)者對(duì)高純度的草酸脫羧酶進(jìn)行結(jié)晶處理并進(jìn)行交聯(lián)固定制成CLECs酶制劑,此種方法需要高純度的酶和結(jié)晶處理,操作難度大,制作成本高。為了降低獲得草酸脫羧酶酶制劑的成本,本實(shí)驗(yàn)研究了無(wú)載體固定化方法制備交聯(lián)草酸脫羧酶聚集體的方法,用30%乙醇對(duì)草酸脫羧酶粗酶液進(jìn)行沉淀分離,操作簡(jiǎn)單,費(fèi)用低廉,純化效果好;用0.06%戊二醛添加量在pH5的磷酸鹽緩沖液中添加0.5g/L的BSA交聯(lián)2h得到交聯(lián)草酸脫羧酶聚集體,酶活回收率達(dá)95.4%。對(duì)其性質(zhì)進(jìn)一步研究表明交聯(lián)草酸脫羧酶聚集體的耐酸性、耐熱性、對(duì)胰蛋白酶的耐受性均比游離草酸脫羧酶穩(wěn)定。本研究為草酸脫羧酶作為預(yù)防、治療結(jié)石的酶制劑的開發(fā)應(yīng)用提供一定的參考。
CLEAs技術(shù)是一種新的無(wú)載體技術(shù),它不需要純度較高的酶就能用于交聯(lián),操作簡(jiǎn)便,在一般實(shí)驗(yàn)室就能完成,而且成本低廉,不需要復(fù)雜的酶純化結(jié)晶處理,是一種非常有前景的固定化技術(shù),本研究考察了用草酸脫羧酶粗酶液經(jīng)一步沉淀分離后進(jìn)行無(wú)載體交聯(lián)固定化的方法,為交聯(lián)酶聚集體技術(shù)的進(jìn)一步運(yùn)用提供了理論依據(jù)。
參考文獻(xiàn):
[1] JUST V J, STEVENSON C E M, BOWATER L, et al. A Closed conformation of Bacillus subtilis oxalate decarboxylase oxdc provides evidence for the true identity of the active site[J]. The Journal of Biological Chemistry, 2004, 279(19): 19867-19874.
[2] 董婷婷, 袁杰利. 利用乳酸菌降解草酸預(yù)防結(jié)石的研究進(jìn)展[J]. 中國(guó)微生態(tài)學(xué)雜志, 2011, 23(3): 266.
[3] COE F L, EVAN A, WORCESTER E. Kidney stone disease[J]. The Journal of Clinical Investigation, 2005, 115(10): 2598-2608.
[4] 代海濤, 陳志強(qiáng), 葉章群. 草酸、草酸鈣晶體-上皮細(xì)胞相互作用與腎結(jié)石[J]. 國(guó)際泌尿系統(tǒng)雜志, 2006, 26(2): 254.
[5] GRUJIC D, SALIDO E C, SHENOY B C, et al. Hyperoxaluria is reduced and nephrocalcinosis prevented with an oxalate-degrading enzyme in mice with hyperoxaluria[J]. Am J Nephrol, 2009, 29(2): 86-93.
[6] 趙樹田, 張士青. 草酸代謝酶的研究進(jìn)展[J]. 上海交通大學(xué)學(xué)報(bào): 醫(yī)學(xué)版, 2007, 27(10): 1274-1277.
[7] TALWAR H S, MURTHY M S R, NATH R, et al. Oxalate decarboxylase from guinea-pig liver[J]. Biochem Biophys, 1981, 18: 105-109.
[8] 曹茂新, 洪楓, 朱利民. 草酸脫羧酶及其應(yīng)用[J]. 中國(guó)生物工程雜志, 2005(增刊1): 170-175.
[9] SJODE A, WINESTRAND S, NILVEBRANT N O, et al. Enzymebased control of oxalic acid in the pulp and paper industry[J]. Enzyme and Microbial Technology, 2008, 43(4): 78-83.
[10] 阿爾特斯制藥公司. 結(jié)晶化的草酸脫羧酶和使用方法: 中國(guó), 200780035792[P]. 2009-11-18.
[11] 張茜, 王家東. 交聯(lián)糖化酶聚集體的制備[J]. 中國(guó)釀造, 2008(23): 67-69.
[12] AYTAR B S, BAKIR U. Preparation of cross-linked tyrosinase aggregates[J]. Proeess Biochemistry, 2008, 43: 125-131.
[13] 武仙山, 何立千, 葉磊. 交聯(lián)酶聚集體: 一種無(wú)載體固定化方法[J].生物技術(shù), 2005, 15(2): 90-92.
[14] 林日輝, 許麗莉, 農(nóng)勉, 等. 重組草酸脫羧酶的表達(dá)及酶學(xué)性質(zhì)研究[J]. 食品與發(fā)酵工業(yè), 2011, 37(2): 57-61.
[15] SVEDRUZI? D, LIU Y, REINHARDT L A, et al. Investigating the roles of putative active site residues in the oxalate decarboxylase from Bacillus subtilis[J]. Arch Biochem Biophys, 2007, 464(1): 36-47.
[16] MONTORO-GARCíA S, GIL-ORTIZ F, NAVARRO-FERNáNDEZ J, et al. Improved cross-linked enzyme aggregates for the production of desacetyl β-lactam antibiotics intermediates[J]. Bioresource Technology, 2010, 101(1): 331-336.
[17] ANAND R, DORRESTEIN P C, KINSLAND C, et al. Structure of oxalate decarboxylase from Bacillus subtilis at 1.75 ? resolution[J]. Biochemistry, 2002, 41(24): 7659-7669.
[18] 董曉毅, 夏仕文. 交聯(lián)脲酶聚集體的制備和初步應(yīng)用[J]. 生物工程學(xué)報(bào), 2003, 19(3): 332-336.
[19] SHAH S, SHARMA A, GUPTA M N. Preparation of cross-linked enzyme aggregates by using bovine serum albumin as a proteic feeder[J]. Analytical Biochemistry, 2006, 351: 207-213.
[20] 潘延芳, 孔珊珊, 陳怡倩, 等. 交聯(lián)重組枯草桿菌纖溶酶聚集體的制備及其性質(zhì)研究[J]. 中國(guó)生化藥物雜志, 2007, 28(5): 318-321.
Preparation and Properties of Cross-Linked Oxalate Decarboxylase Aggregates
LIANG Yue1,LIN Ri-hui1,*,HUANG Wen-qin2,QIN Meng1,LI Xiang-xiang1,HE Mei-qing1,ZHENG Yuan-bo3
(1. Key Laboratory of New Techniques for Chemical and Biological Conversion Process, College of Chemistry and Chemical Engineering, Guangxi University for Nationalities, Nanning 530006, China;2. Nanning Yide Environment Technology Co. Ltd., Nanning 530003, China;3. College of Sciences, Northeastern University, Shenyang 110819, China)
Cross-linked oxalate decarboxylase aggregates (oxdc-CLEAs) for use as an enzyme preparation to relieve urinary oxalate stone disease were prepared by a carrier-free immobilization method. Crude enzyme solution was obtained from the induced expression of the genetically engineered strain E.coli BL21(DE3)/pET32a/YvrK, and oxalate decarboxylase was separated by adding 30% ethanol with a purification factor of 2.7 and an activity recovery of 91.2%. Cross-linked oxdc-CLEAs were further obtained after 2 h of cold treatment at 4 ℃ in the presence of 0.5 g/L bovine serum albumin (BSA) and 0.06% glutaraldehyde at pH 5, resulting in an activity recovery of 95.4%. Enzymatic characterization showed that cross-linked oxdc-CLEAs had improved tolerance to acid, heat and trypsin degradation when compared to free oxalate decarboxylase.
oxalate decarboxylase;cross-linked enzyme aggregates;preparation;properties
Q814.4
A
1002-6630(2013)01-0215-05
2011-11-11
廣西化工過程創(chuàng)新技術(shù)研發(fā)平臺(tái)建設(shè)項(xiàng)目(桂科能0992028-13);廣西自然科學(xué)基金項(xiàng)目(2011GXNSFC018015)
梁躍(1985ü),男,碩士研究生,主要從事化學(xué)與生物轉(zhuǎn)化研究。E-mail:lyyue1013@126.com.cn
*通信作者:林日輝(1972ü),男,副教授,博士,主要從事發(fā)酵工程、酶工程研究。E-mail:linrihui_0@yahoo.com.cn

