蝦類過敏原及消減方法研究進展
胡志和
(天津市食品生物技術重點實驗室,天津商業大學生物技術與食品科學學院,天津 300134)
蝦類過敏原及消減方法研究進展
胡志和
(天津市食品生物技術重點實驗室,天津商業大學生物技術與食品科學學院,天津 300134)
蝦及其制品味道鮮美,營養豐富,但卻具有較高的致敏性。本文綜述國內外有關蝦類主要過敏原üü原肌球蛋白的結構、表位預測與定位、變態反應原性檢測及脫敏方法等方面的研究進展,為進一步研究蝦類過敏原及其消減技術提供一定的參考。
海蝦;過敏原;原肌球蛋白;過敏反應原性
自古以來,海洋一直是人類食物的主要來源之一,海洋食品是由各種海洋有機體構成的,但人類對它們中的多數產生過敏。蝦及其制品味道鮮美,營養豐富,越來越受到消費者的喜愛,是百姓餐桌上常見的水產品。然而,蝦及其制品卻具有致敏性,約有20%的過敏病人對蝦過敏,小兒發病率高達60%,嚴重影響了患者的生活質量。因此,學者們針對蝦的過敏物質展開了一系列的研究。本文針對目前國內外有關蝦類主要過敏原üü原肌球蛋白的結構、表位預測與定位、過敏反應原性檢測及脫敏方法等方面的研究進展進行綜述。
1 蝦類原肌球蛋白結構及表位
蝦中存在的過敏原種類比較多,但目前為止研究比較清楚的是其主要過敏原Pen a 1和Pen c 1,二者都來源于肌肉組織中的原肌球蛋白。
1993年,Shanti等[1]以印度對蝦為原料研究確定原肌球蛋白是其主要過敏原,并對其IgE的結合表位特性進行鑒定,結果顯示其分子質量為34kD,等電點為4.8~5.4,IgE結合表位為肽鏈的50~66和153~161片段。1994年,Daul等[2]以褐對蝦(Penaeus aztecus)為原料研究確定了該蝦的主要過敏原也是原肌球蛋白,其分子質量為36kD,并將其命名為Pena1。同年,Leung等[3]對刀額新對蝦(Metapenaeus ensis)的原肌球蛋白進行克隆表達,并進行氨基酸測序,結果顯示,該蝦的原肌球蛋白有281個氨基酸殘基,分子質量為34kD。此后研究發現,原肌球蛋白不僅是蝦的主要過敏原,同時也是龍蝦和蟹類等甲殼類水產品的主要過敏原[4-6]。因此,各國研究者對不同蝦類原肌球蛋白的基因克隆與序列分析、重組表達與致敏性及交叉反應分析、致敏原因分析、脫敏和檢測等方面進行了研究。2006年,Reese等[7]提取褐對蝦(Penaeus aztecus)的過敏原蛋白并進行克隆表達,對天然和重組后的過敏原蛋白的分子二級結構和免疫學參數進行研究,結果顯示天然和重組后的蛋白具有а-螺旋構象,為典型的原肌球蛋白,由284個氨基酸殘基組成。2008年,Nakano等[8]對2種磷蝦(Euphausia superba和E. pacifica)的原肌球蛋白和變態反應原性進行研究,發現2種磷蝦的原肌球蛋白由284個氨基酸殘基組成,分子質量為38kD,與龍蝦和螃蟹的原肌球蛋白顯著一致。2007年,Motoyama等[9]研究發現6種甲殼類水產(black tiger prawn、kuruma prawn、pink shrimp、king crab、snow crab、horsehair crab)的原肌球蛋白為主要過敏原,并對不同品種和不同部位的原肌球蛋白的氨基酸序列進行分析,發現快速和舒緩原肌球蛋白的氨基酸序列具有90%的一致性。2008年,Motoyama等[10]比較了南極磷蝦(Euphausia superb)和蝦蛄的原肌球蛋白,發現二者的氨基酸序列有82.4%~89.8%的一致性,均具有變態反應原性,但蝦蛄中原肌球蛋白含量很低。除了原肌球蛋白以外,2008年,Ayuso等[11]研究發現,蝦的肌球蛋白輕鏈是一種新的過敏原,并將其命名為Lit v 3。
對于水產品中甲殼綱動物和軟體動物之間的過敏原的相關性,2007年,Suma等[12]研究了2種十足類動物(American lobster Homarus americanus and black tiger prawn Penaeus monodon)和2種藤壺(acorn barnacle Balanus rostratus and goose barnacle Capitulum mitella)的原肌球蛋白的變態反應原性,證明2種原肌球蛋白具有交叉反應,但氨基酸序列的一致性較低,通過重組DNA克隆發現,藤壺的原肌球蛋白與鮑魚具有高度的一致性,應屬于軟體動物家族。2009年,Emoto等[13]研究了4種腹足動物(disc abalone、turban shell、whelk、Middendorf’s buccinum)和6種雙貝類動物(bloody cockle、Japanese oyster、Japanese cockle、surf clam、horse clam、razor clam、shortneckclam),發現原肌球蛋白是主要過敏原,且彼此間具有交叉反應;通過對各自的原肌球蛋白氨基酸序列分析,發現同類間具有高度一致性,而軟體動物與甲殼綱動物之間的原肌球蛋白的氨基酸序列只有60%左右的一致性。由此可見,對于水產品中甲殼類動物和軟體動物,其主要過敏原均為原肌球蛋白,但在氨基酸序列方面存在差異。
國內有關蝦原肌球蛋白的研究,在1964年,龔祖塤等[14]對蝦的原肌球蛋白進行提取并進行結構觀察。針對其過敏性的研究起步較晚,李振興[15]對凡納濱對蝦(Pneaeus vannamei)的過敏原蛋白進行分離純化,并鑒定為原肌球蛋白,分子質量為36kD。王曉斐[16]對中國對蝦的主要過敏原進行分離鑒定,將其命名為Pen c 1,該過敏原含有1個糖鏈,分子質量為36kD,其二級結構為а-螺旋。杜欣軍等[17]對凡納濱對蝦原肌球蛋白基因表達模式與重組表達進行研究,確定其原肌球蛋白分子質量為38.2kD。詹政科等[18]進行了口蝦蛄原肌球蛋白基因表達及變應原性鑒定的研究,證明其原肌球蛋白分子質量為36kD,且具有良好的IgE結合活性。黃建芳[19]進行了河蝦主要過敏原單克隆抗體的制備及河蝦過敏原不同組分共同表位分析,結果顯示,河蝦中至少存在9種過敏原組分,21、36、80kD等3種蛋白組分為河蝦的主要過敏原組分,其中以36kD過敏原組分致敏率和致敏性最強。河蝦21、36kD的過敏原組分之間具有共同過敏原表位,河蝦、海蝦和蟹的過敏原之間具有交叉反應,河蝦36kD的原肌球蛋白與海蝦的原肌球蛋白及蟹的26、36、70kD的蛋白組分具有共同表位。吳海明等[20]對凡納濱對蝦、中國明對蝦、刀額新對蝦以及蝦蛄4種海蝦的過敏原進行鑒別,發現凡納濱對蝦的主要過敏原為99、33、19、14kD的蛋白質;中國明對蝦的主要過敏原為39、33、28kD的蛋白質;刀額新對蝦的主要過敏原為33、24kD的蛋白質;蝦蛄的主要過敏原為56、48kD的蛋白。因此,分子質量為33kD的蛋白組分是前三者所共有的過敏原,而蝦蛄的則無共同分子質量的過敏原。鄭禮娜[21]對刀額新對蝦的過敏原指紋圖譜進行分析,確定其過敏原為分子質量36kD的原肌球蛋白,利用生物信息學方法對蝦過敏原及其他甲殼類過敏原之間的同源性進行分析,發現甲殼類過敏原-原肌球蛋白氨基酸序列之間同源性很高。易海濤等[22]對克氏原螯蝦主要變應原原肌球蛋白的一個片段區基因的克隆表達、純化及免疫原性鑒定。周向紅等[23]進行了中國明對蝦主要過敏原基因分子克隆與序列分析,證明其原肌球蛋白的分子質量為32.8kD,由284個氨基酸殘基組成。
上述研究表明,原肌球蛋白是甲殼綱動物的主要過敏原,但不同亞類間原肌球蛋白的氨基酸序列存在一定差異。因此,在過敏原的研究過程中,要注意不同蝦類的亞種之間的差異。
2 表位預測與定位及過敏反應原性檢測
2.1 表位預測與定位
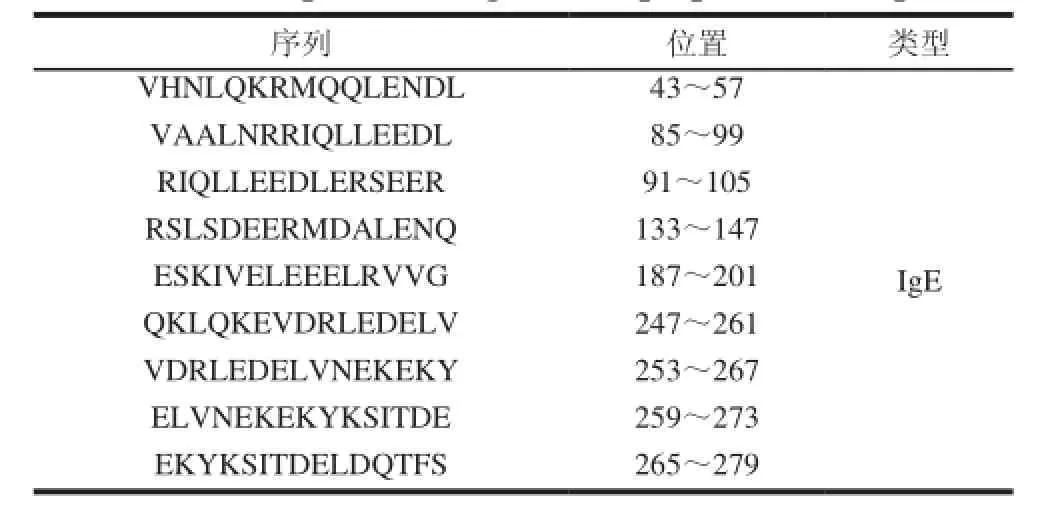
表 1 蝦過敏原的線性表位肽段Table 1 Peptides of allergen linear epitopes from shrimps
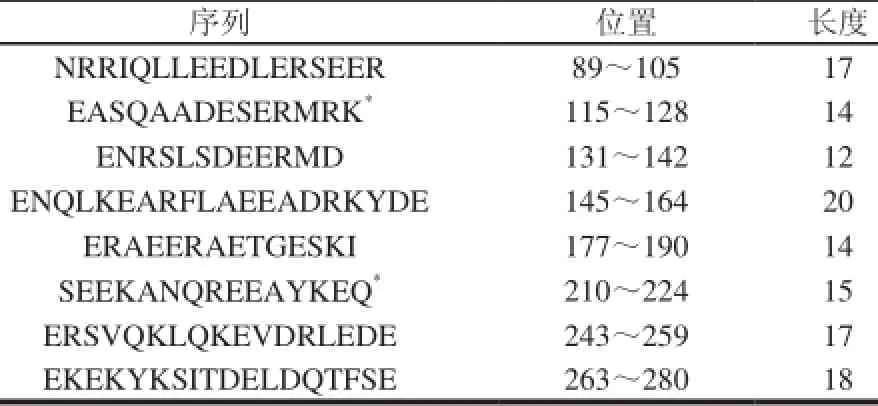
表 2 刀額新對蝦線性表位[21]Table 2 Allergen linear epitopes from Metapenaeus ensis[21]
表位預測與定位方法主要有酶解、肽掃描、噬菌體展示、質譜、表面等離子共振、蛋白芯片和核磁共振技術等[24]。酶解和肽譜掃描技術相對傳統,有特異性差、費時和昂貴等缺點;而噬菌體展示、質譜、表面等離子共振、蛋白芯片、核磁共振技術相比于傳統的技術在靈敏度、樣品用量、分析速度等方面都有一定的優勢。目前,研究確定的蝦過敏原表位共有9個肽段,見表1[16]。另外,鄭禮娜[21]采用DNAstar、AntheProt等生物信息學軟件分析刀額新對蝦的Pen a 1的二級結構、親水性、溶劑可及性、可塑性、抗原指數等多個性質,間接預測線性表位區域,并結合2個在線網站對表位的預測結果進行篩選,發現8個表位,其中有2個新的表位(表2)。并指出Pen a 1 空間結構比較簡單,沒有復雜的三、四級結構,二級結構主要以α-螺旋為主。
2.2 過敏反應原性檢測
在過敏反應原性檢測方法的研究方面,李振興[15]以鼠源抗體為捕獲抗體,膠體金標記的兔源抗體為檢測抗體,制備了蝦過敏原蛋白檢測的免疫滲濾試劑盒,檢測限達到250ng/mL,檢測時間在15min之內。劉光明等[25]進行了蝦類過敏原的識別純化和檢測技術研究,建立了蝦原肌球蛋白的酶聯免疫吸附測定方法。張軼群[26]采用蛋白質芯片技術建立了過敏原檢測的技術體系,其芯片檢測南美白對蝦過敏原檢測限為20ng/mL,線性檢測范圍為0.02~20.0μg/mL;雜色蛤過敏原檢測限為40ng/mL,線性檢測范圍為0.04~40.0μg/mL。鲅魚過敏原檢測限為20ng/mL,線性檢測范圍為0.02~20.0μg/mL。王麗娟等[27]以豚鼠為實驗動物,建立了蝦過敏實驗的動物模型,為過敏原消減效果的體內檢測提供依據。
3 蝦類過敏原的消減方法
目前,國內外普遍采用的方法包括物理法(加熱、輻照、微波、超高壓)、化學法和生物法(酶解法、基因改良法)等。
3.1 加熱、輻照、微波技術在過敏原消減中的應用
由于蝦的原肌球蛋白對熱穩定,因此,較少采用熱加工消減其過敏反應原性,但加熱對其他來源的過敏原反應原性的影響均有報道。Yu Huilin等[28]以青蟹(Scylla paramamosain)為原料,采用煮沸加熱、超聲波與煮沸加熱、高壓蒸汽加熱等方法處理,研究對其主要過敏原蛋白(原肌球蛋白)的可消化性的影響,研究發現,3種方法中的高壓蒸汽加熱能夠較好地促進過敏原的消化。Husband等[29]研究了熱和高壓對蘋果的2個主要過敏原(Mal d1、Mal d 3)及Bet v 1(類似芹菜中過敏原Api g 1)的影響,發現芹菜中過敏原Api g 1的免疫反應活性可通過加熱或提高壓力而被減小。Tong Ping等[30]研究了加熱誘導卵轉鐵蛋白潛在變態反應原性和結構的變化,結果顯示熱處理卵轉鐵蛋白引起的構象變化,顯著影響了其變態反應原性。
輻照對蝦過敏原消減的研究方面,李振興[15,31]、顧可飛[32]等的研究結果表明,輻照可以導致蝦過敏原蛋白免疫活性的變化,當輻照劑量低于10kGy時,處理的蝦抽提物和蝦肉的免疫活性有稍微增加;當輻照劑量大于10kGy時,蝦過敏原蛋白的免疫活性下降。但輻照會引起劑量殘留,從而對消費者產生不良影響。微波-超聲波對蝦過敏原的影響,根據董曉穎等[33]和李振興[15]結果表明,微波-超聲波處理雖然不會改變蝦過敏原的分子質量,但其致敏性有所降低。
3.2 化學法及酶法在過敏原消減中的應用
化學法對過敏原消減的研究中,可采用強酸(鹽酸)水解過敏原蛋白,使之完全降解為氨基酸。另外,也可采用美拉德反應,使糖和蛋白質反應生成糖和蛋白質的復合物,通過化學修飾改變蛋白質的變應原性,有學者[34-35]將該方法用于大豆過敏原的消減實驗,李慶麗等[36]采用麥芽糖、葡萄糖等與蝦過敏原進行美拉德反應,研究美拉德反應對蝦過敏原免疫活性的影響。結果表明,不同的還原糖對蝦過敏原免疫活性的影響不同,葡萄糖使蝦過敏原免疫活性降低約10%,麥芽糖能夠使蝦過敏原的免疫活性降低60%。因此,在合適的條件下,美拉德反應能夠有效降低蝦過敏原的免疫活性。
在蝦類過敏原消減研究中使用最多的方法是蛋白酶水解法。黃園園[37]采用模擬胃腸消化液的方法處理甲殼類原肌球蛋白和魚類小清蛋白,結果顯示,原肌球蛋白能被不同程度地分解,并產生一些降解條帶,而小清蛋白則幾乎不被分解。劉光明等[38]采用模擬胃腸液體外消化方法消減蟹類原肌球蛋白,較好地降低了其致敏性。吳海明等[39-40]采用胰蛋白酶、菠蘿蛋白酶和木瓜蛋白酶分別水解蝦蛋白和蝦肉,發現3種酶對蝦蛋白的致敏性均有較好的消減作用,木瓜蛋白酶的消減效果最好。
3.3 高靜壓技術在過敏原消減中的應用
靜壓力是指在一個壓力條件下維持一定時間。高靜壓是指以水壓作為壓力傳遞介質,壓力范圍0.1~10GPa,且受壓空間的各個方向的壓力相同。該技術在食品加工應用中,一般壓力范圍在100~1000MPa。研究表明,高靜壓只對弱鍵(氫鍵、離子鍵、疏水鍵等)產生影響,對共價鍵不會產生影響[41]。而這些弱鍵在維持蛋白質構象穩定性方面起著主要作用,因此,高靜壓對蛋白質的構象穩定具有很大影響。高壓條件下蛋白質的穩定性主要依賴于其構象穩定去代償弱鍵相互作用的損失,除此之外,也依賴水分子可滲透的縫隙體積。高壓條件下蛋白質結構的轉變常常受到蛋白質水合變化的影響,該水合變化伴隨著蛋白質的構象轉變。這種水合度的變化可以由兩個主要作用解釋:1)打開縫隙允許溶液占據內部空間,該空間原先沒有與這種溶劑發生作用:2)對于伸展蛋白與原蛋白相比,其與溶劑的接觸面積增大了[42-43]。眾所周知,食物過敏原的二、三級結構對其過敏潛能十分重要。因此,高壓處理可以影響其結構,具有減弱或增強食物的變應原性。目前,有些研究者已經開始研究高壓處理對一些食品過敏原的影響。根據Kato等[44]研究,大米(Oryza sativa L. Japonica cv. Akitakomachi)浸泡在蒸餾水中,在100~400MPa壓力作用下,其變應原蛋白會釋放出來,高壓釋放的蛋白主要是球蛋白Glb33、a-Glb和白蛋白Alb16。Husband等[29]研究了熱和高壓對蘋果的2個主要過敏原(Mal d 1、 Mal d 3)及Bet v 1類似芹菜中過敏原Api g 1的影響。結果顯示,盡管Mal d 1對115℃加熱10min和高壓高溫(115℃、10min、700MPa)加工時有一定的抗性,但其結構依然被化學修飾。來源于芹菜的Bet v 1,類似于Api g 1對熱和壓力都很敏感。通過研究得出結論,高壓高溫加工是一種有效地減少蘋果和芹菜過敏原的變應原性的方法。Pe?as等[45]研究了高靜壓對大豆制品的免疫反應性和營養質量的影響,高壓處理(300MPa、15min、40℃)可顯著降低大豆的抗原性。
但也有經過高壓處理后,雖然結構發生改變,而變態反應原性沒有發生變化的情況。例如,Setinova等[46]采用高壓(450~550MPa)處理重組樺樹花粉過敏原(rBet v1)和樺樹花粉提取物。在450MPa條件下30℃處理,rBet v1結構發生最大變化。采用免疫印跡法檢測rBet v1和樺樹花粉提取物的變態反應。450~550MPa條件下,溫度分別30、40、50℃,處理10min,與未處理的樣品比較,沒有改變rBet v1蛋白和花粉提取物的變態反應原性。
針對原肌球蛋白,謝丹丹等[47-48]提取南美白對蝦水溶性蛋白,然后采用超高壓法、超高壓結合酶法進行處理,發現采用超高壓法處理(150MPa、45℃、35min)的產物,過敏原性降低了66.2%;超高壓下直接用木瓜蛋白酶處理(300MPa、45℃、35min)的產物,過敏原性降低了91.5%。隨后又以蝦肉為原料,研究蝦肉組分存在對過敏原消減效果的影響,發現采用超高壓法處理(200MPa、40℃、35min)處理的產物過敏原性降低了66.1%;超高壓條件下直接用木瓜蛋白酶處理(300MPa、40℃、35min)的產物過敏原性降低了91.2%。上述研究結果表明,采用超高壓、超高壓結合酶法處理,均能降低蝦的過敏原性,且后者消減效果更好;另外,當蝦肉其他組分存在時,其過敏原性消減條件發生改變,但通過改變作用條件,會達到同樣的消減效果。
高靜壓對原肌球蛋白結構影響的研究方面,烏云娜[49]采用0.1~400MPa的壓力處理牛骨骼肌的原肌球蛋白,解壓后測定原肌球蛋白的芳香族表面疏水基團、脂肪族表面疏水基團、280nm和295nm激發波長處的熒光強度、光譜質量中心、光散射性、巰基基團含量等的變化,發現壓力可引起原肌球蛋白結構的變化,而這些變化可能有一定程度的可逆性。
另外,經過高壓處理可增加過敏原的可消化性,從而降低過敏反應。例如,在高壓條件下進行酶水解蛋白時,乳清中β-乳球蛋白對胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、鏈酶蛋白酶和嗜熱菌蛋白酶等更加敏感。其水解物減小了對IgG和人的IgE結合的變態反應原性[50-51]。但該報道沒有進行高壓對酶活力影響進行對照實驗,因此,不能說明上述結果到底是由于高壓對β-乳球蛋白的可消化性產生影響,還是高壓對相關的酶活產生了影響。因為酶的活性,如特異性蛋白酶,可被壓力調節。某些酶的活性隨著壓力的增加會喪失活性。如在壓力為100~400MPa,馬肝醇脫氫酶(HLADH)的催化活性急劇降低[52]。相反,如果催化反應誘導的體積是減小的,那么,高壓能夠增強相關的酶的活性。如α-糜蛋白酶,在470MPa條件下,其酶活是常壓下的6倍[53]。同樣,嗜熱菌蛋白酶在200MPa條件下的酶活是環境壓力下的45倍[54]。因此,在高壓條件下進行酶解消減過敏原,有必要進行高壓對酶活性影響的對照實驗,進而確定降低致敏性的真正原因,但目前還沒有報道。
4 結 語
對于消費者而言,不僅要享受蝦的美味,更要享受吃蝦時的感覺,因此,在不破壞整體蝦仁結構的同時,消減過敏原,制備低致敏性或無致敏性的蝦仁就顯得尤為重要。綜合目前國內外的研究報道,較少研究加工對其分子結構和過敏反應原性的影響,而對整體蝦仁的過敏原消減方法及機理研究基本沒有報道。雖然日本已經采用高壓法生產低致敏性的米飯,但對不同過敏原,食物基質對其鈍化作用和機理有著明顯的差異,因此很難得出同樣的結論。在以往的研究中,無論是物理法、化學法還是生物法,如果單獨使用,由于蝦仁其他成分和組織結構的影響,很難較好地消減蝦仁內部的過敏原。本課題組采用高靜壓結合蛋白酶水解方法,處理整體蝦仁,較好地消減了蝦仁內部的過敏原,建立了高壓結合酶法制備低致敏性蝦仁的相關技術參數。但對于蝦仁內部過敏原消減過程中,高壓對蝦仁過敏原蛋白溶出、結構變化與過敏反應原性關系;蝦仁中其他成分對過敏原蛋白消減的影響;高壓能否有效地使蛋白酶壓入蝦仁組織內部并作用于過敏原蛋白,以及高壓對酶活性影響等問題還有待深入探討研究。
參考文獻:
[1] SHANTI K N, MARTIN B M, NAGPAL S, et al. Identification of tropomyosin as the major shrimp allergen and characterization of its IgE binding epitopes[J]. J Immunol, 1993, 151(10): 5354-5363.
[2] DAUL C B, SLATTERY M, REESE G, et al. Identification of the major brown shrimp (Penaeus aztecus) as the muscle protein tropomyosin[J]. Int Arch Allergy Clin Immunol, 1994, 105(1): 49-55.
[3] LEUNG P S C, CHU K H, CHOW W K, et al. Cloning, expression, and primary structure of Metapenaeus ensis tropomyosin, the major heatstable shrimp allergen[J]. J Allergy Clin Immunol, 1994, 94(5): 882-890.
[4] LEUNG P S, CHEN Y C, MYKLES D L, et al. Molecular identif i cation of the lobster muscle protein tropomyosin as a seafood allergen[J]. Mol Mar Biol Biotechnol, 1998, 7(1): 12-20.
[5] LEUNG P S, CHEN Y, GERSHWIN M R, et al. Identif i cation and molecular characterization of Charybdis feriatus tropomyosin, the major crab allergen[J]. J Allergy Clin Immunol, 1998, 102(5): 847-852.
[6] MYKLES D L, COTTON J L, TANIGUCHI H, et al. Cloning of tropomyosins from lobster (Homarus americanus) striated muscles, fast and slow isoforms may be generated from the same transcript[J]. J Muscle Res Cell Motil, 1998, 19(2): 105-115.
[7] REESE G, SCHICKTANZ S, LAUER I, et al. Structural, immunological and function al properties of natural recombinant Pen a 1, the major allergen of brown shrimp Penaeu saztecus[J]. Clin Exp Allergy, 2006, 36(4): 517-524.
[8] NAKANO S, YOSHINUMA T, YAMADA T. Reactivity of shrimp allergy related IgE antibodies to krill tropomyosin[J]. Int Arch Allergy Immunol, 2008, 145(3): 175-181.
[9] MOTOYAMA K, SUMA Y, ISHIZAKI S, et al. Molecular cloning of tropomyosins identif i ed as allergens in six species of crustaceans[J]. J Agric Food Chem, 2007, 55(3): 985-991.
[10] MOTOYAMA K, SUMA Y, ISHIZAKI S, et al. Identification of tropomyosins as major allergens in ant arctic krill and mantis shrimp and their amino acid sequence characteristics[J]. Mar Biotechnol, 2008, 10(6): 709-718.
[11] AYUSO R, GALINA G, LUDMILLA B, et al. Myosin light chain is a novel shrimp allergen, Lit v 3[J]. J Allergy Clin Immunol, 2008, 122(4): 195-802.
[12] SUMA Y, ISHIZAKI S, NAGASHIMA Y, et al. Comparative analysis of barnacle tropomyosin: divergence from decapod tropomyosins and role as a potential allergen[J]. Comparative Biochemistry and Physiology, 2007, 147(2): 230-236.
[13] EMOTO A, ISHIZAKI S, SHIOMI K. Tropomyosins in gastropods and bivalves: identification as major allergens and amino acid sequence features[J]. Food Chemistry, 2009, 114(2): 634-641.
[14] 龔祖塤, 曹天欽. 對蝦原肌球蛋白晶體和纖維的電子顯微鏡觀察[J].生物化學與生物物理學報, 1964, 4(4): 427-436.
[15] 李振興. 蝦(Penaeus vannamei)過敏原免疫活性的研究[D]. 青島: 中國海洋大學, 2006.
[16] 王曉斐. 中國對蝦(Penaeus chinensis)主要過敏原的鑒定及性質研究[D]. 青島: 中國海洋大學, 2008.
[17] 杜欣軍, 張偉偉, 孫偉英, 等. 凡納濱對蝦原肌球蛋白基因表達模式與重組表達[J]. 漁業科學進展, 2009, 30(4): 38-43.
[18] 詹政科, 劉志剛, 吉坤美. 口蝦蛄原肌球蛋白基因表達及變應原性鑒定[J]. 中國公共衛生, 2009, 25(4): 413-415.
[19] 黃建芳. 河蝦主要過敏原單克隆抗體的制備及河蝦過敏原不同組分共同表位分析[D]. 廣州: 暨南大學, 2010.
[20] 吳海明, 胡志和, 王超. 免疫印跡法對4種海蝦主要過敏原的鑒定[J].食品科學, 2010, 31(16): 274-277.
[21] 鄭禮娜. 蝦類過敏原的活性分析及其抗原表位的研究[D]. 青島: 中國海洋大學, 2011.
[22] 易海濤, 夏立新, 劉芳, 等. 克氏原螯蝦主要變應原原肌球蛋白的一個片段區基因的克隆表達、純化及免疫原性鑒定[J]. 江西師范大學學報: 自然科學版, 2011, 35(3): 280-285.
[23] 周向紅, 閻斌倫, 李士虎. 中國明對蝦主要過敏原基因分子克隆與序列分析[J]. 水產科學, 2011, 30(2): 102-106.
[24] 武涌, 李欣, 陳紅兵, 等. 食物過敏原表位定位技術的研究進展[J].食品科學, 2010, 31(23): 406-410.
[25] 劉光明, 沈苑, 曹敏杰, 等. 蝦類過敏原的識別、純化和檢測技術研究[J]. 中國食品學報, 2008, 8(6): 142-148.
[26] 張軼群. 海產品過敏原免疫芯片檢測方法的研究[D]. 青島: 中國海洋大學, 2009.
[27] 王麗娟, 胡志和, 陳照麗, 等. 蝦蛋白過敏實驗動物模型的建立[J].食品科學, 2010, 31(19): 347-350.
[28] YU Huilin, CAO Minjie, CAI Qiufeng, et al. Effects of different processing methods on digestibility of Scylla paramamosain allergen (tropomyosin)[J]. Food and Chemical Toxicology, 2011(49): 791-798.
[29] HUSBAND F A, ALDICK T, van der PLANCKEN I, et al. High pressure treatment reduces the allergenicity of the major allergens in apple and celeriac[J]. Molecular and Nutrition and Food Research, 2011, 55(7): 1087-1095.
[30] TONG Ping, GAO Jinyan, CHEN Hongbing, et al. Effect of heat treatment on the potential allergenicity and conformational structure of egg allergen ovotransferrin[J]. Food Chemistry, 2012, 131(2): 603-610.
[31] LI Zhenxing, LIN Hong, CAO Limin, et al. The inf l uence of gamma irradiation on the allergenicity of shrimp (Penaeus vannamei)[J]. Journal of Food Engineering, 2007, 79(3): 945-949.
[32] 顧可飛, 高美須, 李春紅, 等. 輻照對蝦過敏原抗原性的影響[J]. 中國食品衛生雜志, 2007, 19(2): 102-105.
[33] 董曉穎, 高美須, 潘家榮, 等. 不同處理方法對蝦過敏蛋白分子量及抗原性的影響[J]. 核農學報, 2010, 24(3): 548-554.
[34] BABIKER E E, HIROYUKI A, MATSUOOMI N, et al. Effect of polysaccharide conjugation or transglutaminase treatment on the allergenicity and functional properties of soy protein[J]. J Agric Food Chem, 1998, 46(3): 866-871.
[35] DOKE S, NAKAMURA R, TORII S. Allergenicity of food proteins interacting with oxidized lipids in soybean-sensitive individuals[J]. J Agric Biol Chem, 1989, 53(5): 1231-1235.
[36] 李慶麗, 李振興, 林洪, 等. 美拉德反應中麥芽糖、葡萄糖對蝦過敏原活性影響的研究[J]. 食品工業科技, 2009, 30(1): 79-81.
[37] 黃園園. 水產過敏原的模擬胃腸液消化[D]. 廈門: 集美大學, 2009.
[38] 劉光明, 余惠琳, 黃秀秀, 等. 加工處理方式對蟹類原肌球蛋白的消化穩定性和過敏原性的影響[J]. 中國食品學報, 2011, 31(11): 14-22. [39] 吳海明, 胡志和, 王麗娟. 凡納濱對蝦主要過敏原鑒定及酶法消減技術的研究[J]. 食品科學, 2010, 31(17): 272-276.
[40] 吳海明, 胡志和. 凡納濱對蝦過敏原酶法消減技術的研究[J]. 食品科學, 2010, 31(19): 38-41.
[41] NOLWENNIG R, JEAN R, GéRARD D. Development of high hydrostatic pressure in biosciences: pressure effect on biological structures and potential applications in biotechnologies[J]. Biotechnology Advances, 2010, 28(6): 659-672.
[42] HEREMANS K. Protein dynamics: hydration and cavities[J]. Braz J Med Biol Res, 2005, 38(8): 1157-1165.
[43] SILVA J L, FOGUEL D. Hydration, cavities and volume in protein folding, aggregation and amyloid assembly[J]. Phys Biol, 2009, 6(1): 15002.
[44] KATO T, KATAYAMA E, MATSUBARA S, et al. Release of allergenic proteins from rice grains induced by high hydrostatic pressure[J]. Journal of Agricultural and Food Chemistry, 2000, 48(8): 3124-3129.
[45] PE?AS E, GOMEZ R, FRIASA J, et al. High hydrostatic pressure effects on immunoreactivity and nutritional quality of soybean products[J]. Food Chemistry, 2011, 125(2): 423-429.
[46] SETINOVA I, KMINKOVA M, STROHALM J, et al. Allergenicity of main birch allergen rBet v1 and high-pressure treatment[J]. High Pressure Research, 2009, 29(4): 680-685.
[47] 謝丹丹, 胡志和, 薛璐, 等. 超高壓結合酶法消減南美白對蝦蛋白過敏原研究[J]. 食品科學, 2012, 33(8): 109-114.
[48] 謝丹丹, 胡志和, 薛璐, 等. 超高壓結合酶法消減南美白對蝦蝦肉中的過敏原[J]. 食品科學, 2012, 33(3): 68-71.
[49] 烏云娜. 超高壓處理對牛骨骼肌原肌球蛋白結構的影響[D]. 呼和浩特: 內蒙古農業大學, 2011.
[50] CHICON R, BELLOQUE J, ALONSO E, et al. Immuno reactivity and digestibility of high-pressure-treated whey proteins[J]. Int Dairy J, 2008, 18: 367-376.
[51] CHICóN R, BELLOQUE J, ALONSO E, et al. Antibody binding and functional properties of whey protein hydrolysates obtained under high pressure[J]. Food Hydrocolloid, 2009, 23(3): 593-599.
[52] TROVASLET M, DALLET-CHOISY S, MEERSMAN F, et al. Fluorescence and FTIR study of pressure-induced structural modif i cations of horse liver alcohol dehydrogenase (HLADH)[J]. Eur J Biochem, 2003, 270(1): 119-128.
[53] AERTSEN A, MEERSMAN F, HENDRICKX M E G, et al. Biotechnology under high pressure: applications and implications[J]. Trends Biotechnol, 2009, 27(7): 434-441.
[54] KUNUGI S, KITAYAKI M, YANAGI Y, et al. The effect of high pressure on thermolysin[J]. Eur J Biochem, 1997, 248(2): 567-574.
Research Progress of Shrimp Allergens and Allergenicity Removal
HU Zhi-he
(Tianjin Key Laboratory of Food Biotechnology, School of Biotechnology and Food Science, Tianjin University of Commerce, Tianjin 300134, China)
Shrimp and its products have good delicious and are rich in nutrients, but they are allergenic foods for some people. In this paper, the research progress in the structure of major shrimp allergen protein (tropomyosin), epitope prediction and positioning, allergenicity testing and desensitization is reviewed. These investigations will provide some references for further studies on shrimp allergens and reduction of their allergencity.
shrimp;allergen;tropomyosin;allergenicity
TS254.1
A
1002-6630(2013)01-0319-05
2012-09-29
國家自然科學基金項目(31271841)
胡志和(1962ü),男,教授,碩士,研究方向為專用功能食品。E-mail:hzhihe@tjcu.edu.cn

