固定化酶化學發光法測定食品中的淀粉含量
舒友琴 徐 軍
(河南牧業經濟學院質量檢測與管理系,鄭州 450011)
食品中淀粉測定的國標方法為酶水解法和酸水解法[1]。酶水解法即在淀粉酶的作用下,使淀粉水解為麥芽糖和低分子糊精,再進一步酸水解,使淀粉全部轉化為葡萄糖,然后按測定還原糖的方法測定生成的葡萄糖,再折算成淀粉的含量。方法繁瑣費時,而且淀粉酶不能重復使用,造成酶試劑的浪費。
酶固定化技術是20世紀60年代發展起來的一項新技術,可提高酶的催化效率、降低使用成本,呈現貯存穩定性高、分離回收容易、可多次重復使用等一系列優點[2-3]。固定化酶所使用的載體有高分子載體、無機載體、復合載體以及新型載體等[4-7]。分子篩作為酶的新型載體材料,已廣泛應用于各種酶的固定化[8-9]。MCM-41介孔分子篩是一種孔徑介于2.0~50 nm之間的分子篩,由于其具有規整的介孔孔道、獨特的液晶自組織合成機理、組分的多樣可變性及極高的比表面積,以及良好的熱穩定性,故在固定化酶方面有著特有的優勢,但目前的研究多集中于固定化條件及固定化酶的性能研究[10-11],而鮮見用于分析測定的報道。
本研究以MCM-41介孔分子篩作為載體固定了α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶,制備了固定化的酶柱,并結合流動注射化學發光體系,建立了快速測定食品中淀粉含量的新方法,并對8種不同的樣品進行了測定,結果令人滿意。
1 材料與方法
1.1 材料與試劑
供試樣品:市售,包括2個含脂肪較多的樣品即火腿腸和餅干;5個含脂肪較少的樣品即饅頭、雞蛋掛面、小麥粉、玉米面和豆漿;1個淀粉類樣品即涼皮。
α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶(生物試劑):北京奧博星生物技術有限責任公司;可溶性淀粉標準品(分析純):北京紅星化工廠;魯米諾(Luminol,3-氨基鄰苯二甲酰肼,又名發光氨)(分析純)、十六烷基三甲基溴化銨(CTAB)(分析純):北京化學試劑廠;正硅酸乙酯(TEOS)(分析純):天津市科密歐化學試劑開發中心;K3[Fe(CN)6]及其他有關試劑均為分析純。
1.2 主要儀器設備
IFIS-C型智能流動注射進樣器、GD-1型微光測量儀:西安瑞科電子設備有限公司;R-60型Rikadenki記錄儀:日本株式會社東海理化電機制作所;HJ-5數顯恒溫多功能攪拌器:金壇市榮華儀器制造有限公司;HZS-H型水浴振蕩器:哈爾濱市東明醫療儀器廠;DZF-6051真空恒溫干燥箱:深圳市鼎鑫宜實驗設備有限公司;TU-1810紫外可見分光光度計:北京普析通用儀器有限責任公司。
1.3 酶柱反應及發光測定原理
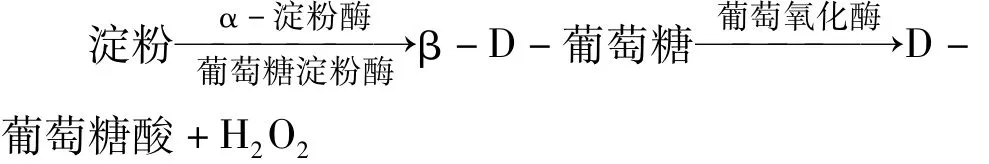
反應生成的 H2O2與 Luminol在 K3[Fe(CN)6]的催化下產生化學發光,發光強度與生成的H2O2的量成正比,即與樣液中淀粉的含量成正比,從而求出樣品中的淀粉含量。發光分析的流路系統如圖1所示。

圖1 流動注射化學發光分析流路圖
1.4 固定化酶柱的制備
1.4.1 MCM-41介孔分子篩的制備
MCM-41的合成參照劉雷等[12]和張波等[13]的文獻進行。取蒸餾水150 mL,依次加CTAB 4.4 g,NaOH 0.8 g,攪拌15 min后逐滴加入TEOS15.5 mL,繼續攪拌2 h。110℃ 晶化24 h,冷卻、過濾、洗滌。50℃干燥過夜后,于馬弗爐中540℃灼燒6 h,所得粉末即為MCM-41介孔分子篩材料。
1.4.2 酶的固定化
稱取α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶各0.20 g,分別溶于的100 mL pH 5.5的磷酸氫二鈉-檸檬酸緩沖溶液中,充分攪拌后靜置2 h以上,所得上清液即為各酶的酶液。
稱取0.2 g MCM-41介孔分子篩載體3份,分別放入3只帶塞的離心管中,各加入上述3種酶的酶液3.0 mL,置于轉速150 r/min、20℃ 的恒溫振蕩器中10 h,離心分離,用緩沖溶液洗滌固體,再離心分離、洗滌,如此反復直至上清液中檢測不到酶活為止。所得固體即為固定化酶,室溫真空干燥后,于4℃下冰箱保存。
1.4.3 酶柱的制備
取一定量的α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶的固定化酶固體,分別壓碎混勻后,依次裝入8 mm×120 mm的塑料管內(每種約占1/3),兩端用玻璃棉封住。即制成固定化的酶柱,不用時保存于4℃的冰箱中。固定化時間、給酶量、溶液pH都會對酶的固定化率產生影響[14]。通過多次試驗,本研究采用的固定化條件為固定化時間10 h、每種酶給酶量30 mg/g、溶液pH 5.5。試驗測得3種酶的固定化率分別為66%、68%和72%。
1.5 固定化酶的活性
固定化后的α-淀粉酶和葡萄糖淀粉酶的活性采用消色法測定[15],葡萄糖氧化酶的活性采用4-氨基安替吡啉、苯酚和辣根過氧化物酶(HRP)體系測定[16]。
本試驗的α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶的酶活單位分別指在40℃、pH 6條件下,每小時水解1 g淀粉所需的固定化酶量、每小時水解可溶性淀粉產生1 mg葡萄糖所需的固定化酶量和每分鐘產生1μmol葡萄糖酸和H2O2所需的固定化酶量。
淀粉的固定化酶化學發光法測定的基礎是3種酶的催化反應,溫度、酸度對酶的催化活性均有影響,多次測定的結果表明,在50~60℃、pH 4.5~5.5的條件下,體系有最大的發光強度。
1.6 樣品的預處理
1.6.1 含脂肪較多的樣品
稱取試樣1~5 g(視樣品含淀粉量而定,通過調節稱樣量和定容體積,把樣液濃度調節在10~150 mg/L的線性測定范圍內),置于鋪有濾紙的漏斗內,先用50 mL乙醚分5次洗滌以除去脂肪,再用100 mL85%乙醇分5次洗滌以除去可溶性糖類。用50 mL水將殘渣移至250 mL燒杯中。將燒杯置沸水浴中加熱15 min,以使淀粉糊化溶解,冷卻后移入1 000 mL容量瓶中,調節溶液的pH 5.0,定容。用快速濾紙過濾,得濾液備用。
1.6.2 含脂肪較少的樣品
可省去除脂肪的操作,其余步驟同1.6.1。
1.6.3 淀粉類樣品
稱樣后可直接糊化,其余步驟同1.6.1。
1.7 化學發光試驗方法
按圖1所示,將各流通管分別插入相應的試劑溶液中,打開蠕動泵,待信號穩定后,記錄發光強度。以體系的發光強度和空白發光強度之差定量。本測定采用的 Luminol濃度為1×10-3mol/L,K3[Fe(CN)6]濃度為2.5×10-2mol/L,二者流速均為10 r/min。
2 結果和討論
2.1 影響酶柱工作性能的因素
2.1.1 柱溫的影響
在Luminol溶液的pH 9.0,淀粉溶液的pH 5.0、流速為2 r/min的條件下,按化學發光試驗方法分別測定酶柱在 20、30、40、50、60、和 70℃時,由 100 mg/L淀粉標液所產生的發光強度,結果如圖2。

圖2 柱溫對發光強度的影響
由圖2可見,當酶柱溫度保持在50~60℃時,體系有最大的發光強度。選用的酶柱使用溫度為55℃。
2.1.2 淀粉溶液酸度的影響
在Luminol溶液的pH 9.0,淀粉溶液的流速為2 r/min,酶柱溫度保持在55℃的條件下,按化學發光試驗方法分別測定由100 mg/L淀粉標液在pH為4.0、4.5、5.0、5.5、6.0、6.5和 7.0時所產生的發光強度,結果如圖3。
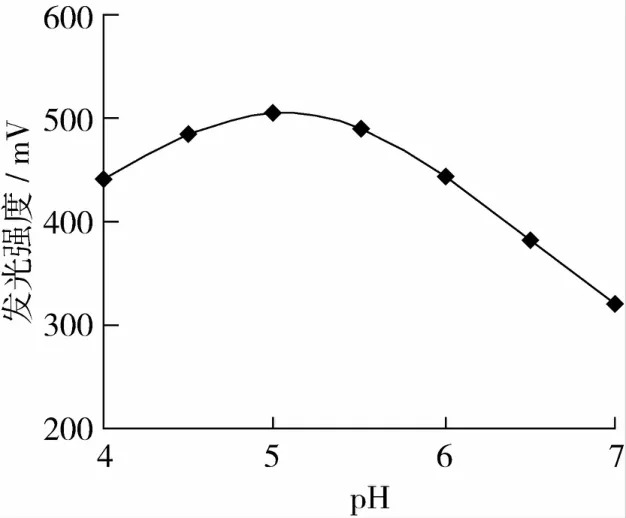
圖3 pH對發光強度的影響
由圖3可見,淀粉溶液的酸度在pH 4.5~5.5時,體系的發光強度最大。選用淀粉溶液的酸度為pH=5.0。所以,在處理樣品和配制標液時,應調節淀粉溶液的酸度在pH=5.0。
2.1.3 淀粉溶液流速的影響
在流動注射化學發光測定中,由于淀粉溶液是在流經酶柱時被酶催化發生反應,流速的快慢會對淀粉的轉化率產生一定的影響。在Luminol溶液的pH 9.0,淀粉溶液pH 5.0,酶柱溫度保持在55℃的條件下,按化學發光試驗方法分別測定由100 mg/L淀粉標液在流速 2、4、6、8、10 r/min時所產生的發光強度,結果如圖4。

圖4 流速對發光強度的影響
由圖4可見,體系的發光強度隨淀粉溶液流速的增大而降低。流速越低,體系的發光強度越大。而體系的發光強度越大,測定的靈敏度就越高。考慮到蠕動泵流速的均勻性及分析速度,選用淀粉溶液的流速為 2 r/min。
2.2 Luminol溶液酸度的選擇
在淀粉溶液pH 5.0、流速為2 r/min,酶柱溫度保持在55℃的條件下,按化學發光試驗方法分別測定100 mg/L淀粉標液在 Luminol溶液 pH 8.0、9.0、10.0、11.0、12.0時體系的發光強度,如圖 5所示。

圖5 Luminol溶液pH對發光強度的影響
圖5表明,在Luminol溶液的pH 9.0左右時,體系的發光強度最大。選定Luminol溶液的pH 9.0。
2.3 標準曲線、線性范圍和檢出限
在Luminol溶液 pH 9.0,淀粉溶液 pH 5.0、流速為2 r/min,酶柱溫度保持在55℃的條件下,按化學發光試驗方法分別測定由 1、10、30、60、100、150 mg/L淀粉標液所產生的發光強度,繪制標準曲線,如圖6。可見,淀粉溶液在1~150 mg/L的濃度范圍內,體系發光強度與濃度呈良好的線性關系,相關系數為0.999 8。對50 mg/L淀粉標液進行10次測定的RSD為2.1%,由對10 mg/L淀粉標液的測定結果,求得測定的檢測限為0.3 mg/L(信噪比 S/N=3)。

圖6 淀粉的標準工作曲線
2.4 加標回收率試驗
取5種樣品,經預處理后按最佳試驗條件進行加標回收試驗,結果見表1。
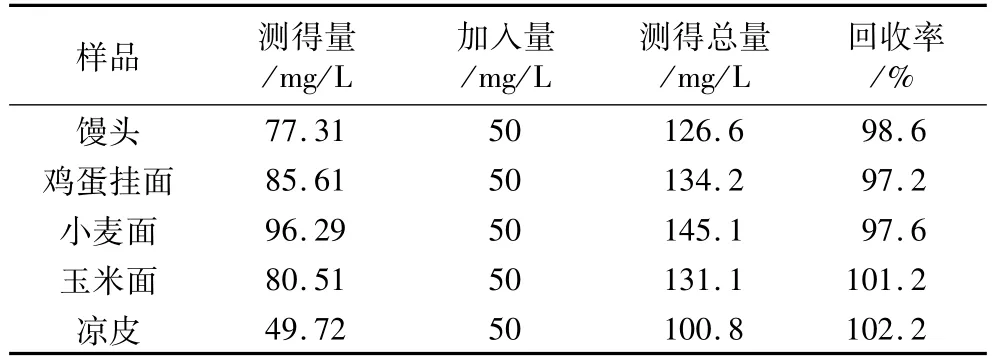
表1 加標回收率試驗結果(n=5)
2.5 樣品測定和對比試驗
為了進一步了解方法的準確度,試驗分別用本法和國標方法(酶水解法)對8個樣品進行了對比測定,結果見表2。將測定結果用t檢驗法進行統計分析,t<t0.05.7,說明兩方法的測定結果無顯著性差異。

表2 樣品測定和對比試驗結果
2.6 酶柱的使用壽命
酶柱的使用壽命取決于酶從固定柱中流出的速度,因為這種流出將導致分析信號的減弱。本試驗在室溫條件下,考察了酶柱活性隨時間的變化情況。結果顯示,1個月內至少使用了300次的酶柱所產生的發光強度與新酶柱所產生的發光強度沒有明顯的減弱,40天內至少使用了350次的酶柱所產生的發光強度仍保持新酶柱所產生的發光強度的77%。說明在室溫條件下,固定化酶柱有較好的使用穩定性。
3 結論
作為生物酶固定化載體,MCM-41介孔分子篩有獨特優勢。本試驗利用MCM-41介孔分子篩將α-淀粉酶、葡萄糖淀粉酶和葡萄糖氧化酶固定化,制成復合酶柱,將此酶柱用于流動注射化學發光分析體系,可用于淀粉含量的快速測定。酶柱的最佳使用條件為:柱溫55℃,淀粉溶液的pH 5.0、流速2 r/min。淀粉測定的線性范圍為1~150 mg/L,相關系數0.999 8,檢出限為0.3 mg/L,回收率為為97.2~102.2%,10次測定的RSD為2.1%。
方法具有多種優點:樣品前處理簡單,操作簡便,節省酶試劑,準確度高,重現性好,測定速度快,單次測定能在1 min內完成。對8個樣品的測定結果與國標方法的測定結果無顯著性差異。為淀粉含量的測定提供了一種良好的新方法。
參考文獻
[1]中華人民共和國衛生部.食品衛生檢驗方法 理化部分(一)[M].北京:中國標準出版社,2004
[2]袁中一.固定化酶[M].北京:化學工業出版社,1996
[3]曹玉華,楊慧萍,楊衛民,等.應用雙固定化酶制備大豆肽的研究[J].中國糧油學報,2003,18(5):40-43
[4]陳霞,劉瀟,趙光輝,等.智能型高分子載體的設計與制備及其固定化酶的研究進展.材料導報,2010,24(12):130-134
[5]張巍巍.生物碳纖維的酶固定化研究[D].北京:北京化工大學,2010
[6]Han Lei,Wang Wei.The prepration and catalytically active characterlzation 0f papain immobilized on magnetic comppsite micmspheres.Enzyme and Microbia1 Technology,2004,35(1):15-18
[7]周桓,張秋禹,金鳳.新型固定化酶載體的合成及其功能.化工進展,2009,28(3):462-467
[8]Song X J,Wang J.Study on immobilization of acylase I on Y-type molecular sieve[J].Journal of Chemical Engineering of Chinese Universities,2004,18(5):617-620
[9]劉平,邢國文,李宣文,等.四種蛋白水解酶在不同分子篩上的吸附固定.物理化學學報,2010,26(4):1113-1118
[10]張君,吳秀文,馬鴻文.不同孔徑MCM-41介孔分子篩的合成及吸附性能研究[J].材料導報,2006,5(20):216-218
[11]趙炳超.介孔分子篩固定化酶的研究[D].北京:北京化工大學,2005
[12]劉雷,張高勇,董晉湘.模板劑對全硅 MCM-41介孔分子篩結構的影響 [J].物理化學學報,2004,20(1):65-69
[13]張波,慎煉,周春暉,等.全硅MCM-41中孔分子篩的合成[J].高校化學工程學報,2001,15(1):29-34
[14]王亮亮,劉雪松,宋偉明,等.α-淀粉酶在 MCM-41介孔分子篩上的固定化研究[J].日用化學工業,2012,42(3):196-200
[15]袁道強,黃建華.生物化學實驗和技術[M].北京:中國輕工業出版社,2006
[16]熊振平,李載平,李致勛,等.酶工程[M].北京:化學工業出版社,1993.

