鹵蟲投喂下長吻?仔稚魚消化酶發育和口寬變化的研究
劉變枝朱曉鳴雷 武韓 冬楊云霞金俊琰解綬啟
(1. 中國科學院水生生物研究所, 淡水生態與生物技術國家重點實驗室, 武漢 430072; 2. 河南農業大學, 牧醫工程學院, 鄭州 450002)
鹵蟲投喂下長吻?仔稚魚消化酶發育和口寬變化的研究
劉變枝1,2朱曉鳴1雷 武1韓 冬1楊云霞1金俊琰1解綬啟1
(1. 中國科學院水生生物研究所, 淡水生態與生物技術國家重點實驗室, 武漢 430072; 2. 河南農業大學, 牧醫工程學院, 鄭州 450002)
采用酶學和形態學測定方法, 研究在投喂鹵蟲條件下長吻?仔魚4種主要消化酶: 胃蛋白酶、胰蛋白酶、脂肪酶和淀粉酶的活性變化以及長吻?仔魚口寬、全長變化。實驗共進行13d, 實驗結果表明: (1)長吻?仔魚全長、口寬的發育與其日齡表現出明顯的線性正相關(R2TL= 0.974, R2MW= 0.964)。口寬與全長比值(MW/TL)在仔魚開口后急劇下降, 并自7日齡開始維持在0.07—0.08, 口寬和全長處于同步發育期并表現出明顯的相關性(R2 = 0.948), 說明7日齡(/h, days post hatching)后口寬和全長處于同步發育期, 標志仔魚轉食的開始。(2)長吻?仔魚初次開口時即可檢測出四種消化酶的活性。5—7/h時胰蛋白酶顯著高于初孵仔魚, 與此時仔魚開始開口攝食的行為相一致。胃蛋白酶、脂肪酶活性在仔魚孵化后第7天即開口的第3天, 淀粉酶活性在孵化后第6天, 顯著高于初次孵化出來的仔魚。8—13/h時, 胃蛋白酶、胰蛋白酶、脂肪酶和淀粉酶活性均在較高水平平穩的波動, 標志著消化道發育逐漸健全。
長吻?; 消化酶; 仔魚; 口寬; 全長
長吻?(Leiocassis longirostris Günther)俗稱江團、肥坨、?魚, 主要分布于長江及遼河流域, 是長江干流的一種名貴肉食性經濟魚類。近年, 過度捕撈和環境條件的惡化導致長吻?野生資源急劇銳減,人工養殖逐漸開展并開始走向規模化, 對長吻?苗種的需求劇增。但是在長吻?苗種生產中, 依靠傳統經驗確定轉食時機和專屬轉食飼料的缺失造成長吻?仔魚期大量死亡, 成為其規模化養殖的主要瓶頸, 也是很多種魚類苗種培育中所遇到的問題[1]。因此, 長吻?苗種培育期轉食時機的選擇以及專屬轉食飼料的開發成為長吻?苗種培育中急需解決的問題。
仔魚只有在具有足夠的消化和吸收外源性餌料的能力后, 外源性餌料的引入才能夠使他們存活和生長。不合適的轉食時機和轉食飼料往往造成仔魚的大量死亡[2,3]。仔魚人工配合飼料的組成、引入的時間要以仔魚發育過程中的消化生理狀況以及消化系統的完善程度為基準[4—7]。因此, 了解仔稚魚何時具有攝食和消化外源性營養物質的能力是我們進行規模化苗種育種的首要前提。目前, 在長吻?苗種培育中, 長吻?幼魚體重、水溫、投喂水平對其生長的影響本實驗室已有所研究[8,9]。本實驗以剛出膜的長吻?仔稚魚為材料, 研究長吻?仔稚魚的消化酶活性變化趨勢以及口寬全長發育, 為提高長吻?仔稚魚期的生長、存活, 確定長吻?仔稚魚期合適的轉食時機, 研制合適的人工配合餌料提供理論依據。
1 材料與方法
1.1 實驗魚、餌料及其養殖條件
實驗用仔魚取自湖北省石首市國家級長吻?良種場, 仔魚于2006年5月2號晚21:00點開始脫膜,水溫26℃, 于5月3號上午10: 00脫膜結束(數據來源于石首市國家級長吻?良種場)。仔魚于5月6號(4dph)下午1: 30分運回, 下午3: 00隨機分缸完畢,共10缸, 每缸330尾。
實驗在室內循環水系統中進行。該系統由10個底部為圓錐形的玻璃纖維缸組成。內設充氣石和進水口, 進行充氣和水流的交換。每個缸內放置一長26.7 cm、寬24.6 cm、高20.4 cm的白色有機塑料箱,箱子四周打孔并貼有絹篩, 用于水流交換, 防止仔魚逃逸。每個箱子水容積約為12.5 L, 仔魚放置其中。
實驗期間水溫控制在24—25℃, 光照周期為13h光亮和11h黑暗, 光亮周期從早7: 30持續到晚8: 30, 溶氧≥6 mg/L。實驗共進行13d。
實驗期間, 每天早8: 00至晚8: 00每4h飽食投喂新鮮孵化的鹵蟲(天津紅太陽水產品有限公司, 粗蛋白58%, 粗脂肪19%)。投餌后1h, 虹吸管吸去剩余的鹵蟲、未孵化的蟲卵粒和死去的仔魚。
1.2 取樣方法
每天早 7:30 取樣5尾用于形態學測定, 游標卡尺測定全長, 顯微鏡目測微尺測定口寬。仔魚剛出膜后取樣一次用于消化酶測定, 自孵化后5dph開始, 每天早7:30—8: 00(即距上次投喂11—12h取樣)間取樣一次, 取樣量據魚體增重情況每天做出調整,從最初的120 尾到實驗結束時40尾。日齡大于14dph的仔魚于腹部肛門處剪去尾部。取樣后, 用濾紙吸干魚體身上的水分后分裝入3個冷凍管, 立即放入液氮罐中速凍, 然后保存在?80℃冰箱中待測。所有樣品在實驗結束后半個月內測定完畢。實驗期間, 為消除外源性酶原帶來的影響, 取樣均在投喂前進行。
1.3 樣品分析
由于實驗魚規格的限制, 消化酶活性采用全魚勻漿測定。樣品解凍后, 按照1∶4 (w/v)的比例加入預冷勻漿介質。0℃下用玻璃勻漿器勻漿, 冰凍離心(4000 r/min, 10min), 取上清液, 分光光度計比色測定酶活。胰蛋白酶活性的測定采用N-苯甲酰基-L-精氨酸乙酯鹽酸鹽為底物測定[10]; 淀粉酶以淀粉為底物測定[11]; 脂肪酶的測定采用南京建成生物有限公司的試劑盒測定; 胃蛋白酶測定是在pH 2.0 的環境中以小牛血紅蛋白為底物測定[12]。蛋白總量根據Bradford[13]方法以小牛血清白蛋白作為標準蛋白測定。
1.4 數據分析
實驗數據采用Statistica 6.0 統計軟件進行統計分析。數據分析前進行齊性檢驗(Homogeneity test of variances, Levene’s test), 然后做一元方差分析(Oneway ANOVA), 差異顯著則進行多重比較 (Duncan’s multiple range tests), 顯著性水平為 P<0.05。結果表述為平均值±標準誤。
2 結果
在實驗中發現長吻?仔魚在5dph時就對鹵蟲有一個積極的攝食行為, 仔魚可以攝食新鮮孵化的鹵蟲。這和長吻?仔魚口寬的測定數據相一致。初次開口時仔魚的口寬為 (895±83) μm, 而剛孵化出的鹵蟲無節幼體體長一般為400—500 μm。
2.1 全長和口寬
長吻?仔魚自出膜到實驗結束, 全長、口寬的發育與其日齡表現出明顯的線性正相關(R2TL= 0.974, R2MW= 0.964, 圖1; P<0.05)。
口寬與全長比值(MW/TL)在初次開口時較高,開口后比值急劇下降, 自7dph開始維持在0.07—0.08, 口寬和全長處于同步發育期(圖2A), 二者呈現線性相關(R2=0.948, 圖2B)。
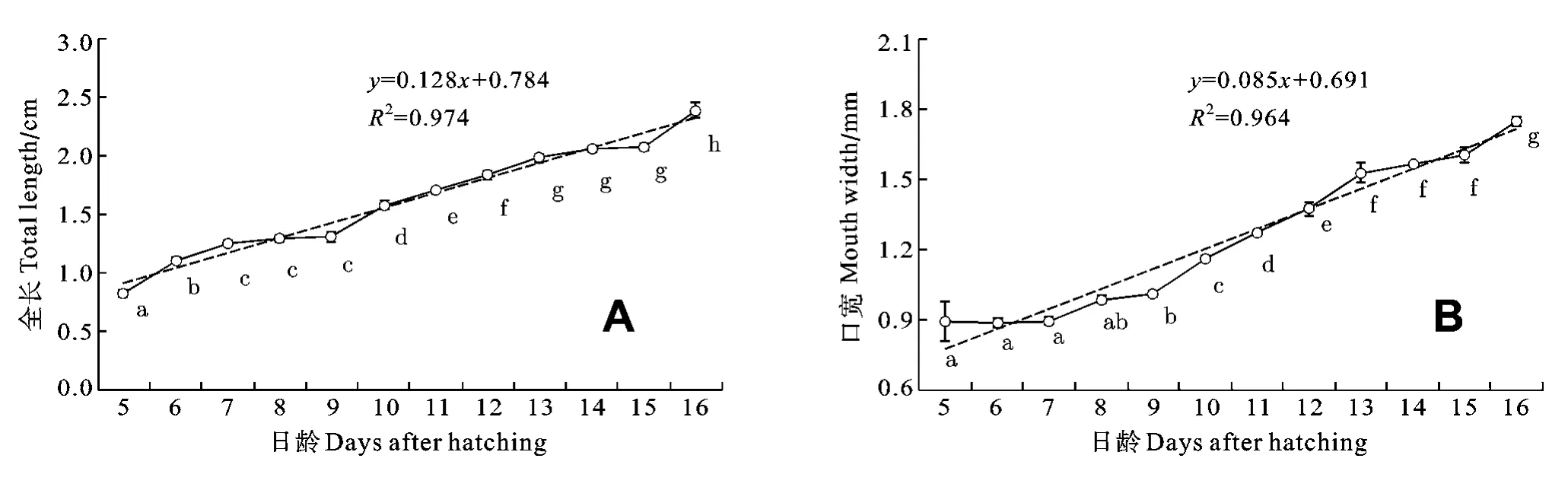
圖1 長吻?仔稚魚全長(A)和口寬(B)的發育以及與日齡的相關性Fig. 1 The relationships between (A) total length and (B) mouth width and developmental days in Chinese longsnout catfish larvae
2.2 消化酶
胃蛋白酶: 剛出膜仔魚胃蛋白酶活性較低0.89 U/(min·mg·protein)。出膜后活性顯著升高, 至8dph時初次達到最高值24.58 U/(min·mg·protein)。8—13dph時, 胃蛋白酶活性處于緩慢下降的趨勢, 但各日齡間無顯著差異(P>0.05)。13dph后活性再次快速上升, 實驗結束時達到最高39.63 U/(min·mg·protein) (圖3; P<0.05)。
胰蛋白酶: 表現出與胃蛋白酶相同的趨勢, 剛出膜時較低, 5—7dph顯著高于初孵仔魚, 8dph時繼續升高至2.70 U/(min·mg·protein)。8—13dph時, 活性在最高水平平穩的波動。14dph日齡時胰蛋白酶活性顯著降低, 15dph又顯著升高(圖4; P<0.05)。
脂肪酶: 自出膜后仔魚脂肪酶活性就一直處于上升期, 于8dph顯著升高, 并于12dph 時初次達到最高: 79.37 U/(min·g·protein)。8—12dph時各取樣時間點上的脂肪酶活性無顯著差異(P>0.05)。13dph時脂肪酶活性顯著下降至5—7dph時的水平。14—15dph又恢復至12dph時的水平 (圖5; P<0.05)。
淀粉酶: 自出膜后仔魚淀粉酶活性就一直處于上升期, 于8dph顯著升高后又顯著下降至6—7dph水平, 直到15dph日齡時才顯著上升至8dph水平(圖6; P<0.05)。
3 討論
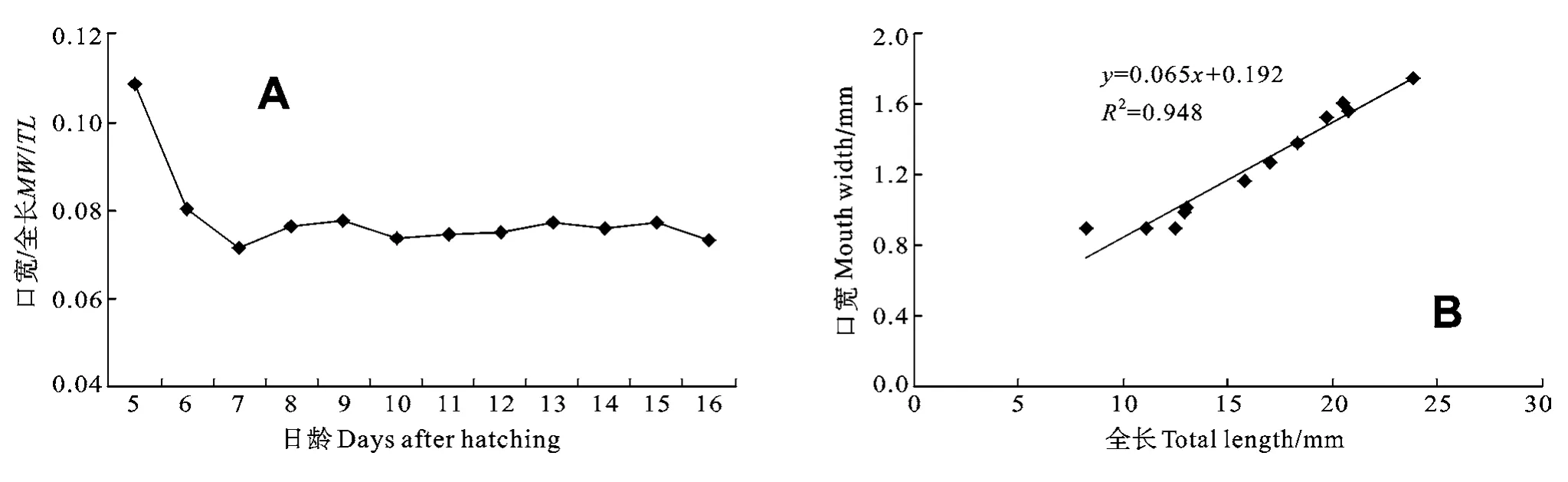
圖2 長吻?仔稚魚發育過程中的口寬/全長比(A)及口寬與全長的相關性(B)Fig. 2 The relationships between (A) ratio of mouth width / total length and developmental days and (B) mouth width and total length in Chinese longsnout catfish larvae
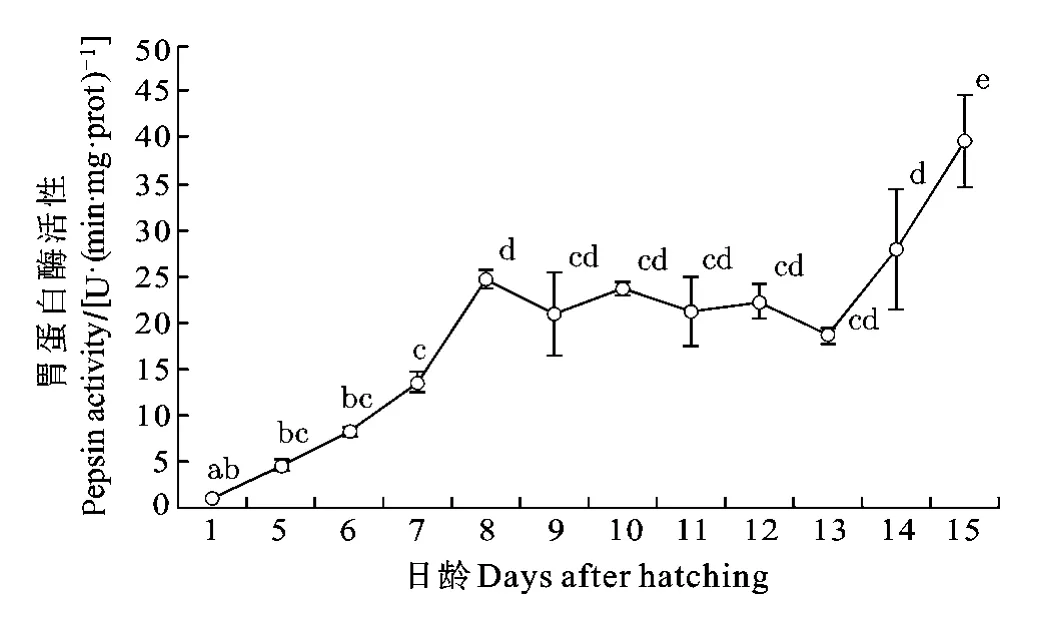
圖3 長吻?仔稚魚發育過程中胃蛋白酶活性變化Fig. 3 Variation of pepsin activity in Chinese longsnout catfish during larval development
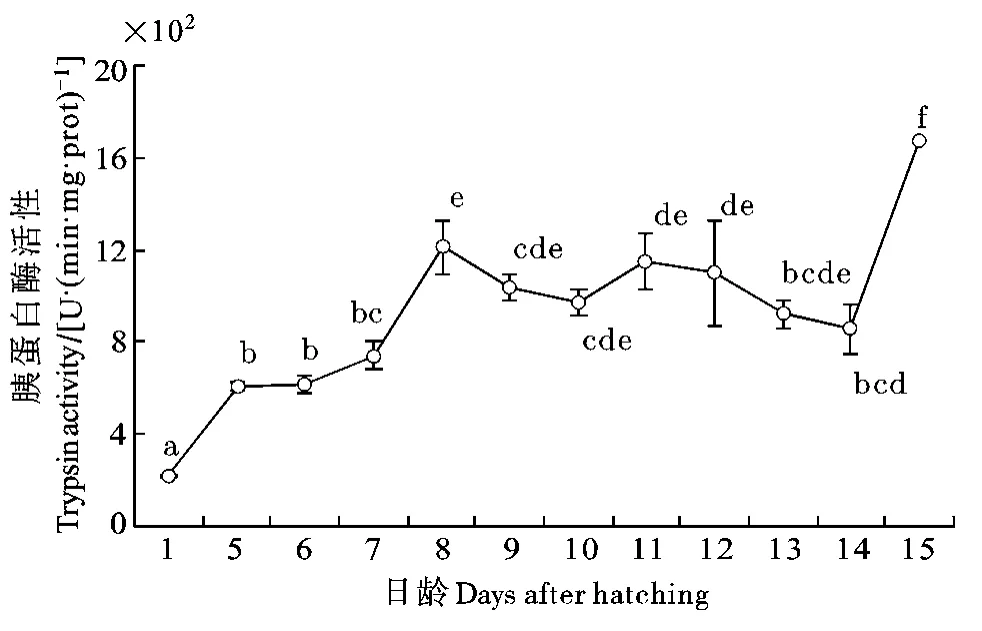
圖4 長吻?仔稚魚發育過程中胰蛋白酶活性變化Fig. 4 Variation of trypsin activity in Chinese longsnout catfish during larval development
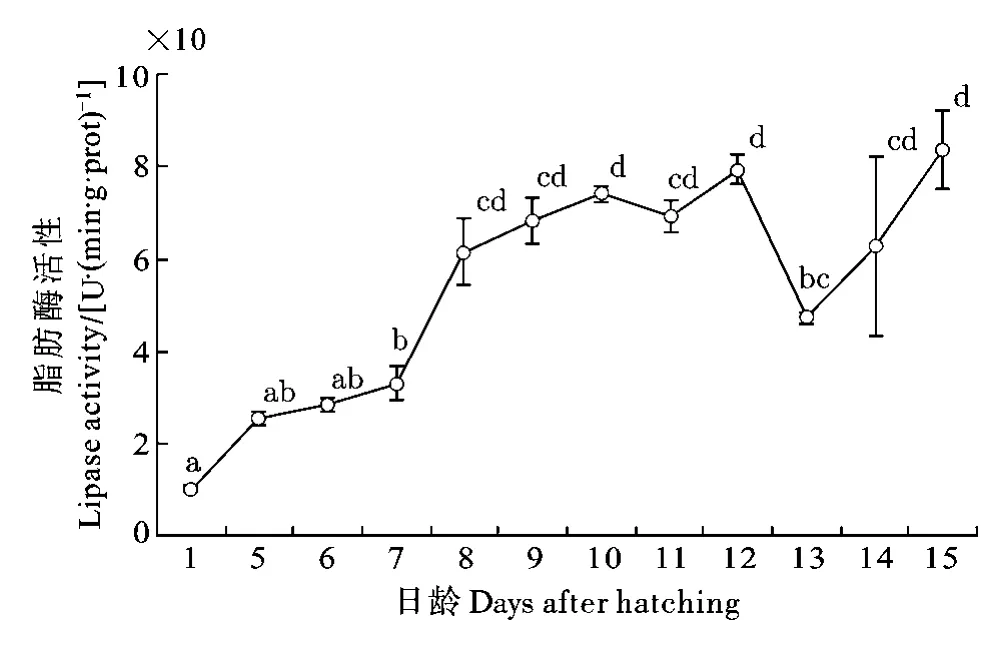
圖5 長吻?仔稚魚發育過程中脂肪酶活性變化Fig. 5 Variation of lipase activity in Chinese longsnout catfish during larval development
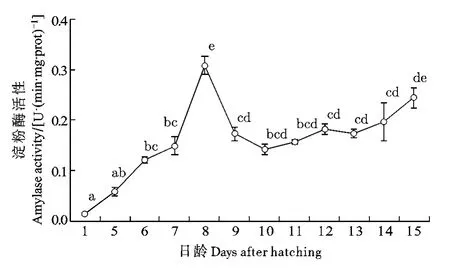
圖6 長吻?仔稚魚發育過程中淀粉酶活性變化Fig. 6 Variation of amylase activity in Chinese longsnout catfish during larval development
在本實驗中, 在初孵仔魚中均可檢測出4種消化酶的活性。仔魚孵化后第5天也就是仔魚開口的當天, 胰蛋白酶活性顯著高于初次孵化出來的仔魚,胃蛋白酶、脂肪酶活性在仔魚孵化后第7天即開口后的第3天, 淀粉酶活性在孵化后第6天, 顯著高于初次孵化出來的仔魚, 這說明長吻?在初次開口時就已為外源性餌料做好了準備。消化酶活性在仔魚開口前就在體內檢測到的現象在許多魚類中均有報道[14—22]。學者們認為這些酶的發育決定著仔魚消化外來食物的時間[23]。魚蝦消化道中相當重要的消化酶, 可以激活消化道內其他消化酶類[23—27]。仔魚開口攝食時間往往與仔魚體內胰蛋白酶原或者胰蛋白酶含量以及胰蛋白酶活性密切相關[6,14,24,28—30]。關鍵性酶的出現是仔魚消化能力的評價指標[23,31]。在本實驗中胰蛋白酶活性在仔魚開口初期就顯著高于初孵仔魚與上述學者的研究結果相一致。在本實驗中, 長吻?仔魚開口攝食之后, 胃蛋白酶、胰蛋白酶、脂肪酶和淀粉酶的活性均表現出先快速升高,繼而下降, 維持在一定的水平, 至實驗結束時又升高的趨勢。這種發育過程中酶活性最初升高, 繼之下降, 最后維持在一個相對固定的水平是脊椎動物包括魚類在內的發育階段的一個顯著的特征表現[32,33]。
一般而言, 仔魚發育階段消化酶的變化主要有兩方面原因造成: (1)餌料組成成分的影響; (2)不同消化器官生長和發育的影響。個體發生過程中, 消化酶活性的發生有兩個關鍵性的時期, 即仔魚內源性營養向外源性營養的轉換期以及仔魚向稚魚的轉變期。眾多的實驗表明: 各種消化酶的發育模式是和消化道各器官發育完善的水平密切相關的。功能性胃的出現被學者們認為是仔魚發育的最后一步,至此以后, 仔魚開始獲得類似于幼魚的消化特性[34]。在功能性胃出現前, 沒有酸的分泌以及胃蛋白酶消化的發生, 蛋白的消化主要由堿性蛋白酶(如胰蛋白酶和糜蛋白酶)[15,35]來完成。在仔魚發育過程中, 胰蛋白酶和糜蛋白酶活性逐漸減弱的同時胃蛋白酶及其類似物的活性逐漸升高意味著魚類消化功能逐漸由堿性向酸性蛋白酶轉變[36]。類胃蛋白酶最終成為主要的消化酶。在本實驗中, 自仔魚開口后, 胃蛋白酶活性一直升高, 至8—13dph達到平臺期, 升高幅度高達20倍, 說明在這一時期, 長吻?仔魚的胃處于快速發育期, 這也與長吻?消化道外在形態發育相一致: 5dph時, 長吻?仔魚消化道剛剛開始彎曲,消化管前段開始膨大, 至8dph時, 這一膨大部分形成胃。因此可以認為, 5—8dph是長吻?仔魚胃部發育的重要時期, 是長吻?仔魚由堿性消化為主向酸性蛋白酶消化為主的轉換時期。
本實驗的結果顯示隨著胃蛋白酶活性的增強,胰蛋白酶活性也逐漸增強, 與胃蛋白酶同一天達到一個最高點, 這種變化趨勢與Zambonino Infante 和Cahu[14]在歐洲鱸仔魚中的報道類似, 但與Chen, et al.[37]在黃尾?仔魚的研究不同, 黃尾?仔魚隨著胃腺的發育, 胃部逐漸的功能化, 胃蛋白酶的活性逐漸增強, 胰蛋白酶的活性逐漸減弱。這種發育趨勢的差異也許是由于魚類的不同種類以及不同的生長發育環境造成的。
從口寬和全長的發育以及口寬全長比可以看出在仔魚孵化后第7天, 仔魚的口寬與全長即進入同步快速發育期, 這與胃蛋白酶、胰蛋白酶、淀粉酶活性初次顯著高于初孵仔魚的時間相一致。代田昭彥[38]認為魚類的口器變化與攝食密切相關, 口裂關系到捕獲餌料的機能, 口寬決定攝食餌料的大小,仔魚期的口徑隨體長的增加而增大, 同時, 口徑比(口徑與全長的比值)也發生變化。孵化后不久的仔魚, 其口徑比隨體長的增加而迅速增大, 但到某一時期, 就開始縮小。仔魚期這種口徑比的變化和食性有密切關系。口徑比轉折點時的體長依魚種類而異, 似乎以這個體長為界線發生了食性的變化。本實驗中, 仔魚消化酶活性初次達到最高出現在仔魚開口攝食之后即仔魚由內源性營養向外源性營養的轉變期, 而口徑比在其孵化7d后即處于一個平穩的波動期, 從這種仔魚形態學與消化酶發育的一致性中我們可以推測長吻?仔魚自孵化后第8天消化功能趨于完善[24], 標志著仔魚轉食時機的開始。
仔魚發育期消化酶活性的變化到底是其自身發育的自然過程還是由于攝取的外源性活餌刺激所造成的, 學者們一直存在爭議, 但是近年來一些學者的實驗證明活餌刺激對仔魚消化酶活性的影響幾乎可以忽略不計[19,24,36,39,40]。在本實驗中為了避免外源性營養物質對仔魚消化酶的影響, 所有取樣均在仔魚投喂前進行, 所觀察到的消化酶的發育趨勢應該被認為是仔魚自身消化酶消化能力的表現, 而不是由攝取外來活餌造成的。正如在其他脊椎動物中所觀察到的一樣, 魚類消化酶的發生和個體發育過程中的變化是受其遺傳因素的調控的[41]。
綜上所述, 4種消化酶活性實驗數據說明長吻?仔稚魚消化功能在孵化后6—8dph逐漸完善。胰蛋白酶活性可以作為長吻?仔魚初次開口與否的評價指標。7dph后長吻?仔魚口寬和全長處于同步發育期, 標志著長吻?仔魚轉食時機的開始, 可以嘗試在此時期投喂人工配合餌料。確切的人工配合飼料投喂時間則需進一步的實驗來確定。
[1] Sanderson S L, Kupferberg S J. Development and evolution of aquatic larval feeding mechanisms [A]. In: Hall B K, Wake M H (Eds.), the Origin and Evolution of Larval Forms [C]. San Diego: Academic Press. 1999, 301—377
[2] Cahu C, Zambonino Infante J L, Escaffre A M, et al. Preliminary results on sea bass Dicentrarchus labrax larvae rearing with compound diet from first feeding, comparison with carp Cyprinus carpio larvae [J]. Aquaculture, 1998, 169(1-2): 1—7
[3] Yúfera M, Fernàndez-D?az C, Pascual E. A highly efficient microencapsulated food for rearing early larvae of marine fish [J]. Aquaculture, 1999, 177(1-4): 249—256
[4] Bengtson D A. A comprehensive program for evaluation of artificial diets [J]. Journal of the World Aquaculture Society, 1993, 24(2): 199—210
[5] Dabrowski K. The feeding of fish larvae: present state of the art and perspectives [J]. Reproduction Nutrition Development, 1984, 24(6): 807—833
[6] Lauff M, Hofer R. Proteolytic enzymes in fish development and the importance of dietary enzymes [J]. Aquaculture, 1984, 37(4): 335—346
[7] Kolkovski S, Tandler A, Kissil G W. The effect of dietary enzymes with age on protein and lipid assimilation and deposition in Sparus aurata larvae. Fish Nutrition in Practice. Institute National De La Recherche Agronomique, Paris (France), Colloques. 1993, 569—578
[8] Han D. Modeling for feeding system and pollution evaluation in Chinese longsnout catfish. PHD. Thesis. Institute of Hydrobiology, Chinese Academy of Sciences. Wuhan. 2005 [韓冬. 長吻?投喂管理和污染評估動態模型的研究. 中國科學院水生生物研究所博士學位論文. 武漢. 2005]
[9] Liu H Y, Lei W, Zhu X M, et al. Effects of different dietary vitamin C levels on Chinese longsnout catfish (Leiocassis longirostris Günther) [J]. Acta Hydrobiologica Sinica, 2009, 33(4): 681—689 [劉海燕, 雷武, 朱曉鳴, 等. 飼料中不同維生素C含量對長吻?的影響. 水生生物學報, 2009, 33(4): 681—689]
[10] Bergmeyer H U, Gawehn K, Grassi M. Trypsin [A]. In: Bergmeyer H U (Eds.), Methods of Enzymatic Analysis [C]. Academic Press, Inc., New York, NY. 1974, 515—516
[11] Métais P, Bieth J. Determination de l'a-amylase parune microtechnique [J]. Annal de Biologie Clinnique, 1968, 26: 133—142
[12] Anson M L. The estimation of pepsin, trypsin, papain, and cathepsin with hemoglobin [J]. The Journal of General Physiology, 1938, 22: 79—89
[13] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein—dye binding [J]. Analytical Biochemistry, 1976, 72(2): 248—254
[14] Zambonino Infante J L, Cahu C. Development and response to a diet change of some digestive enzymes in sea bass (Dicentrarchus labrax) larvae [J]. Fish Physiology and Biochemistry, 1994, 12(5): 399—408
[15] Zambonino Infante J L, Cahu C. Ontogeny of the gastrointestinal tract of marine fish larvae [J]. Comparative Biochemistry and Physiology Part C, 2001, 130(4): 477—487.
[16] Martinez I, Moyano F J, Fernandez-Diaz C. Digestive enzymes activity during larval development of the Senegal sole (Solea senegalensis) [J]. Fish Physiology and Biochemistry, 1999, 21(4): 317—323
[17] Ribeiro L, Zambonino Infante J L, Cahu C, et al. Development of digestive enzymes in larvae of Solea senegalensis, Kaup 1858 [J]. Aquaculture, 1999, 179(1-4): 465—473
[18] Cara J B, Moyano F J, Cárdenas S, et al. Assessment of digestive enzyme activities during larval development of white bream [J]. Journal of Fish Biology, 2003, 63(1): 48–58
[19] Baragi V, Lovell R T. Digestive enzyme activities in strippedbass from first feeding through larval development [J]. Transactions of the American Fisheries Society, 1986, 115(3): 478—484
[20] Cousin J C B, Baudin-Laurencin F, Gabaudan J. Ontogeny of enzymatic enzyme activities in fed and fasting turbot, (Scophthalmus maximus) L [J]. Journal of Fish Biology, 1987, 30(1): 15—33
[21] Moyano F J, Díaz M, Alarcón F J, et al. Characterization of digestive enzyme activity during larval development of gilthead seabream (Sparus aurata) [J]. Fish Physiology and Biochemistry, 1996, 15(2): 121—130
[22] Baglole C J, Goff G P, Wright G M. Distribution and ontogeny of digestive enzymes in larval yellowtail and winter flounder [J]. Journal of Fish Biology, 1998, 53(4): 767—784
[23] Gawlicka A, Parent B, Horn M H, et al. Activity of digestive enzymes in yolk-sac larvae of Atlantic halibut (Hippoglossus hippoglossus): indication of readiness for first feeding [J]. Aquaculture, 2000, 184(3-4): 303—314
[24] Oozeki Y, Bailey K M. Ontogenetic development of digestive enzyme activities in larval walleye pollock Theragra chalcogramma [J]. Marine Biology, 1995, 122(2): 177—186
[25] Pedersen B H, Nilssen E M, Hjelmeland K. Variations in the content of trypsin and trypsinogen in larval herring (Clupea harengus) digesting copepod nauplii [J]. Marine Biology, 1987, 94(2): 171—178
[26] Lazo J P, Holt G, Arnold C. Ontogeny of pancreatic enzymes in larval red drum Sciaenops ocellatus [J]. Aquaculture Nutrition, 2000, 6(3): 183—192
[27] Garcia-Ortega A, Verreth J, Van Hoornyck A, et al. Heat treatment affects protein quality and protease activity in decapsulated cysts of Artemia when used as starter food for larvae of African catfish Clarias gariepinus (Burchell) [J]. Aquaculture Nutrition, 2000, 6(1): 25—31
[28] Hjelmeland K, Huse I, J?rgensen T, et al. Trypsin and trypsinogen as indices of growth and survival potential of cod Gadus morhua L. larvae [A]. In: Dahl E, Danielssen D S, Moksness E, et al. (Eds.). The Propagation of Cod Gadus morhua L [C]. University of Troms?, Troms?, Norway. 1984, 189—202
[29] Kurokawa T, Suzuki T. Formation of the diffuse pancreas and the development of digestive enzyme synthesis in larvae of the Japanese flounder Paralichthys oliíaceus [J]. Aquaculture, 1996, 141(3-4): 267—276
[30] Ueberschar B. Measurement of proteolytic enzyme activity: significance and application in larval fish research [A]. In: Walther B T, Fyhn H J (Eds.). Physiology and Biochemistry of Fish Larvae Development [C]. University of Bergen Press, Bergen, Norway. 1993, 233—238
[31] Moyano F J, Sarasquete M C. A screening on some digestive enzyme activities of gilthead seabream (Sparus aurata) larvae [A]. World Aquaculture’93. E.A.S Special Publication [C]. 1993, 19: 366
[32] Henning S J. Functional development of the gastrointestinal tract [A]. In: Johnson L R (Eds.). Physiology of the Gastrointestinal Tract[C]. 2rd edition. Raven Press, New York. 1987, 285—300
[33] Kim B G, Divakaran S, Brown C L. Comparative digestive enzyme ontogeny in two marine larval fishes: Pacific threadfin (Polydactylus sexfilis) and bluefin trevally (Caranx melam pygus) [J]. Fish Physiology and Biochemistry, 2001, 24(3): 225—241
[34] Gawlicka A, Leggiadro C T, Gallant J W, et al. Cellular expression of the pepsinogen and gastric proton pump genes in the stomach of winter flounder as determined by in situ hybridization [J]. Journal of Fish Biology, 2001, 58(2): 529—536
[35] Pérez-Casanova J C, Murray H M, Gallant J W, et al. Development of the digestive capacity in larvae of haddock (Melanogrammus aeglefinus) and Atlantic cod (Gadus morhua) [J]. Aquaculture, 2006, 251(2-4): 377—401
[36] Lazo J P, Mendoza R, Holt G J, et al. Characterization of digestive enzymes during larval development of red drum (Sciaenops ocellatus) [J]. Aquaculture, 2007, 265(1-4): 194—205
[37] Chen B N, Qin J G, Kumar M S, et al. Ontogenetic development of the digestive system in yellowtail kingfish Seriola lalandi larvae [J]. Aquaculture, 2006, 256(1—4): 489—501
[38] Liu S Y, Yong W Y. Aquatic Bait Biology [M]. Beijing: The Agriculture Press. 1985, 149—177 [劉世英, 雍文岳. 水產餌料生物學. 北京: 農業出版社. 1985, 149—177]
[39] Cahu C L, Zambonino Infante J L. Is the digestive capacity of marine fish larvae sufficient for compound diet feeding [J]? Aquaculture Intentional, 1997, 5(2): 151—160
[40] Kurokawa T, Suzuki T. Development of intestinal brush border aminopeptidase in the larval Japanese flounder Paralichthys olivaceus [J]. Aquaculture, 1998, 162(1-2): 113—124
[41] Buddington R K, Doroshov S I. Digestive enzyme compliment of white sturgeon (Acipenser transmontanus) [J]. Comparative Biochemistry and Physiology, 1986, 83(3): 561—567
VARIATION OF DIGESTIVE ENZYMES AND MOUTH WIDTH DURING LARVAL DEVELOPMENT OF CHINESE LONGSNOUT CATFISH (LEIOCASSIS LONGIROSTRIS GüNTHER) FED WITH ARTEMIA
LIU Bian-Zhi1,2, ZHU Xiao-Ming1, LEI Wu1, HAN Dong1, YANG Yun-Xia1, JIN Jun-Yan1and XIE Shou-Qi1
(1. State Key Laboratory of Freshwater Ecology and Biotechnology, Institute of Hydrobiology, Chinese Academy of Sciences, Wuhan 430072, China; 2. Henan Agricultural University, College of Animal Science and Veterinary Medicine, Zhengzhou 450002, China)
Ontogentic changes of four digestive enzymes (amylase, lipase, trypsin, pepsin) and the morphological parameters of total length and mouth width were investigated in Chinese longsnout catfish larvae fed with Artemia. The experiment lasted for 13 days. The results showed that 1) total length (TL) and mouth width (MW) of the larvae increased linearly with time after hatching (R2TL= 0.974, R2MW= 0.964; P<0.05). The ratio of mouth width to total length decreased from 5 to 7dph (days after hatching) (P<0.05) and then reached to a plateau at 0.07—0.08. The fact that mouth width developed synchronically with total length from 7dph indicated the beginning of the weaning time. All the digestive enzymes were detected at the first feeding. Trypsin activity was significant higher in 5—7dph larvae than that of the newly hatched fish, which accompanied the first feeding behavior at 5dph. Pepsin and lipase activities in 7dph larvae and amylase activities in 6dph larvae were significantly higher than that of the newly hatched larvae. The high and stable activities of the digestive enzymes during 8—13dph indicated that the digestive tract was fully developed.
Leiocassis longirostris Günther; Digestive enzyme; Larvae; Mouth width; Total length
S962
A
1000-3207(2013)01-0125-07
10.7541/2013.125
2011-12-02;
2012-10-30
現代農業產業技術體系建設專項資金(CARS-46-19); 公益性行業(農業)專項“水產養殖動物營養需求與高效配合飼料開發(201003020)”; 公益性行業(農業)科研專項“飼料高效低耗加工技術研究與示范(201203015)”公益性行業(農業)科研專項“淡水池塘工程化改造與環境修復技術研究與示范(201203083)”資助
劉變枝(1981—), 女, 河南開封人; 博士研究生; 研究方向為魚類生理生態學。E-mail: liubianzhi@126.com
解綬啟, E-mail: sqxie@ihb.ac.cn

