以白酒酒糟為原料發酵產丁二酸*
周小兵,鄭璞
(工業生物技術教育部重點實驗室,江南大學生物工程學院,江蘇無錫,214122)
丁二酸又名琥珀酸,是三羧酸循環的中間產物,在農業、醫藥、食品、化工領域有著廣泛的應用[1]。目前商業化的丁二酸主要由化學法制得[2],該法依賴于不可再生的石化資源,同時存在環境污染問題[3]。微生物厭氧發酵生產丁二酸是利用微生物將糖和CO2轉化成丁二酸,可以擺脫丁二酸產品對化石原料的依賴,具有環境友好,緩解溫室效應的優勢。生物基丁二酸2004年經美國能源部評估,被認為是未來12種最有價值的生物基化學品之一[3]。雖然微生物發酵法生產丁二酸具有廣闊的前景,但發酵成本偏高影響著其工業化的進程,而尋找廉價易得的原料是降低成本的有效手段之一。
白酒酒糟是釀酒工業最主要的副產物,2011年我國白酒產量達到1 025.55萬kL[4],固態法生產1 t白酒約產生10 t酒糟[5],我國白酒酒糟產量近1億t。濕酒糟含有大量水分(60% ~70%),還有殘余糖和淀粉,酸度高,不易保存,容易腐爛變質,造成嚴重的環境污染。同時酒糟中含有的纖維素、蛋白質、氨基酸、維生素和多種微量元素也得不到合理有效的利用,造成資源浪費。目前對酒糟的綜合利用開始受到廣泛的關注,除了傳統的作為飼料[6]和肥料[7],利用酒糟培養食用菌[8],提取蛋白質[9]、植酸[10]、復合氨基酸和微量元素[11],以及利用發酵生產沼氣[12]、食醋[13]、甘油[14]等的研究也在進行。本課題組先后開展了以廢糖蜜[15]、菊芋[16]和秸稈[17]為原料發酵產丁二酸的研究。本文旨在研究以白酒酒糟為原料發酵生產丁二酸的工藝路線,一方面為發酵丁二酸生產提供新的原料來源,另一方面又為白酒酒糟綜合利用提供新的途徑。
1 材料與方法
1.1 材料
1.1.1 菌種與酶
琥珀酸放線桿菌A.succinogenes F3-21,由本實驗室保藏[18];纖維素酶10 000 U/mL,購自康地恩生物集團;纖維二糖酶購自Sigma公司,≥250 U/mL。耐高溫α-淀粉酶20 000 U/mL,購自山東杰諾生物酶有限公司;糖化酶(100 000 U/mL)購自山東隆大生物工程有限公司。
1.1.2 原料
白酒酒糟,由四川瀘州老窖集團有限公司提供,經干燥粉碎,過40目篩,其成分經測定為:粗蛋白17.15%,粗纖維37.91%(木質素10.68%,纖維素19.34%,半纖維素7.89%,其中纖維素半纖維素共27.23%,為方便表述將其統稱為纖維素),粗脂肪6.02%,無氮浸出物 39.76%,灰分 9.16%,淀粉12.35%。
1.1.3 培養基
種子活化培養基:參照文獻[18]。
分批發酵培養基(g/L):白酒酒糟80~400酶水解液(含固型物),K2HPO4·3H2O 1.5,NaH2PO4·2H2O 1.5,MgCl2 ·6H2O 0.2,CaCl20.2。
同步糖化發酵培養基(g/L)白酒酒糟:160~320,K2HPO4·3H2O 1.5,NaH2PO4·2H2O 1.5,MgCl2·6H2O 0.2,CaCl20.2。
1.1.4 儀器
SHZ-88A往復式恒溫水浴振蕩器,蘇州培英實驗設備有限公司;752紫外可見光分光光度計,上海精密科學儀器有限公司;厭氧培養箱YQX-Ⅱ上海躍進醫療器械廠;7 L攪拌發酵罐,NBS BIOFLO 110 Fermentor;高效液相色譜儀,美國Waters 1512。
1.2 方法
1.2.1 成分分析方法
粗纖維成分分析采用Van Soest法[19],蛋白質含量分析方法采用凱氏定氮法[19],淀粉含量分析采用酸水解法[19],粗脂肪含量分析采用索氏抽提法[19],灰分分析方法采用灼燒法,還原糖含量測定采用3,5-二硝基水楊酸比色法[20],有機酸含量分析方法采用離子排斥高效液相色譜法[21]。
1.2.2 白酒酒糟中纖維素與淀粉的水解
纖維素水解:稱8 g酒糟,加水25 mL調pH至4.8,加纖維素酶和纖維二糖酶(用量分別為5 000 U/g DGS和50 U/g DGS)于50℃恒溫水浴水解。
淀粉水解:10 g酒糟加水至25 mL,加α-淀粉酶(2 400 U/g DGS)于90℃液化1 h,冷卻調 pH 4.5,加糖化酶(1 800 U/g DGS)于60℃恒溫水浴水解。
淀粉和纖維素分步水解:10 g酒糟加水至25 mL,按上述的酶用量與水解條件,先纖維素或淀粉依次水解。
淀粉和纖維素同時水解:10 g酒糟加水至25 mL,先加 α-淀粉酶液化,90℃1 h再調 pH 4.5 ~4.8,同時加入纖維素酶和淀粉酶,在50℃或60℃下恒溫水解。
1.2.3 發酵方法
分步糖化發酵:2、4、6、8、10 g 酒糟分別加水至25 mL,先加纖維素酶和纖維二糖酶在50℃、pH 4.8條件下恒溫水浴8 h,然后加 α-淀粉酶在90℃ pH 6.0條件下液化1 h,再加糖化酶在60℃、pH 4.5條件下恒溫水浴4 h,然后補加無機鹽配制成發酵培養基,調節 pH 6.5,121℃滅菌 20 min,37℃在 CO2環境下培養48 h,分析發酵液有機酸含量。
同步糖化發酵:4、5、6、7、8 g 酒精加水至 25 mL,先加纖維素酶和纖維二糖酶在50℃ pH 4.8條件下水解8 h,然后再加α-淀粉酶在90℃ pH 6.0條件下液化1 h,然后補加無機鹽配制成發酵培養基,調節pH 6.5,121℃滅菌20 min,接種發酵20 h后,加入膜濾的糖化酶,37℃在CO2環境下培養48 h,分析發酵液有機酸含量。

其中,c為還原糖濃度,g/L;c0為丁二酸濃度,g/L;C為酒糟濃度,g/L;ω1,ω2分別為酒糟中纖維素半纖維素含量;ω3為酒糟中淀粉含量。
2 結果與討論
2.1 白酒酒糟中纖維素和淀粉的分別水解
2.1.1 纖維素酶水解酒糟
白酒酒糟含有約37.91%的粗纖維(其中纖維素和半纖維素共27.23%),加纖維素酶和纖維二糖酶后纖維素和半纖維素轉化為還原糖,可供琥珀酸放線桿菌利用。圖1顯示,在50℃,pH 4.8條件下,前4 h白酒酒糟中纖維素的水解速率最快,4 h至8 h期間水解速率減慢,8 h之后,還原糖量增加極少,水解率為43.31%,最終還原糖濃度達到35.5 g/L,還原糖對酒糟得率約110 mg/g酒糟,纖維素水解率為44.04%,為減少能耗,水解時間確定為8 h。

圖1 水解時間對酒糟纖維素水解的影響Fig.1 Effect of time on hydrolysis of cellulose in SDG
2.1.2 糖化酶水解酒糟
酒糟中殘留12.35%淀粉,通過α-淀粉酶和糖化酶水解后,才能被琥珀酸放線桿菌利用。如圖2所示,400 g/L酒糟中淀粉經過α-淀粉酶水解后,加入糖化酶,經4 h還原糖濃度達到49.8 g/L,水解率為90.67%,4 h后還原糖含量略有增加,最終還原糖濃度為50.6 g/L,還原糖對酒糟得率約126 mg/g酒糟,淀粉水解率為92.26%。
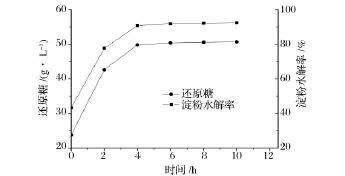
圖2 時間對酒糟淀粉水解的影響Fig.2 Effect of time on hydrolysis of starch in SDG
2.2 纖維素酶和糖化酶共同水解白酒酒糟
如表1所示,先水解白酒酒糟中的纖維素,后水解其中的淀粉時,淀粉水解率僅為8.6%;而先水解白酒糟中淀粉再加纖維素酶水解其中的纖維素時,纖維素水解率也僅為9.1%。后者總還原糖得率略高,但遠低于兩種酶單獨作用之和(110+126)mg/g,其原因可能是葡萄糖濃度達到一定量時,糖苷水解酶活性受到產物的反饋抑制,后水解組分水解率低。分別在纖維素酶或糖化酶作用的最適反應溫度和pH條件下,同時用兩種酶進行水解酒糟,結果兩者水解所產生的還原糖濃度相差不大(約為60 g/L),且與分步水解的總還原糖得率相當,進一步說明了產物對糖苷水解酶的抑制可能是制約還原糖濃度提高的主要原因。

表1 酶水解順序對酒糟水解的影響Table 1 Effect of enzymes adding order on hydrolysis of SDG
2.3 不同濃度酒糟對酒糟分步糖化發酵產丁二酸的影響
初始酒糟濃度與初始還原糖濃度直接相關,初始糖濃度對丁二酸的發酵有明顯影響。圖3顯示,隨著酒糟濃度的增加,水解得到的還原糖濃度升高,發酵產丁二酸的濃度也增加。酶處理后得到的酒糟水解液中固形物也增多,同時由酒糟所帶入的乳酸也增加,使得發酵丁二酸產率的增加變緩。酒糟濃度為400 g/L時,還原糖濃度為58.3 g/L,丁二酸產量為28.8 g/L。
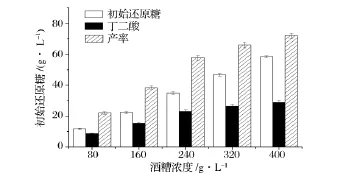
圖3 不同酒糟濃度對分步糖化發酵生產丁二酸的影響Fig.3 Effect of SDG concentration on the production of succinic acid using separate hydrolysis and fermentation method
2.4 不同濃度酒糟對酒糟同步糖化發酵生產丁二酸的影響
由于酶水解酒糟時,水解產物對酶反應存在一定的反饋抑制作用,而且經過α-淀粉酶處理后,糖化酶在37℃,pH 6.5時仍能水解酒糟中淀粉,進行了同步糖化發酵實驗,結果如圖4所示。隨著酒糟濃度的增加,初始還原糖濃度增加,但發酵的殘糖也增加,發酵后丁二酸濃度先增后減,雜酸(乳酸、甲酸和乙酸)濃度增加,推測可能是發酵受到產物抑制。酒糟濃度為240 g/L時,經過纖維素酶作用之后得到還原糖35.5 g/L,然后加α-淀粉酶液化,再加糖化酶同步發酵后丁二酸濃度達到32.0 g/L。相同酒糟用量下,比分步糖化發酵的丁二酸的濃度提高了37.3%。對酒糟產率從72 mg/g酒糟增加到133 mg/g酒糟。
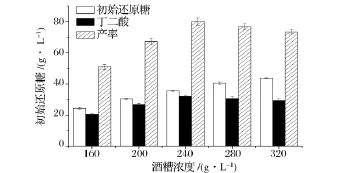
圖4 不同酒糟濃度對同步糖化發酵生產丁二酸的影響Fig.4 Effect of SDG concentration on the production of succinic acid using separate hydrolysis and fermentation method
3 結論
白酒酒糟酶法處理過程中,用纖維素酶和糖化酶水解白酒酒糟,得到的還原糖得率要低于2種酶單獨水解的還原糖得率之和,白酒糟經兩種酶水解后總還原糖得率約為150 mg/g酒糟。采用先水解白酒酒糟,后發酵白酒酒糟水解液的分步糖化發酵工藝,其較佳的白酒酒糟用量為400 g/L,發酵液丁二酸濃度為28.8 g/L;采用先水解白酒糟中纖維素,后對其淀粉進行同步糖化發酵的工藝,較佳的白酒酒糟用量為240 g/L,發酵液中丁二酸濃度為32 g/L。比較兩種工藝,同步糖化發酵工藝的丁二酸產率(133 mg/g)是分步糖化發酵(72 mg/g)的1.8倍,具有明顯優勢。
白酒酒糟用于生產丁二酸不需要外源添加氮源,不需要像秸稈、玉米芯等原料耗費大量酸堿進行預處理,具有一定的優勢。白酒酒糟發酵生產丁二酸既為發酵丁二酸生產提供了新的原料來源,又為白酒酒糟綜合利用提供了新的途徑,具有一定的應用前景。
[1] Zeikus J G,Jain M K,Elannovan P.Biotechnology of succinic acid production and markets for derived industrial products[J].Appl Microbiol Biotechnol,1999,51(5):545-552.
[2] Song H,Lee S Y.Production of succinic acid by bacterial fermentation[J].Enzyme Microb Technol,2006,39(3):352-361.
[3] 鄭璞,孫志浩.生物質原料發酵生產丁二酸研究進展[J].生物產業技術,2009(增刊):31-36.
[4] 王延才.中國釀酒工業協會白酒分會2011年工作報告[J].釀酒科技,2012,217(7):17-25.
[5] 施安輝.國內白酒工業固體酒糟環保生態化利用的現狀及前景[J].中國釀造,2006,156(3):4-7.
[6] 魯文普,楊玉能.酒糟的飼料化利用概況[J].貴州畜牧畜醫,2009,33(4):9 -10.
[7] 潘保原,曹越.不同劑量酒糟對鹽堿土壤的改良作用[J].環境科學與管理,2009,34(10):135-137.
[8] 張鑫,李志強,相里加雄,等.利用汾酒酒糟生產冬蟲夏草的工藝條件研究[J].釀酒科技,2010,191(5):95-97.
[9] 姜福佳,王玉萍,周暢,等.酒糟中蛋白質的提取工藝[J].吉林大學學報,2010,48(1):152-156.
[10] 張云鵬,劉軍,陳娟.白酒糟植酸提取條件的優化[J].中國釀造,2010,216(3):125-127.
[11] 蔣瀅,黃美英.從酒糟中提取復合氨基酸及微量元素[J].食品工業科技,1991(6):14-15.
[12] 郭婷,徐帥,呂孝宇,等.秸稈-酒糟混合液厭氧發酵產沼氣的初步研究[J].食品工業科技,2010,31(8):248-250.
[13] 高曉娟,王君高,王欣,等.酒糟在食醋釀造中的應用研究[J].中國調味品,2010,35(7):45-47.
[14] 丁琳,聶英龍,化興仇,等.酒糟發酵制取甘油的研究[J].沈陽化工學院學報,2000,14(2):158-160.
[15] 董晉軍,鄭璞,孫志浩,等.利用甘蔗糖蜜半連續發酵生產琥珀酸[J].化工學報,2008,59(6):1 490-1 495.
[16] 董晉軍,鄭璞,倪曄,等.菊芋原料同步糖化發酵生產丁二酸[J].食品與生物技術學報,2008,27(5):78-82.
[17] 孔德城,鄭璞,董晉軍,等.堿處理秸稈同步糖化發酵生產丁二酸[J].食品與發酵工業,2011,37(10):1-5
[18] 劉璇,鄭璞,倪曄,等.基因改組技術選育耐酸性琥珀酸放線桿菌[J].微生物學通報,2009,36(11):1 676-1 681.
[19] 張麗英.飼料分析及飼料質量檢測技術[M].北京:北京農業大學出版社,2007.70.
[20] Miller G L.Use of dinitrosalicylic acid regent for determination of reducing sugar[J]. Analytical Chemistry,1959,31(3):426-428.
[21] 劉宇鵬,鄭璞,孫志浩.采用離子排斥色譜法分析發酵液中的琥珀酸等代謝產物[J].工業微生物,2007,37(5):1-5.

