纈氨酸轉氨酶拆分DL-纈氨酸的催化條件*
張飛,魏濤,劉寅,韓亞偉,何培新
(鄭州輕工業學院,食品與生物工程學院,河南鄭州,450002)
D-氨基酸作為重要的中間體,在食品添加劑、醫藥和農藥等行業應用,廣泛市場需求較大,已逐漸成為氨基酸行業新的發展方向[1-3]。D-丙氨酸作為原料可用于合成甜味劑阿力甜,也可用于合成農藥精甲霜靈[4-5]。D-纈氨酸作為重要的中間體可用于合成高效殺蟲劑氟胺氰菊酯[6-7]。
轉氨酶在合成某些氨基酸及其衍生物領域具有一定應用價值。目前,關于轉氨酶的研究報道較多的是該酶的酶學性質、催化機制及抑制動力學研究[8-10]。大腸桿菌纈氨酸轉氨酶可以催化L-纈氨酸與丙酮酸反應生成α-酮異戊酸和L-丙氨酸。理論上,利用該酶可以把纈氨酸外消旋混合物中的L-纈氨酸轉化為α-酮異戊酸,從而實現外消旋纈氨酸的拆分。目前,關于纈氨酸轉氨酶在氨基酸手性拆分領域的應用報道甚少。本研究利用具有纈氨酸轉氨酶活性的工程菌,初步考察了反應溫度、pH、底物摩爾比、底物濃度和對拆分反應的影響,進而確定酶促反應的最佳條件。研究結果顯示纈氨酸轉氨酶具有一定應用潛力。
1 材料與方法
1.1 材料與儀器
纈氨酸轉氨酶基因工程菌(pET-32a-avtA)由本實驗室構建。蛋白胨、酵母浸膏、丙酮酸均購自國藥集團化學試劑有限公司;異丙基-β-D-硫代半乳糖苷(IPTG),純度≥98%,購自南京基天生物科技有限公司;戊二醛(25%),天津市津宇精細化工廠;L-纈氨酸,分析純,湖北新生源生物工程股份有限公司;DL-纈氨酸,純度≥99%,由本實驗室制備;茚三酮,分析純,上海化學試劑站中心化工廠;其他試劑均為分析純。LB液體培養基組成(1 L體系):蛋白胨10 g,酵母提取物5 g,NaCl 5 g,定容前用NaOH調節pH至7.0,120℃高壓滅菌備用。
THZ-C恒溫振蕩器(太倉博萊特實驗儀器廠);日立UV-3000型分光光度計(日本Hitachi公司);日立CR22E型離心機(日本Hitachi公司);自動旋光儀WZZ-2A;P2S電子天平(上海恒平科學儀器有限公司);RE2002旋轉蒸發儀(上海予華儀器有限公司)。
1.2 菌種培養條件
上述纈氨酸轉氨酶基因工程菌平板挑單克隆接種于10 mL含氨芐青霉素50 μg/mL的LB液體培養基,37℃恒溫振蕩培養過夜。次日,過夜培養物接種于2 L含氨芐青霉素50 μg/mL的LB液體培養基,37℃恒溫振蕩(180 r/min)培養6 h,使菌液600 nm光密度大約至0.5。然后冷卻至30℃,加入終濃度為0.4 mmol/L IPTG,在30℃誘導8~10 h。最后離心收集細胞(5 000 r/min,4℃,15 min)。
1.3 菌體酶活力測定
稱取0.1 g菌體置于100 mL三角瓶中,加入終濃度為0.2 mol/L DL-纈氨酸和0.1 mol/L丙酮酸溶液10 mL,加入 10% 土溫-80 50 μL,調節 pH=7,于37℃攪拌反應20 min,離心除菌體,收集上清液煮沸5 min滅酶活,冷卻。在以上條件下,纈氨酸轉氨酶酶單位定義為每1 min每生成1 μmol的 L-丙氨酸所用的細胞量。
1.4 底物摩爾比對轉化率的影響
DL-纈氨酸濃度固定為0.2 mol/L,另一底物丙酮酸濃度分別為 0.1、0.2、0.4、0.8、1.0、1.2 mol/L,即L-纈氨酸與丙酮酸的摩爾比分別為1∶1、1∶2、1∶4、1∶8、1∶10 和 1∶12。反應體積 20 mL,菌體用量 0.2 g,調節pH值至9,于45℃下攪拌反應18 h。然后取樣測定樣品中L-丙氨酸含量。轉化率定義為:

1.5 底物濃度對轉化率的影響
DL-纈氨酸終濃度分別為 0.2、0.6、1.0、1.4、1.8 mol/L,丙酮酸終濃度分別為 0.8、2.4、4.0、5.6、7.2 mol/L,即L-纈氨酸與丙酮酸摩爾比為1∶8。反應體積30 mL,菌體用量0.6 g,調節pH值至9,于45℃下攪拌反應48 h。然后取樣測定L-丙氨酸含量。
1.6 金屬離子對酶活的影響
在反應體系中分別加入終濃度為0.5 mmol/L的Cu2+、Co2+、Fe2+、Mn2+、Mg2+、Na+,測定酶活力,以不加金屬離子作為對照。
1.7 丙氨酸含量測定
反向高效液相色譜(RP-HPLC)測定樣品中L-丙氨酸的濃度,所用色譜柱為Cosmosil 5C18-AR,20 mm i.d.×250 mm,5 μm流動相為0.06%TFA水溶液-乙腈(體積比為98∶2),流速為1.0 mL/min,進樣量為 10 μL。
2 結果與分析
2.1 溫度對酶活的影響
溫度對酶活力的影響見如圖1。纈氨酸轉氨酶在45℃時酶活達到最大值,可以看出在一定范圍內,隨著溫度升高,酶活性逐漸增大;相對酶活達到最大值后,隨著溫度的進一步升高,酶活反而減小。
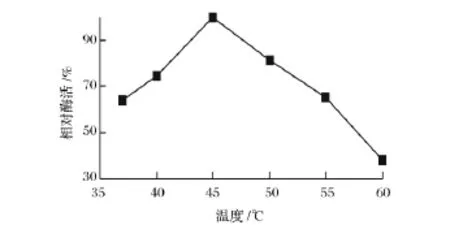
圖1 溫度對酶活力的影響Fig.1 Effect of temperature on enzyme activity
2.2 pH值對酶活的影響
酶活隨pH值的變化規律如圖2所示。在一定pH值范圍內,酶活隨著pH值的升高而相應的升高;當酶活性升高到最大值后隨著pH值的進一步升高,酶活性開始降低;菌體的最適pH在pH=9附近。從實驗結果還可以看出,該酶的最適pH值比生物體內天然pH值高,其原因是轉氨反應屬于加成反應,其反應機理是由供體氨基氮原子的孤對電子進攻受體酮酸羰基碳原子,在酶的作用下,形成反應中間體,然后生成產物。較高的pH值可以使供體氨基氮原子更多處于自由態,而不是結合H+離子,這樣更有利于氮原子進攻羰基碳原子發生化學反應。
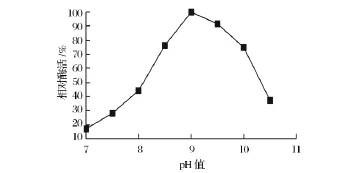
圖2 pH對酶活力的影響Fig.2 Effect of pH on enzyme activity
2.3 底物摩爾比對轉化率的影響
在酶催化的多底物生化反應中,增加其中一種底物的相對濃度常常可以促進另一種底物的轉化。從圖3可以看出,隨著底物L-纈氨酸與丙酮酸的摩爾比逐漸增大,轉化率也同時增大;當底物L-纈氨酸與丙酮酸的摩爾比增加到1∶8時,轉化率達到最大值98.7%;之后,隨著摩爾比的進一步增加,轉化率趨于穩定。因此,選擇L-纈氨酸與丙酮酸摩爾比1∶8為最佳底物比例。
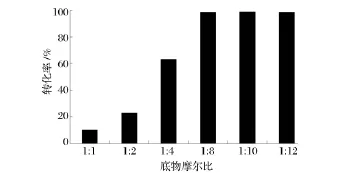
圖3 底物摩爾比對轉化率的影響Fig.3 Effect of substrate mole ratio on enzyme activity
2.4 底物濃度對轉化率的影響
從圖4可以看出,隨著底物濃度的增加轉化率有降低的趨勢。當L-纈氨酸底物濃度為0.1 mol/L和0.3 mol/L時,轉化率最分別是98.6%和98.3%;當L-纈氨酸濃度進一步升高時,轉化率明顯降低。高底物濃度條件下轉化率降低的原因可能是高濃度產物對催化反應的抑制。因此,為了充分發揮酶的催化效率,實際應用中以DL-纈氨酸為0.6 mol/L和丙酮酸濃度為2.4 mol/L作為最適底物濃度。
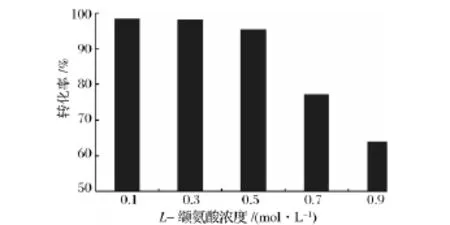
圖4 底物濃度對轉化率的影響Fig.4 Effect of substrate concentration on enzyme activity
2.5 金屬離子對酶活的影響
金屬離子可以影響酶解底物絡合物的形成,以及改變和影響酶的催化活性。從圖5可以看出,金屬離子對纈氨酸轉氨酶活性影響比較明顯,Cu2+、Co2+、Fe2+、Mn2+對酶活性有抑制作用,而 Mg2+、Na+對酶活性有一定的激活作用。
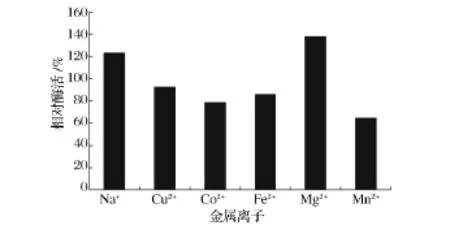
圖5 金屬離子對酶活的影響Fig.5 Effect of metal ion on enzyme activity
3 結論
目前制備D-氨基酸的方法主要有生物酶法、不對稱化學合成法和光學拆分法[11]。不對稱合成法需要純手性試劑或貴金屬絡合物作催化劑,該法成本高不適合大規模制備。光學拆分法(或非對映體鹽法)需要篩選合適的化學拆分劑,該法應用領域有限也不適合大量制備。生物酶法制備D-氨基酸由于具有經濟、高效、環保等優點逐漸成為國內外研究熱點[12]。本研究利用大腸桿菌纈氨酸轉氨酶把纈氨酸外消旋混合物中的L-纈氨酸轉化為α-酮異戊酸,從而實現外消旋纈氨酸的拆分。實驗中考察了反應溫度、pH值、底物摩爾比、底物濃度和金屬離子對拆分反應的影響,進而確定酶促反應的最佳條件。結果表明,該催化反應的最適反應條件為:反應溫度是45℃,pH=9,L-纈氨酸與丙酮酸的摩爾比 1∶8,DL-纈氨酸初始濃度為0.6 mol/L和丙酮酸初始濃度為2.4 mol/L,0.5 mmol/L的Mg2+和Na+對酶活性有明顯的促進作用。本實驗結果對于轉氨酶的進一步開發應用有參考價值。
[1] Yang H,Zheng G,Peng X,et al.D-Amino acids and DTyr-tRNA-Tyr deacylase:stereospecificity of the translation machine revisited [J].FEBS Letters,2003,552(2):95-98.
[2] 何仕國,俞一軍,許文松.DL-苯丙氨酸的酶法拆分研究[J].化學反應工程與工藝,2004,20(l),64-69.
[3] 吳美紅,鄭建仙.超高倍甜味劑N-[3-(3-羥基-4-甲氧基苯基)丙基]-阿斯巴甜的合成研究[J].食品與發酵工業,2009,35(6):1-5.
[4] 嚴傳鳴.氟胺氰菊酯的合成[J].現代農藥,2003,2(1):13-15.
[5] 李雪生,黃輝曄,林明珍,等.精甲霜靈柱層析凈化淋洗液的改進研究[J].廣西農業科學,2006,37(1):52-55.
[6] 湯家芳,劉芝蘭,肖玉秀,等.纈氨酸殺蟲菊酯的合成[J].氨基酸和生物資源,1998,20(1):45-50.
[7] 劉鵬飛,劉西莉,馬安捷,等.精甲霜靈與外消旋體甲霜靈對掘氏疫霉菌的抑菌活性比較[J].農藥學學報,2003,5(3):45-49.
[8] Banks J M,Yvon M,Gripon J C,et al.Enhancement of amino acid catabolism in Cheddar cheese using α-ketoglutarate:amino acid degradation in relation to volatile compounds and aroma character[J].International Dairy Journal,2001,11(4-7):235-243.
[9] Bartek T,Znnchen E,Klein B,et al.Analysing overexpression of L-valine biosynthesis genes in pyruvate-dehydrogenase-deficientCorynebacterium glutamicum [J].Journal of Industrial Microbiology& Biotechnology,2010,37(3):263-270.
[10] Wieschalka S,Blombach B,Eikmanns B J.Engineering Corynebacterium glutamicum for the production of pyruvate[J].Applied Microbiology and Biotechnology,2012,94(2):449-459.
[11] 劉鵬剛,張飛,劉均忠,等.氨基酰化酶固定化細胞光學拆分DL-丙氨酸[J].精細化工,2009,26(4):345-347.
[12] 陳建波,徐毅.D-型氨基酸的生物法制備[J].分子催化,2006,20(3):284-288.

