營養液培養糙米發芽富集GABA工藝條件優化
蔣 靜,馬 濤
(1.沈陽農業大學食品學院,遼寧沈陽110866;2.渤海大學化學化工與食品安全學院,遼寧錦州121013)
發芽糙米含有豐富的維生素A、B、E和礦物元素鉀、鈉、鐵、鋅等,而且還含有多種促進人體健康和防治疾病的成分,如谷胱甘肽、谷維素和阿魏酸,特別是糙米中的γ-氨基丁酸(GABA)含量在發芽時會大幅增加[1]。GABA具有改善腦機能,調整血壓,鎮靜神經,促進長期記憶,促進生長激素分泌,調節腎功能以及肝功能等作用[2],因而受到國內外廣泛關注。糙米發芽過程中,內源的谷氨酸脫羧酶(Glutamate decarboxylase,GAD)被活化,將糙米中的谷氨酸轉化為GABA,從而顯著的提高GABA的含量,而GAD活性又受環境pH、谷氨酸濃度等因素的影響[3]。谷氨酸脫羧會造成反應體系的pH不斷上升,使反應速度下降,因此一般在緩沖體系中進行轉化,而研究表明,不同的緩沖體系及其離子強度對GABA產量也有較大影響,張暉等研究發現PBS緩沖體系比MES緩沖體系中 GABA的產量高 28%[4];谷氨酸鈉(MSG)相對谷氨酸溶解性好,價格低廉,且對發芽糙米富集GABA效果更佳。因此,本實驗采用谷氨酸鈉(MSG)替代谷氨酸添加到PBS緩沖溶液中制成營養液培養糙米發芽。根據單因素結果,用 Box-Behnken響應面分析法對營養液培養糙米發芽富集GABA工藝條件進行優化,以期為糙米發芽富集GABA提供理論依據。
1 材料與方法
1.1 材料與儀器
供試糙米 中稻股份有限公司,品種為遼星1號;GABA標準品 Sigma公司;谷氨酸鈉(味精,谷氨酸鈉>99%,無鹽)中外合資武漢味全食品有限公司;次氯酸鈉,分析純,有效氯為9% 廣東汕頭市西隴化工廠;重蒸苯酚,分析純 武漢天源生物技術有限公司;磷酸氫二鈉、磷酸二氫鉀、硼砂、硼酸和無水乙醇均為分析純 國藥集團化學試劑有限公司。
HH.B11-500電熱恒溫培養箱 上海躍進醫療器械廠;HH-601A超級恒溫水浴鍋 江蘇省金壇市醫療儀器廠;SC-279GA海爾冰柜 海爾公司;UV1200型紫外可見分光光度計 上海正慧工貿有限公司;PB-20標準pH計、1245電子天平 北京賽多利斯儀器系統有限公司。
1.2 實驗方法
1.2.1 發芽糙米的制備 發芽糙米的制備工藝流程如下:原料篩選→精選→殺菌→清洗→浸泡→發芽→清洗→干燥→成品。
為了有效控制糙米發芽過程微生物污染,將精選后的糙米用1.0%的次氯酸鈉溶液浸泡5min(加入量以剛好淹沒糙米為宜,下同[5]),自來水沖洗3遍,加入4倍體積的水,恒溫浸泡。糙米浸泡后從燒杯中取出,用去離子水清洗,均勻地攤于鋪有四層紗布的培養皿中,其中紗布已用營養液潤濕。發芽過程中每隔4h加入1mL營養液并上下翻動糙米,以保證糙米在發芽期間的濕潤狀態并防止種子部分接觸水面積時間較久腐爛發臭,并于一定溫度的培養箱中進行培養發芽。發芽結束后,用去離子水清洗,于55℃烘箱中終止活性,干燥至5h,取出備用。
1.2.2 糙米吸水率的測定 將稱取的糙米分別放入20、25、30、35、40℃的恒溫水浴鍋中浸泡,每隔 2h 測定一次吸水率。糙米吸水率的計算公式如下:

1.2.3 GABA含量的測定 參考姚森[6]的方法并加以改進,取2.5g發芽糙米,加適量蒸餾水研磨勻漿,然后定容至50mL,于30℃水浴中浸提2h,過濾后取濾液 0.5mL,加入 0.2mL 0.2mmol/L硼酸緩沖液(pH9.0),1mL 6g/100mL重蒸苯酚溶液,0.4mL有效氯含量9%的NaClO溶液,充分振蕩,置于沸水浴10min,再立即置于冰水浴中20min并不斷振蕩,待溶液出現藍綠色后,加2mL體積分數60%的乙醇溶液,再次振蕩均勻,靜置后于645nm波長處比色,測定其吸光度值A,通過GABA的標準曲線Y=0.005X-0.032(Y為 GABA的濃度,mg/mL;X為 A645,R2=0.998)求出GABA含量。
1.2.4 單因素實驗 通過發芽溫度、發芽時間、營養液pH及MSG濃度4個因素實驗,研究其對發芽糙米GABA含量的影響。
1.2.5 實驗條件優化 根據單因素實驗結果,以發芽溫度(A)、發芽時間(B)、營養液pH(C)及MSG濃度(D)四個因素與發芽糙米中GABA含量進行響應面實驗設計,優化糙米發芽工藝。根據Box-Behnken的中心組合設計原理[7],通過Design Expert 8.0軟件對實驗數據進行分析,預測糙米發芽的最佳工藝條件。各因素及水平編碼如表1所示。
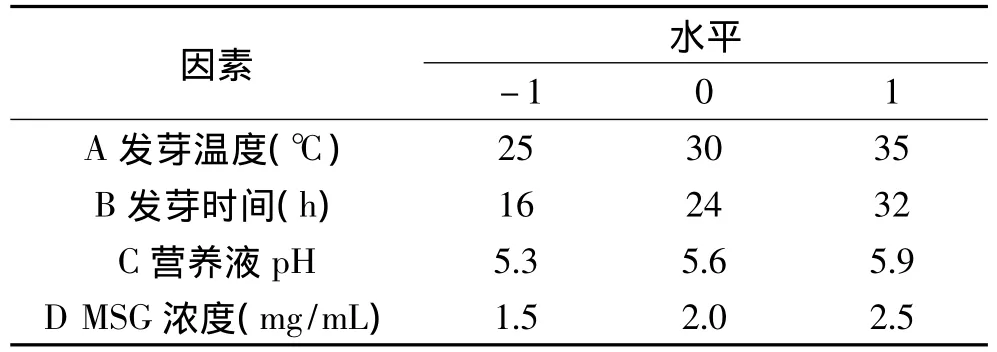
表1 Box-Behnken實驗因素及水平Table 1 Four main induction conditions and their levels for Box-Behnken design
1.2.6 最佳發芽條件的驗證 根據優化實驗結果,采用Design Expert軟件求得回歸方程,以發芽糙米GABA含量最大化為目標,計算得到培養發芽糙米工藝參數和理論含量,將得到的工藝參數修正以便于操作后,進行驗證實驗,評價工藝參數的可靠性。
2 結果與分析
2.1 浸泡溫度和時間對糙米吸水率的影響
糙米浸泡溫度和時間與吸水率的關系見圖1,從圖1中可以看出,浸泡溫度對糙米吸水率有較大的影響。在30、35、40℃三個浸泡溫度條件下糙米吸水率較快。而在20、25℃浸泡條件下,需要較長的浸泡時間才達到一定的吸水率。生產過程中提高溫度有利于縮短浸泡時間,減少營養成分流失,但浸泡溫度也不能過高,過高會導致熱溶性物質流失,或者表層淀粉糊化[8]。實驗發現,在大于30℃條件下浸泡,浸泡的糙米易產生發酵味,對后期培養糙米發芽產品品質有嚴重影響。考慮生產實際,浸泡溫度為30℃比較適宜。
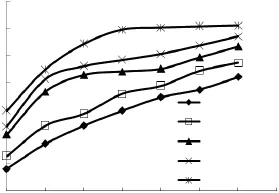
圖1 不同浸泡條件下糙米的吸水率Fig.1 Effect of soaking condition on the water absorbability of brown rice
2.2 單因素實驗結果
2.2.1 發芽溫度對發芽糙米GABA含量的影響 將糙米30℃溫度下浸泡12h,用谷氨酸鈉(MSG)濃度為2.0mg/mL的pH5.6 PBS緩沖溶液(0.05mol/L)作為營養液在不同溫度 20、25、30、35、40℃下培養 24h,其它過程同“1.2.1”,以GABA含量為考察指標。結果如圖2所示。

圖2 發芽溫度對GABA含量的影響Fig.2 Effect of germination temperature on the GABA content
由圖2可看出,在一定溫度范圍內,GABA含量隨發芽溫度升高而升高。在30℃時達到最大值,隨后下降。溫度過高和過低對糙米種子發芽均不利,適宜的溫度是增加營養物質轉化合成GABA的必要條件[9]。本實驗條件下,發芽溫度30℃較為適宜。
2.2.2 發芽時間對發芽糙米GABA含量的影響 將糙米30℃溫度下浸泡12h,用谷氨酸鈉(MSG)濃度為2.0mg/mL的pH5.6 PBS緩沖溶液(0.05mol/L)作為營養液在30℃下分別培養 8、16、24、32、40h,其它過程同“1.2.1”,以GABA含量為考察指標。結果如圖3所示。

圖3 發芽時間對GABA含量的影響Fig.3 Effect of germination time on the GABA content
由圖3可看出,GABA含量在培養過程中呈現先增長后下降的趨勢。24h時達到最大值;24h以后呈下降趨勢。分析其原因可能是隨著培養時間的延長,GABA在轉氨酶的作用下,轉換成琥珀酸半醛,使GABA含量下降[10]。在本實驗條件下,發芽時間24h較為適宜。
2.2.3 營養液pH對發芽糙米GABA含量的影響將糙米 30℃溫度下浸泡 12h,分別用谷氨酸鈉(MSG)濃度為 2.0mg/mL 的 pH5.3、5.6、5.9、6.2、6.5PBS緩沖溶液(0.05mol/L)作為營養液在30℃下培養24h,其它過程同“1.2.1”,以GABA含量為考察指標。結果如圖4所示。
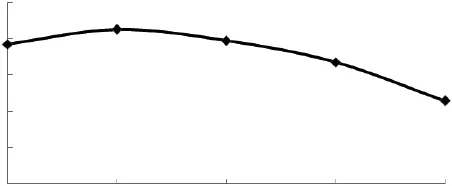
圖4 pH對GABA含量的影響Fig.4 Effect of pH on the GABA content
由圖4可看出,當pH5.6時,發芽糙米中GABA含量最高,這與資料報道相一致[11]。GABA是生物體在逆境條件下緩解細胞酸化對自身毒害作用的產物,其合成途徑為 Glu在 GAD催化條件下形成GABA,弱酸條件能促進GABA的合成[12]。植物組織中GAD的最適pH為5~6,GABA轉氨酶最適pH則為9左右。酸性條件利于形成逆境,從而使發芽糙米中GABA大量積累。當pH>5.6時,隨著營養液pH的繼續增加,GABA的含量呈顯著下降趨勢,這是由于在較高pH環境下GAD活性相對降低,GABA轉氨酶相對增加,從而影響發芽糙米富集GABA。在本實驗條件下,營養液pH5.6較為適宜。
2.2.4 MSG濃度對發芽糙米GABA含量的影響 將糙米30℃溫度下浸泡12h,分別用谷氨酸鈉(MSG)濃度為1.0、1.5、2.0、2.5、3.0mg/mL 的 pH5.6 PBS 緩沖溶液(0.05mol/L)作為營養液在30℃下培養24h,其它過程同“1.2.1”,以GABA含量為考察指標。結果如圖5所示。

圖5 MSG對GABA含量的影響Fig.5 Effect of MSG on the GABA content
由圖5可看出,隨谷氨酸鈉濃度增加,GABA含量呈現上升和下降的趨勢。分析其原因可能是隨著谷氨酸鈉濃度的增加,谷氨酸脫羧酶可利用的底物逐漸增多,當達到2.0mg/mL時,底物與酶達到一個最適比例,隨后濃度的增加造成營養液中離子濃度的增加,從而給細胞壁較大壓力,堵塞營養物質的運輸通道,使營養物質不能自由進出細胞,從而不利于GABA的合成與運送[13]。在本實驗條件下,MSG濃度為2.0mg/mL時較為適宜。
2.3 響應面分析法優化糙米發芽條件結果分析
2.3.1 實驗因素水平編碼與實驗結果 應用Design-Expert 8.0軟件進行Box-Behnken中心組合實驗設計,依次進行浸泡培養發芽,以發芽糙米中GABA含量為響應值(Y),進行響應面實驗,實驗設計及結果如表2所示。
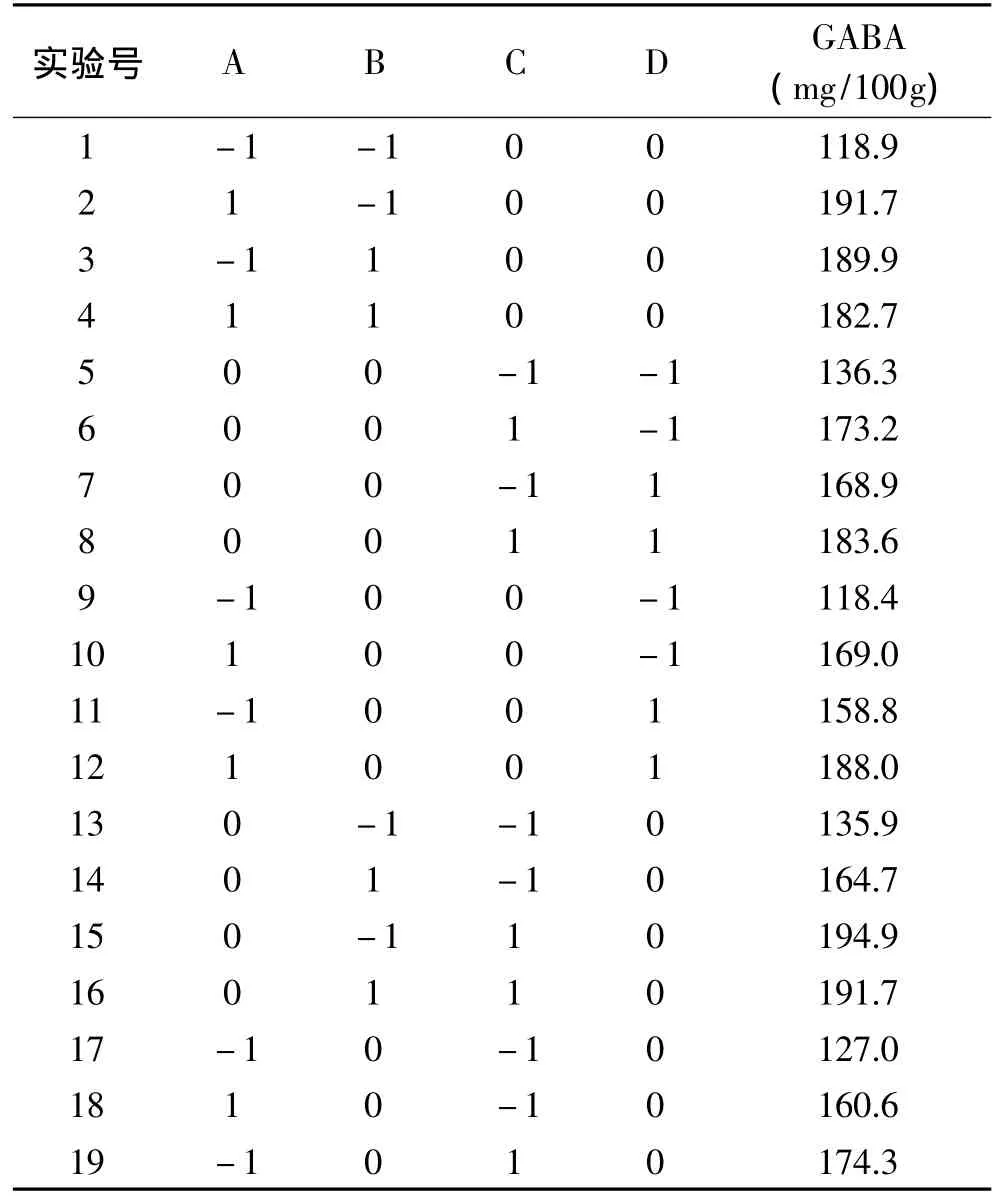
表2 Box-Behnken實驗設計及結果Table 2 Test design and results of Box-Behnken design
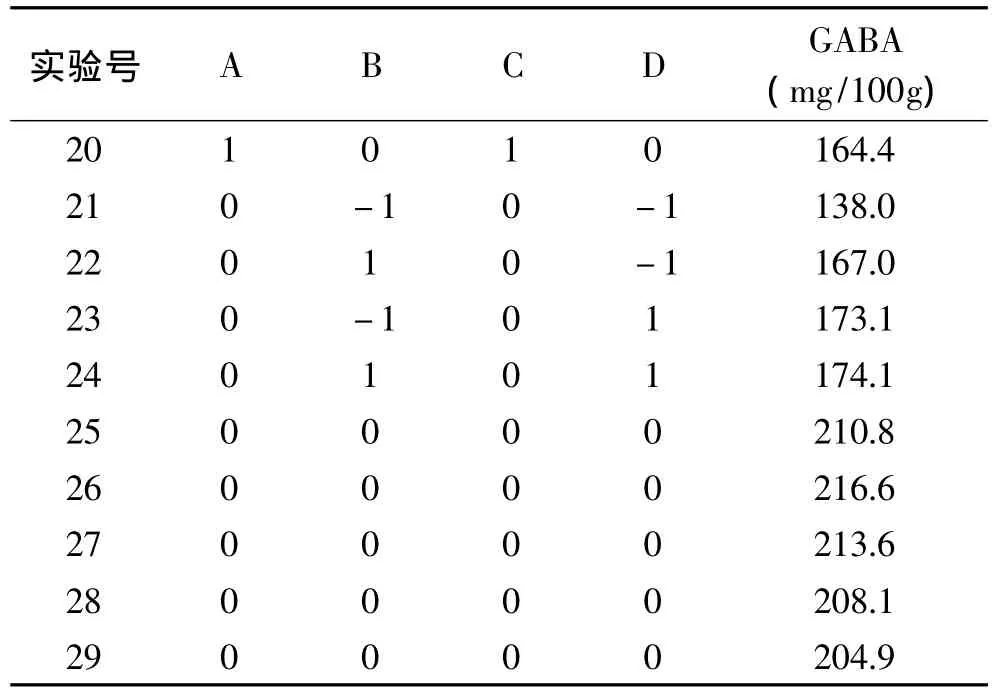
續表
2.3.2 回歸模型的建立及統計分析 根據表2的實驗結果,通過Design Expert 8.0軟件處理確定回歸方程,該實驗的回歸方程為:
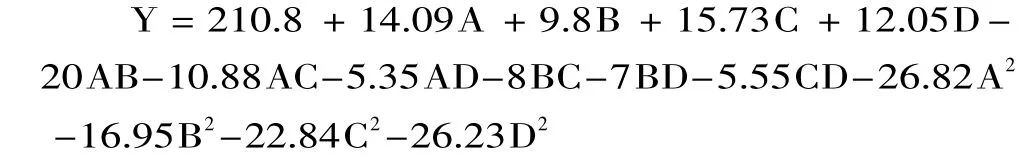
回歸模型進行方差分析及可信度分析結果見表3。
根據α=0.05顯著水平剔除不顯著項,簡化后的回歸方程為:Y=210.8+14.09A+9.8B+15.73C+12.05D-20AB-10.88AC-26.82A2-16.95B2-22.84C2-26.23D2
根據表3可知,該回歸模型顯著(p<0.0001)方程的一次性和二次項的影響都顯著,且交互項AB、AC也顯著,且該模型極顯著(p<0.01),因變量與自變量之間的線性關系顯著(R2=0.9428),模型調整復相關系數=0.9155,說明該模型能解釋91.55%響應值的變化,擬合程度較好。失擬項不顯著(p>0.05),說明本實驗所得二次回歸方程能很好地對響應值進行預測[14]。
2.3.3 響應面因素水平的優化 回歸方程中影響顯著的交互項所做的響應曲面見圖6。
根據回歸方程繪制響應面分析圖,運用Design Expert 8.0軟件對模型進行分析,尋求發芽糙米GABA含量最大值的穩定點及對應的因素水平,由圖6可知,回歸模型存在穩定點,穩定點即極大值點,通過對回歸模型求一階偏導,得到各因素A、B、C、D的編碼值為 0.154、0.100、0.269、0.172,利用編碼公式Xi=(Xj-X0)/Δj將上述編碼值轉變為實際參數為:發芽溫度30.7℃、發芽時間24.8h、營養液pH5.68和MSG濃度2.09mg/mL,此時發芽糙米GABA含量為215.5mg/100g。
2.4 驗證實驗
對最佳工藝條件進行驗證實驗,重復實驗5次,得發芽糙米GABA含量實測值為210.8mg/100g,與理論值215.5mg/100g接近,可以用此模型預測并指導生產實際。
3 結論

表3 回歸方程的統計分析Table 3 Statistical analysis of regression equation
采用Box-Behnken響應面法建立影響因素的二次回歸模型,對數據進行分析,糙米在30℃浸泡12h后,其富集 GABA的最佳工藝條件為發芽溫度30.7℃、發芽時間24.8h、營養液pH5.68和MSG濃度2.09mg/mL。擬合實驗誤差小,可為實際預測和評價發芽糙米GABA含量提供理論依據。

圖6 各兩因素交互作用對GABA含量影響的響應曲面Fig.6 Response surface and contour plots showing the effects of pairwise interactions among various process conditions on the GABA content
[1]Takayo Saikusa,Toshiroh Horino,Yutaka Mori.Accumulation of γ-aminobutyric acid in the rice germ during water soaking[J].Biosci Biotech Biochem,1994,58(12):91-92.
[2]王玉萍,韓永斌,顧振新,等.谷氨酸鈉和抗壞血酸對發芽糙米中GABA富集效果的影響[J].南京農業大學學報,2006,29(2):94-97.
[3]Aurisano N,Bertani A,Reggiani R.Anaerobic accumulation of γ-aminobutyric in rice seedlings:Causes and Significance[J].Phytochemistry,1995,38(5):1147-1150.
[4]姚森.高γ-氨基丁酸含量的發芽糙米品種篩選及應用[D].武漢:華中農業大學,2008.
[5]孟祥勇.糙米、大豆發芽富集γ-氨基丁酸及復合谷物飲料的研究[D].無錫:江南大學,2009.
[6]姚森,鄭理,趙思明,等.發芽條件對發芽糙米中γ-氨基丁酸含量的影響[J].農業工程學報,2006,22(12):211-215.
[7]JOSHI S,YADAV S,DESAI AJ.Application of responsesurface methodology to evaluate the optimum medium components for the enhanced production of lichenysin by Bacillus licheniformis R2[J].Biochemical Engineering Journal,2008,41(2):122-127.
[8]張群,單楊.糙米浸泡過程中γ-氨基丁酸的變化[J].糧食與飼料工業,2006(11):6-8.
[9]李冰冰,王玉萍,顧振新,等.發芽糙米與稻谷的谷氨酸脫梭酶活力及 γ-氨基丁酸含量比較[J].食品與發酵工業,2006,2(5):28-30.
[10]張暉.米胚芽谷氨酸脫羧酶性質及其富集γ-氨基丁酸研究[D].無錫:江南大學,2004.
[11]Wallance W,Secor J,Schrader LE.Rapid accumulation of γ-aminobutyric acid and alanine in soybean leaves in response to an abrupt transfer to lower temperature,darkness or mechanical manipulation[J].Plant Physiol,1984,75:170-175.
[12]蔣振輝,顧振新.高等植物體內γ-氨基丁酸合成、代謝及生理作用[J].植物生理學通訊,2003,39(3):249-255.
[13]韓永斌,顧振新,蔣振輝.Ca2+浸泡處理對發芽糙米生理指標和 GABA等物質含量的影響[J].食品科學,2006,27(10):26-27.
[14]吳竹青,陳景,黃群,等.響應面法優化雪蓮果酒發酵工藝[J].食品科學,2010,31(23):182-187.

