急診介入治療在胰腺疾病外科術后大出血中的應用研究
王志軍 王茂強 宋鵬 段峰 劉鳳永 劉志偉 樊慶勝 田利
王志軍, 王茂強, 宋鵬, 等. 急診介入治療在胰腺疾病外科術后大出血中的應用研究[J/CD].中華介入放射學電子雜志,2013, 1(2): 92-98.
隨著外科手術技術及術后處理的不斷進步,胰腺外科手術、尤其是胰十二指腸切除術(pancreatoduodenectomy,PDT)的病死率已明顯降低(<5%);但手術并發癥的發生率仍較高(18%~52%),其中術后出血率為5%~15%,如不能及時恰當處理,病死率高達50%[1-3]。筆者總結應用介入技術治療20 例胰腺外科手術后大出血的患者,重點探討介入治療方法的安全性、療效和介入技術問題。
對象與方法
一、一般資料
2005 年7 月—2008 年7 月20 例因胰腺疾病外科術后出現大出血的患者在我院行急診介入治療。其中男性12 例,女性8 例;年齡40~75 歲(中位年齡56 歲)。其中6 例十二指腸腺癌、3 例膽管癌及5 例胰腺癌分別行胃-十二指腸切除術(Whipple,其中Child 法9 例、保留幽門的胃-十二指腸切除術5 例);2 例胰腺癌行剖腹探查+胰腺腫瘤穿刺活檢術;3 例急性重癥胰腺炎行剖腹探查+壞死感染組織清除術;1 例胰腺癌行剖腹探查+局部射頻消融術。
二、臨床表現及輔助檢查
20 例患者于術后6 h 至60 d 出現突發性大出血。早期出血者 8 例(≤5 d )、延遲出血者12 例(>5 d )。腹腔出血者10 例、消化道出血者7 例(上腹痛、黑便、便血5 例,胃管引流血性液體2 例)、腹腔合并消化道出血者3 例。單純出血者10 例、出血合并腹腔感染者6 例,出血合并腹腔感染、胰瘺者4 例。
20 例患者急診行介入診療時,均有不同程度的失血性休克表現,如面色蒼白、呼吸急促、心率快,生命體征不穩,血氧飽和度下降到89%~92%。急診血常規檢測:血紅蛋白(HGB)測定為60~80 g/L。經輸血、升壓、大量補液等措施治療,生命體征仍不平穩,內科止血效果差。合并胰瘺患者胰腺斷端引流液淀粉酶23 300~44 224 U/L,合并腹腔感染患者白細胞(9.15~14.00)×109/L、白蛋白為28~36 g/L,其他肝功能指標、血清淀粉酶、脂肪酶均在正常范圍內。3 例術前CT 或MRI 檢查提示假性動脈瘤形成,其余17 例因出血性休克癥狀明顯,未行其他輔助檢查,在簽署了由本院倫理委員會批準的患者家屬知情同意書后,直接行急診血管造影檢查和介入治療。
三、介入治療方法
1. 血管造影:常規行腹主動脈、選擇性腹腔動脈造影、腸系膜上動脈造影、腸系膜下動脈造影。如不能明確出血部位,可酌情采用不同斜位和多角度體位攝影,或進行超選擇性插管造影:脾動脈、胃-十二指腸動脈、肝動脈、胰腺動脈、腸系膜動脈分支等;動脈造影同時進行間接法門靜脈-腸系膜靜脈造影,觀察有無靜脈曲張、靜脈狹窄或阻塞。
2. 介入治療技術
(1)血管內栓塞術:完成造影確認為出血動脈后,將3 F 微型導管(Renegade,Boston Scientif ic Corp,U S A)超選擇插至出血動脈遠端,近端充分栓塞曠置靶血管,栓塞后造影復查確認靶血管是否完全閉塞。完全閉塞靶血管后,積極尋找及栓塞潛在的可疑側支動脈。對血管造影未發現明確活動性出血但顯示血管結構異常的患者,與外科手術醫師溝通后,對高度可疑的出血動脈在栓塞后不影響臟器主要功能的情況下,采用經驗性栓塞。常用栓塞劑用鋼絲圈(直徑3~6 mm),如不能徹底閉塞靶血管則聯合明膠海綿碎粒進行栓塞;靶血管有多支細小分支參與供血時,聯合大顆粒PVA(聚乙烯醇顆粒,700~1000 μm,美國Cook 公司產品),以加強栓塞效果。對結腸中動脈及胰背、胰大、胰尾動脈,以鋼圈為主。肝總動脈-肝固有動脈、胰-十二指腸下動脈、脾動脈主干、胃-十二指腸動脈、胃-十二指腸動脈-肝固有動脈、肝右動脈、胃網膜右動脈等以鋼圈栓塞為主,聯合少量明膠海綿碎粒。
(2)覆膜支架置入術:1 例因脾動脈破裂栓塞成功止血20 d 后再次出血,造影顯示肝動脈破裂出血,門靜脈主干狹窄。為確保肝功能行覆膜支架置入術,依次成功置入覆膜支架3 個(3.0 mm×
16.0 mm,3.5 mm×19.0 mm,3.5 mm×19.0 mm,JOSTENT Graft Master,德國Abbott 公司產品),支架遠端位于肝固有動脈主干遠側、近段被覆部分腹腔動脈干。
(3)動脈內局部灌注垂體后葉素:1 例患者造影發現假性動脈瘤由胰-十二指腸下動脈及空腸第1、2 支供血,在栓塞完胰-十二腸下動脈分支后通過4F 普通導管于腸系膜上動脈分支至空腸第1、2 支供血開口處緩慢推入加壓素3 U(時間約20 min),治療后復查造影,異常血管消失。
3.術后常規進行抗感染、止血、補液等治療:支架植入后常規進行低分子肝素(2 500 U,1次/12 h ),持續用5 d,活化部分凝血活酶時間維持在正常參考值范圍內。術后定期復查血常規、肝功能、血淀粉酶等指標。
四、統計學分析
采用SPSS 17.0 統計軟件進行分析,定量資料采用t檢驗。
結 果
一、血管造影表現
20 例血管造影患者中,19 例可見明確活動性出血或假性動脈瘤形成,1 例血管造影雖然陰性,但相關血管結構異常。19 例血管造影陽性患者中,17 例行首次造影即明確了出血部位,另2 例首次造影均為陰性,1 例保留導管等再次出血時立即行血管造影而發現出血動脈(圖1~4),1 例通過調整引流管位置誘發出血,隨即造影發現出血的血管(圖5~6)。19 例術后出血部位的直接參與供血動脈數共27 支,13 例假性動脈瘤來源于多支(2 支或2 支以上)血管參與供血(圖1~4)。其中脾動脈及其胰腺分支出血占30.00%(9 支,圖1~4,圖7~12);胃-十二指腸動脈出血占18.52%(5 支);胰-十二指腸下動脈占14.81%(4 支);肝總動脈(圖7~8)、肝中動脈、肝右動脈、肝左動脈、第1~2 支空腸動脈、結腸中動脈、胃網膜固有動脈各占10.0%。
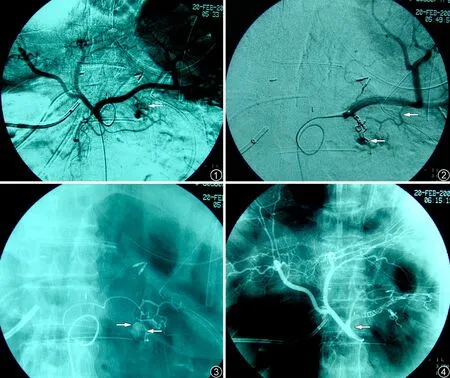
圖1~4 患者,男,67 歲。胰腺癌Whipple 術后第9 天,胃引流管大出血。圖1 為腹腔動脈造影,顯示胰大動脈分支紊亂,管壁結構不清楚,可見多個(4 個)不規則小囊狀結構、對比劑向周圍彌散,為小假性動脈瘤形成、破裂(箭頭所示)。圖2、3 為胰大動脈栓塞后脾動脈造影,顯示殘留假性動脈瘤,超選擇胰尾動脈造影確認其參與供血(箭頭所示)。圖4 為栓塞胰大、胰尾、胰背、脾動脈主干后造影,顯示脾動脈主干及上述3 支動脈完全閉塞,假性動脈瘤消失(箭頭所示)
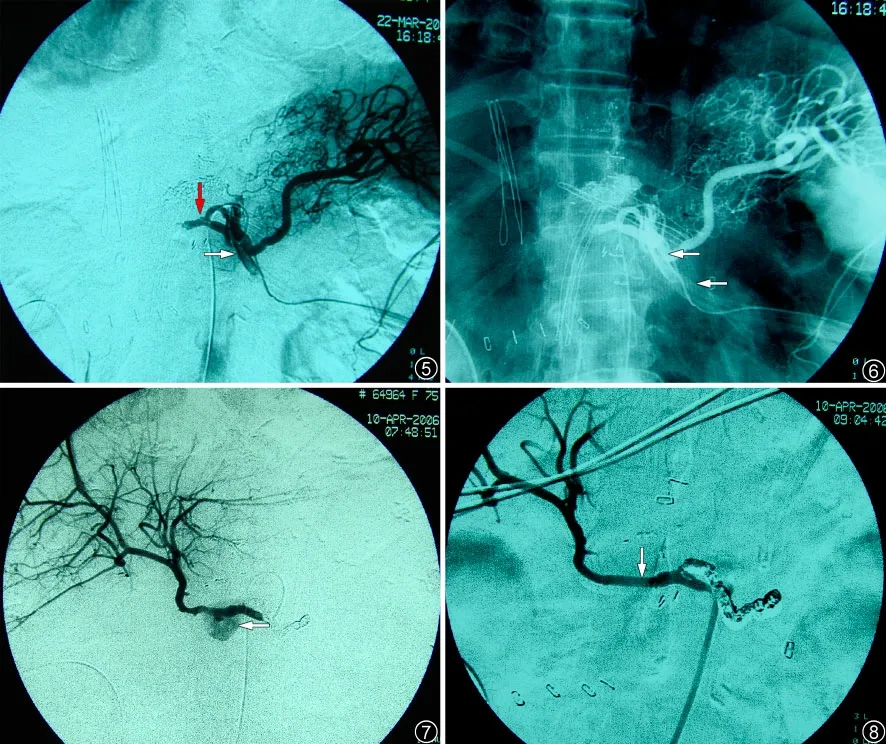
圖5~8 患者,女,75 歲。胰腺癌Whipple 術后出現間斷引流管大出血。2 次造影(間隔5 h)均未發現出血部位,將球囊放置于腹腔動脈干,試圖作為應急措施,但發生肝動脈血栓、閉塞;介入術中調整出血引流管、吸引血塊時發生大出血,經第3 次造影方確認為脾動脈近段破裂,行脾動脈主干栓塞。術后18 d 再次出現大出血。圖5、6 為血管造影,顯示肝固有動脈完全閉塞、脾動脈主干近段狹窄處有“噴射”狀對比劑外溢,直接流入左上腹區引流管。圖5 紅色箭頭示閉塞肝固有動脈,白色箭頭示外溢對比劑;圖6 箭頭示引流管;圖7 示肝總動脈中段一處破口和巨大囊狀結構,對比劑向周圍彌散,為巨大假性動脈瘤合并活動性出血表現(箭頭所示)。圖8 為肝總動脈支架置入后造影,顯示管腔內血流通常,假性動脈瘤消失(箭頭所示)
造影表現:①單純假性動脈瘤形成13 例(13/20,65.00%),表現為出血動脈處囊狀血管結構,對比劑滯留、延遲消失(圖9~12)。合并動脈瘤破裂者3 例(3/20,15.00%),可見對比劑彌散至腹腔、胃腸道、膽管、胰管及引流管等(圖5~6)。②對比劑外溢(活動性出血表現)3 例(3/20,15.00%)。③非特異性異常表現,1 例除有對比劑外溢外,其腸系膜上動脈近段管腔輕度變窄,第1~2 支空腸動脈末梢分支血管走行紊亂,腸壁染色明顯。血管受壓移位、局部血管分支增多、紊亂。④首次血管造影陰性的3 例中,2 例未見明確異常發現,另1 例雖然造影陰性,但其肝固有動脈-肝總動脈管壁不規則、分支紊亂。
二、血管內介入療效
1.介入治療情況:20 例患者共行27 次介入治療,介入治療成功率90.00%(18/20)。18 例單純行血管內栓塞者,16 例一次介入治療成功,血管造影復查示上述異常血管結構消失,無對比劑外溢;其余2 例因栓塞后側支再通而再出血(10.00%),行第2 次介入栓塞治療后1 例出血停止,1 例術后仍出血。介入手術過程順利,未出現技術相關性并發癥。
2. 臨床改善情況:20 例中18 例介入止血成功,20 例中2 例介入治療術后次日死亡(應激性潰瘍大出血);18 例介入治療止血成功者,術后經給予補充血容量、輸血等對癥處理后,胃引流管及腹腔引流管的引流液均逐步恢復正常。心率、血壓等基本生命體征逐步恢復穩定。4 例行肝總動脈、肝固有動脈及肝動脈分支栓塞者,與術前比較,術后第3 天天冬氨酸氨基轉移酶均明顯升高[P=0.001;介入前:(24.050±7.084)U/L,介入后(112.600±54.700)U/L],至第7~10 天降至正常,其他指標白蛋白、直接膽紅素和總膽紅素,谷丙氨酸氨基轉移酶較術前無明顯變化。5 例行胰腺分支栓塞及胰-十二指腸下動脈分支栓塞者,未出現壞死性胰腺炎臨床表現,血淀粉酶在正常范圍內。2 例行結腸中動脈栓塞及胃網膜右動脈栓塞者未出現腸壞死、穿孔表現。
在隨訪過程中,20 例中2 例因介入治療次日出現應激性潰瘍大出血死亡,18 例介入治療成功者,有2 例首次介入治療成功但在術后2 周死亡,死因為反復腹腔感染伴胰瘺,誘發反復大出血、失血性休克、多臟器功能衰竭。其余16 例隨訪2 周至24 個月,未再出現大出血。
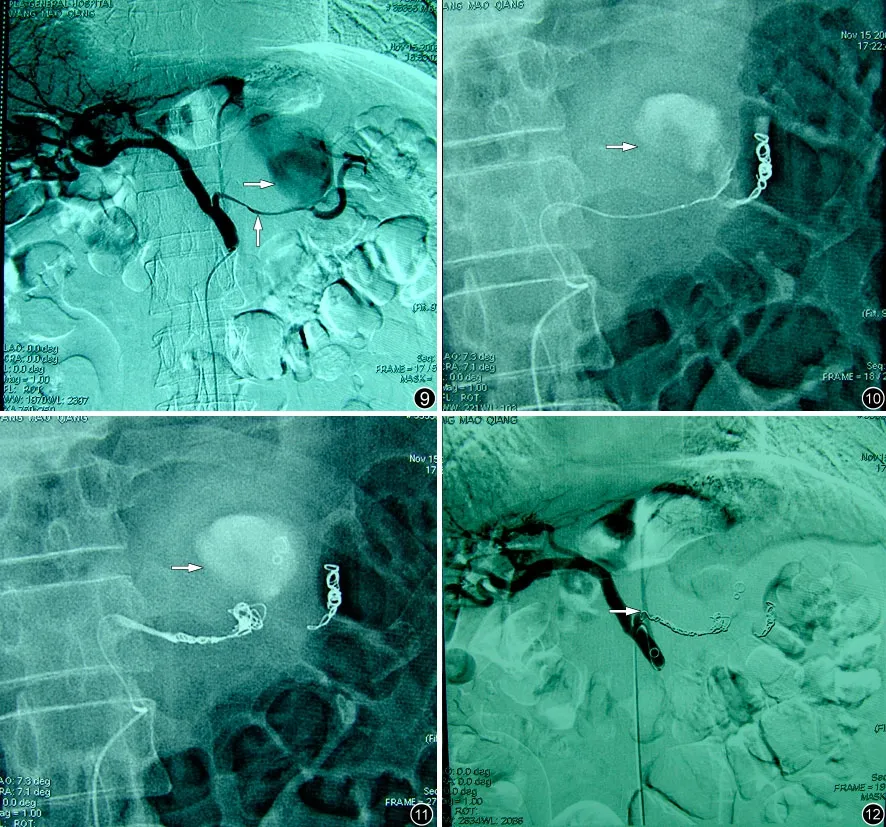
圖9~12 患者,男,64 歲。胰腺癌(尾部)射頻治療后2 周,發生胰周引流管出血。圖9 造影顯示脾動脈主干纖細,中段可見巨大不規則囊狀結構、為假性動脈瘤形成(箭頭所示);圖10、11 示:將微導管分別超選擇插入假性動脈瘤遠端、近端進行栓塞(箭頭所示)。圖12 為假性動脈栓塞后造影,顯示脾動脈完全閉塞,動脈瘤消失
討 論
一、胰腺外科術后大出血的臨床特征
術后出血是胰腺疾病外科術后的主要并發癥之一。一旦出血,多合并失血性休克,病情危、重、急,死亡率高,臨床處理較為棘手;準確判斷出血部位、及時選擇有效治療方法極為關鍵[2-7]。出血按部位分為消化道出血和腹腔內出血兩大類。消化道出血可來源于吻合口出血、應急性潰瘍出血和消化道外出血。腹腔內出血常見原因包括外科技術因素、術后并發癥引起(如胰瘺、感染等)、彌漫性血管內凝血、肝功能障礙所致的凝血機能低下及留置的引流管機械性磨擦鄰近的血管,造成破裂出血。外科技術因素,如胃-十二指腸動脈結扎不徹底,是導致術后早期出血的主要因素,多發生于術后24~48 h。而術后并發癥,如胰瘺、腹腔感染等,為引起術后延遲出血的主要因素,多發生在術后2 周以內(術后5~16 d )。在大出血前6 h~10 d,部分患者往往有不適主訴或“前哨出血(少量出血表現)”,此時行腹部超聲、增強CT 或MRI 檢查,有助于發現出血部位,及時處理有助于降低大出血致死率[7-9]。本組出血動脈以脾動脈及其胰腺分支出血的比例較高,其次是胃-十二指腸動脈、胰-十二指腸下動脈等其他動脈出血,考慮與術后合并癥(胰瘺、腹腔感染)侵蝕不同血管有關,對出血的解剖定位具有一定的臨床意義。
外科手術曾是治療胰腺術后大出血的主要手段,對早期大血管破裂出血具有一定的療效,然而再次外科手術止血難度較大、風險高,尤其解剖位置較深的出血小動脈及在腹腔粘連明顯時,則更難以進入出血區域。與外科手術相比,介入治療方法具有安全性較高、創傷小、可明確出血部位及采取及時有效的止血方法的優點,近年已逐步成為胰腺外科術后大出血的急診止血方法之一,對于有外科手術禁忌證或手術風險較高的患者更是首選的治療方法[7-10]。
二、胰腺外科術后大出血的介入治療技術
血管內介入止血技術主要包括:血管內覆膜支架植入、血管內栓塞、局部注入血管內加壓素、球囊導管暫時性阻斷等[10-15]。覆膜支架置入,一般用于直徑大于6 mm 的血管,優點在于保留組織的正常血供,但不適合于走行迂曲的血管。血管內栓塞術通過對出血動脈的近端、遠端及側支血管的栓塞,可有效止血,但往往有導致部分組織壞死的風險。局部動脈內灌注加壓素,一般用于不適合覆膜支架植入、動脈栓塞的彌漫性末梢血管出血。球囊導管暫時性阻斷,一般用于暫時性阻斷血流的患者。選擇何種方法取決于出血部位的位置、所在部位的臟器功能、參與動脈瘤的動脈血供,對于復雜性出血一般需選擇1 種或2 種介入治療技術。
術后出血中部分患者常合并或單純為假性動脈瘤,文獻報道假性動脈瘤的發生率為0.9%~20.9%,本組患者為65.00%(13/20),顯示其在胰腺疾病術后出血中并不少見,其形成多與胰瘺、腹腔感染有關,一般出現在術后7~30 d 。綜合文獻報道和筆者有限的經驗,處理假性動脈瘤時應注意以下幾點[6-7,15-17]:①假性動脈瘤瘤壁薄,隨時可能破裂,且往往是出血時血管造影的惟一表現,因此一旦發現應及時處理;②由于腹腔內臟血管之間相互聯系交通,多支動脈血管參與瘤體供血的可能性增大,如本組20 例患者中就有4 例假性動脈瘤由2 支或2 支以上動脈參與其供血。因此,充分栓塞出血動脈后尋找并栓塞相 關側支血管,對于徹底止血具有重要意義。即使支架植入術后造影血流通暢,仍應考慮潛在的側支血管存在的可能性;③栓塞后應常規進行血管造影、術后增強CT 復查,可有助于判斷是否完全栓塞或潛在的側支存在;④常用栓塞材料以鋼絲圈為主,可聯合少量PVA(聚乙烯醇)顆粒、明膠海綿碎粒、組織膠(NBCA)、自體血栓等。具體選擇何種材料,可根據病變類型和個人習慣選用。
三、胰腺外科術后大出血的并發癥及臨床預后
介入術后并發癥包括介入技術本身導致的并發癥及栓塞部位的組織缺血、壞死導致的并發癥[6,8-10]。本組患者4 例行肝固有動脈栓塞的肝功能出現一過性損傷,多可耐受,至第7~10 天即降至正常,20 例患者中未出現與介入技術相關的并發癥及嚴重的栓塞后并發癥,介入治療安全性高。然而,介入止血后因2 例合并腹腔感染、胰瘺者于首次成功栓塞后2 周再次出現反復大出血,最終因失血性休克、多器官功能衰竭死亡,提示我們胰腺外科手術后大出血介入止血成功后,應加強對原發病,尤其是胰瘺、腹腔感染的治療與控制,對于提高遠期療效、減少再出血具有重要意義[1-2]。在20 例患者中雖有18 例止血成功,但有1 例患者第2 次介入治療后仍出血不止,筆者分析可能原因如下:①該患者反復出血致凝血功能下降,故單純機械性栓塞后難以局部形成血栓,影響栓塞效果。②局部動脈出血合并應激性潰瘍出血,后者可表現為彌漫性滲血。因此介入治療可有效控制前者出血,但對后者療效有限。
1 Jagad RB, Koshariya M, Kawamoto J, et al. Postoperative hemorrhage after major pancrea-tobiliary surgery: an update.Hepatogastroenterology, 2008, 55(82-83):729-737.
2 Santoro R, Carlini M, Carboni F. Delayed massive arterial hemorrhage after pancreaticoduodenectomy for cancer.Management of a lifethreatening complication. Hepatogastroenterology. 2003, 50(54):2199-2204.
3 Choi SH, Moon HJ, Heo JS, et al. Delayed hemorrhage after pancreaticoduodenectomy.J Am Coll Surg, 2004; 199(2): 186-191.
4 Yoon YS, Kim SW, Her KH, et al. Management of postoperative hemorrhage after pancreatoduodenectomy. Hepatogastroenterology,2003, 50(54): 2208-2212.
5 Nosher JL, Chung J, Brevetti LS, et al. Visceral and renal artery aneurysms: a pictorial essay on endovascular therapy.RadioGraphics,2006, 26(6):1687-1704.
6 Harvey J, Dardik H, Impeduglia T, et al. Endovascular management of hepatic artery pseudoaneurysm hemorrhage complicating pancreaticoduodenectomy. J Vasc Surg, 2006,43(3):613-617.
7 Narumi S, Hakamda K, Toyoki Y, et al. Endovascular treatment of life-threaten-ing pseudoaneurysm of the hepatic artery after pancreaticoduodenectomy. Hepatogastroenterology, 2007, 54(79):2152-2154.
8 Makowiec F, Riediger H, Euringer W, et al. Management of delayed visceral arterial bleeding after pancreatic head resection. J Gastrointest Surg, 2005, 9(9): 1293-1299.
9 Fujii Y, Shimada H, Endo I, et al. Management of massive arterial hemorrhage after pancreatobiliary surgery: does embolotherapy contribute to successful outcome? J Gastrointest Surg, 2007, 11(4): 432-438.
10 Stoupis C, Ludwig K, Inderbitzin D, et al. Stent grafting of acute hepatic artery bleeding following pancreatic head resection. Eur Radiol, 2007,17(2): 401-408.
11 Hyare H, Desigan S, Brookes JA, et al. Endovascular management of major arterial hemorrhage as a complication of inf lammatory pancreatic disease. J Vasc Interv Radiol, 2007, 18(5): 591-596.
12 Lagana D, Carrafiello G, Mangini M, et al. Multimodal approach to endovascular treatment of visceral artery aneurysms and pseudoaneurysms. Eur J Radiol, 2006, 59(1): 104-111.
13 陳耀庭,許林鋒, 江容堅,等.鋼圈栓塞治療肝動脈假性動脈瘤的臨床觀察.介入放射學雜志, 2007, 16(12): 803-806.
14 李國華,楊衛宏,宋穎妹,等.膽胰術后出血的介入治療.介入放射學雜志, 2006, 15(1): 17-19.
15 Wallace MJ, Choi E, McRae S, et al. Superior mesenteric artery pseudoaneurysm following pancreaticoduodenectomy:manageme nt by endovascular stent-graft placement and transluminal thrombin injection. Cardiovasc Intervent Radiol, 2007, 30(3): 518-522.
16 Iwama Y, Sugimoto K, Zamora CA, et al. Transcatheter embolization of splenic artery pseudoaneurysm rupturing into colon after post-operative pancreatitis. Cardiovasc Intervent Radiol, 2006, 29(1): 133-136.
17 Tulsyan N, Kashyap VS, Greenberg RK, et al. The endovascular management of visceral artery aneurysms and pseudoaneurysms. J Vasc Surg, 2007, 45(2): 276-283.

