膜分離制備紅松松塔多糖的研究
張曜武,馮雪
(青島科技大學 化工學院,山東 青島 266042)
松科植物紅松(Pinus koraiensis Sieb.et Zucc)松塔中含有萜類及多糖等多種重要天然成分[1],藥理研究結果顯示松塔多糖具有調節免疫機能、抑制腫瘤以及抗氧化、抗菌等諸多功效[2],具有良好的應用前景。
與水提醇沉法等多糖制備的傳統方法相比,膜分離制備技術具有許多明顯優勢[3],本研究中嘗試將膜分離技術用于紅松松塔多糖制備,文獻中尚未見有同類工作報道。實驗中重點考察了微濾過程中料液溫度、操作壓力和料液濃度等對膜通量的影響,并通過正交實驗確定了最佳微濾條件;由于多糖的不同分子量組分常呈現不同活性[4],因此本實驗中還采用了不同截留分子量的超濾膜對紅松松塔多糖進行分級制備,獲得了不同分子量的紅松松塔多糖,及其分子量分布的大致規律,以期為后續活性研究和工業化開發提供參考。
1 材料與儀器
1.1 材料
紅松松塔(產地:東北地區)、酚酞指示液、氫氧化鈉、硫酸、苯酚、亞硫酸鈉、酒石酸鉀鈉、3,5-二硝基水楊酸、鹽酸(以上試劑均為分析純)。
1.2 儀器
FA1004N型電子天平(上海精密科學儀器有限公司),SHZ-III式循環水真空泵(上海亞榮生化儀器廠),TGT-16C型臺式高速離心機(上海安亭科學儀器廠),RE-52型旋轉蒸發儀(上海亞榮生化儀器廠),LD-800粉碎機(長沙市岳麓區常宏制藥機械設備廠),電熱鼓風干燥箱(天津市泰斯特儀器有限公司),0.2μm中空纖維微濾膜(天津膜天膜科技股份有限公司),截留分子量分別為6kDa、10kDa、50 kDa、100kDa的中空纖維超濾膜(天津膜天膜科技股份有限公司)。
2 實驗方法與結果
2.1 紅松松塔多糖含量的測定
本實驗采用DNS比色法進行紅松松塔多糖含量測定。
2.1.1 標準曲線繪制
取105℃恒重過的葡萄糖50mg,加適量水溶解,轉移至100mL容量瓶中,稀釋,搖勻,定容,即得葡萄糖對照品溶液(0.5mg/mL)。精密量取0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1mL 的 葡 萄 糖對照品溶液放入10mL具塞試管中,加水使成2mL,分別精密加入DNS顯色液2.5mL混勻,在沸水浴中加熱7min,取出,立即用流冷卻至室溫,加水3mL搖勻,用相應試劑做空白,在490nm測吸光度。以葡萄糖濃度(mg/mL)為橫坐標(濃度0.0000~0.06667mg/mL),以吸光度為縱坐標繪制490nm標準曲線、得出回歸方程標準曲線見圖1。滴,用40%氫氧化鈉溶液調節至微紅色,轉移至50mL容量瓶中,定容即得。
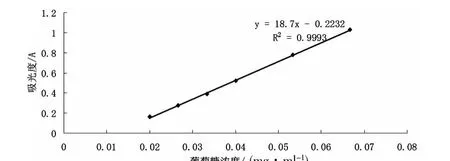
圖1 DNS法標準曲線
(2)單糖溶液的制備。精密量取經過超濾處理的截留液5mL,置于10mL容量瓶中,加酚酞指示液1滴,搖勻,用1%氫氧化鈉溶液調節至微紅色,稀釋、定容即得。
(3)含量測定。取總糖溶液、單糖溶液各2mL,分別精密加入DNS顯色液2.5mL混勻,在沸水浴中加熱7min后,立即用流水冷卻至室溫,加水3mL搖勻,用相應的試劑做空白,在490nm測吸收度A。多糖含量計算公式如下:

式中:n1、n2分別為各自的稀釋倍數。
2.2 紅松松塔多糖微濾制備工藝研究
紅松松塔多糖制備工藝見圖2。首先經過濾等預處理步驟除去提取液中塵埃、粗纖維等雜質,隨后微濾除去膠質等大分子物質,得到含紅松松塔多糖的微濾滲出液,再經超濾除去其中的小分子物質,所得截留液即為濃縮的多糖提取液。膜分離過程中,按照公式J=V/(S·t)計算膜通量,其中t為膜分離時間,h;J為膜通量,L/m2·h;V為t時間內透過液的體積,L;S為有效膜面積,m2。
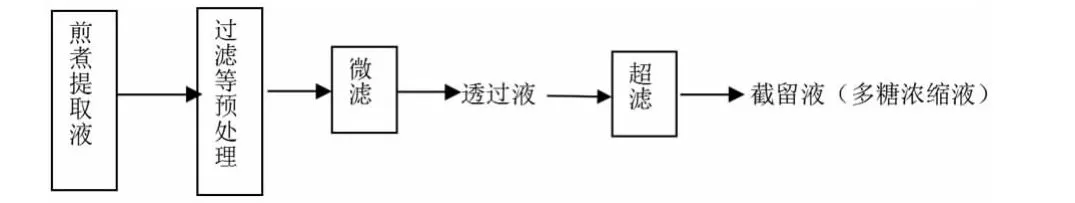
圖2 紅松松塔多糖制備工藝路線
2.2.1 影響微濾效果的主要因素考察
(1)料液濃度對膜通量的影響。在0.08MPa、常溫條件下,將不同濃度的紅松松塔提取液進行微濾處理,料液濃度對膜通量的影響見圖3。
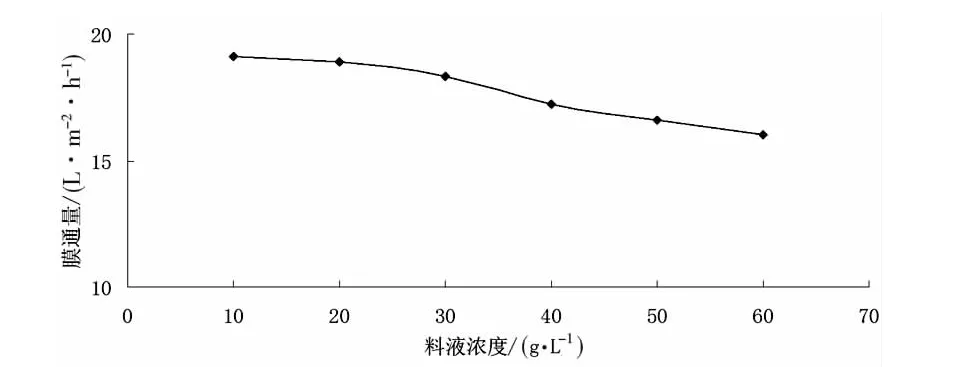
圖3 料液濃度對膜通量的影響
2.1.2 紅松松塔多糖樣品含量測定
(1)總糖溶液的制備。取經過超濾處理的截留液2.5mL,加水2.5mL、6mol/L鹽酸溶液15mL,在沸水浴中加熱30min,用流水冷卻后加酚酞指示液1
由圖3可知,隨著初始料液濃度的增大,膜通量減小。這是因為隨著初始料液濃度的增大,料液粘度增大,導致濃差極化嚴重;此外,初始料液濃度增大,溶質吸附在膜表面,阻塞膜孔,造成通量下降。
(2)操作壓力對膜通量的影響。常溫下對20g/L的紅松松塔多糖提取液進行微濾,壓力對膜通量的影響見圖4。
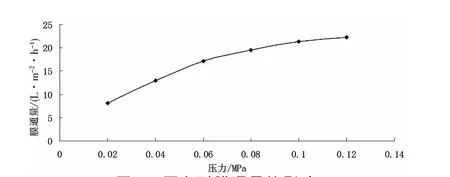
圖4 壓力對膜通量的影響
由圖4可知,隨著壓力的增大,膜通量顯著增大。這是因為壓力增大使得溶液通過濾膜的推動力增大。壓力繼續增大,濃差極化嚴重,使有效的傳質推動力下降導致膜通量增長變緩。
(3)料液溫度對膜通量的影響。在0.08MPa,對20g/L的紅松松塔提取液進行微濾,料液溫度對膜通量的影響見圖5。
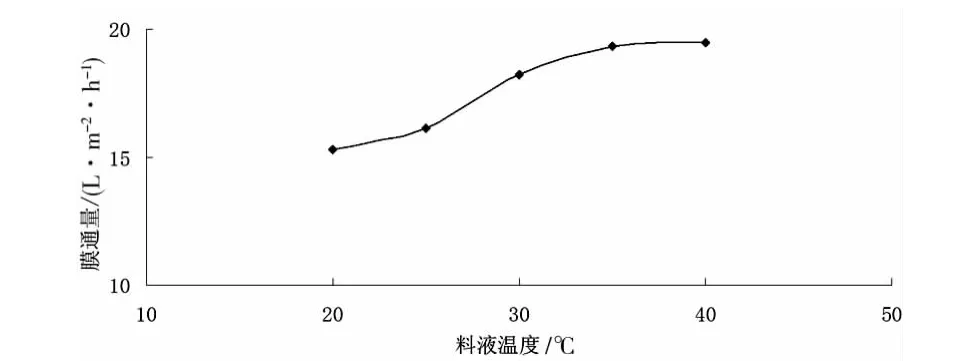
圖5 料液溫度對膜通量的影響
由圖5可知,在一定范圍內,膜通量隨溫度的升高而呈上升趨勢。這是因為升高溫度可使溶液粘度下降、擴散系數增大,而濃差極化減小,故膜通量增大。當溫度升高到一定程度后,膜通量增加趨勢趨于平緩,且溫度過高還會導致濾膜性能和溶液理化性質的改變。
2.2.2 正交實驗優選微濾工藝
采用正交實驗考察料液溫度t、操作壓力MPa、料液濃度C 3個因素對膜通量的影響,每個因素取3個水平,因素水平見表1。本研究選擇L9(34)表,實驗結果見表2。

表1 微濾因素水平表

表2 正交實驗結果
由表2可知,微濾最佳條件為A3B1C3,即料液溫度40℃、料液濃度25g/L、操作壓力0.10MPa。由極差可以得出結論:影響微濾膜通量的主要因素中,操作壓力對膜通量的影響最大,其次為料液濃度,料液溫度對膜通量影響最小。
2.2.3 工藝驗證實驗
按工藝條件A3B1C3進行3組重復實驗,結果見圖6。
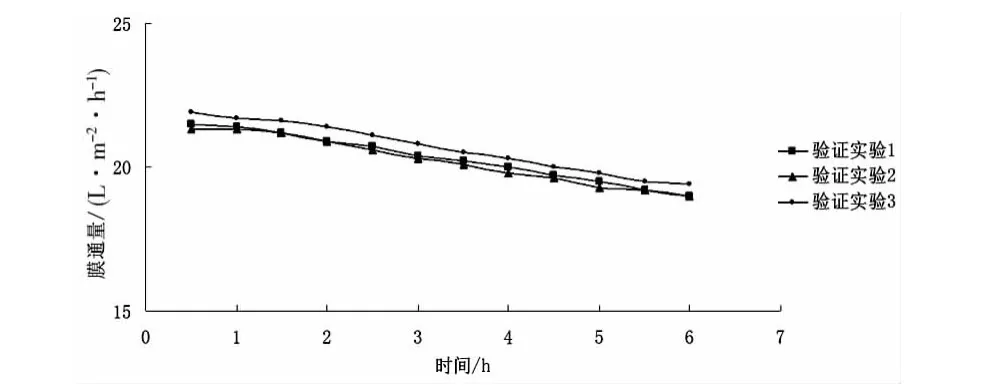
圖6 微濾過程膜通量變化曲線
由圖6可知,該三組實驗中膜通量理想,只有小幅度下降,說明該優化方案合理、可行。
2.3 紅松松塔多糖超濾制備方法及其分子量分布研究
2.3.1 紅松松塔總多糖的制備
將微濾滲出液經截留分子量為6kDa的超濾膜進行分離,所得濃縮液經減壓蒸發得到總多糖固形物,測定其中總多糖含量,實驗結果見表3。

表3 超濾前后總多糖含量對比
由表3可知,超濾純化后的樣品中多糖含量提高了約4倍,純化效果明顯。
2.3.2 不同分子量紅松松塔多糖的制備
在0.10MPa、常溫條件下選用截留分子量分別為100kDa、50kDa、10kDa、6kDa的超濾膜對上述微濾透過液依次進行超濾分離,得到分子量>10萬、5萬~10萬、1萬~5萬、6000~1萬等4段不同組分,測定各段的多糖含量,得出紅松松塔多糖分子量分布結果,見圖7。
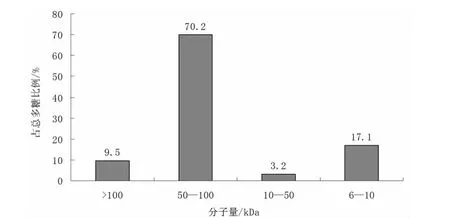
圖7 紅松多糖分子量分布
由圖7可知,分子量>10萬的組分占紅松松塔總多糖的9.5%,5萬~10萬之間的占70.2%,1萬~5萬之間的占3.2%,6000~1萬的占17.1%。
3 結論
以上實結果表明,微濾過程的適宜操作條件為:料液濃度25g/L、操作壓力0.10MPa、料液溫度40℃,其中影響膜通量的主要因素為操作壓力,其次是料液濃度和溫度。微濾滲出液再經截留分子量為6kDa的超濾膜純化后,多糖含量可由7.20%,提高到35.16%,純化效果顯著。
本實驗中還測得紅松松塔多糖分子量分布如下:分子量>10萬的占9.5%,5萬~10萬之間的占70.2%,1萬~5萬之間的占3.2%,6000~1萬的占17.1%,這些不同分子量的各組分樣品正在進行后續活性研究。
[1]Sakagami H,Takeda K,MakinoY,et al.Partial purification of novel differentiation-inducing substances(s)from hot water extract of Japanese pine cone[J].Jep.J.Cancer Res,1986,77(1):59-61.
[2]王智航,張永紅,于婉婷,等.紅松松塔、松子殼研究進展及在畜牧業中應用可行性分析[J].國外畜牧學——豬與禽,2009,29(4):88-89.
[3]葉曉,俞軍,易劍平,等.利用膜法分離姬松茸多糖的研究[J].食品科技,2006(2):44-46.
[4]Misaki A,Kishida E,Kakuta M,et al.Carbohydrate and Carbohydrate Polymers[M].ATL Press.Mount Prospect,Illinois USA,1993:116-129.

