不同熱處理對沙門氏菌DNA消亡的影響
劉 杰,李苗云*,趙改名,柳艷霞,高曉平,田 瑋,黃現青,張秋會
(河南農業大學食品科學技術學院,河南 鄭州 450002)
沙門氏菌廣泛分布于自然界,是腸桿菌科中一種常見、重要的人畜共患病原菌之一,對人類和動物具有極大危害,沙門氏菌污染能使人類發生傷寒、副傷寒、敗血癥、腸胃炎和食物中毒等病癥[1-3]。其中肉、蛋、乳等營養豐富的食品是沙門氏菌的主要傳播介質,直接影響著人們的飲食健康安全[4-5]。近年來,核酸分析被廣泛應用于病原菌的檢測,具有檢測范圍廣、敏感度高、特異性好等優點,大大提高了檢測的效率,縮短了檢測流程,但其存在假陽性偏高等問題[5-9]。魯玉俠等[10]研究了121℃、15min 處理后沙門氏菌的PCR擴增效果,結果顯示PCR產物電泳條帶很明顯。Malorny[11]、Nocker[12]、Oliveira[13]等研究指出死菌DNA會長期存在。另外,很多研究者[14-18]指出死菌DNA的存在使基因水平的檢測方法高估了樣品中活菌的水平。而我國肉類食品有低溫、高溫、涮、煎、烤等多種加工和消費方式,常用的熱處理方式對沙門氏菌致死情況和DNA的破壞程度不是很清楚。本實驗模擬肉品在加工和消費過程中常用的幾種加熱處理過程,以研究不同熱處理對沙門氏菌致死效果以及對沙門氏菌DNA消亡的影響,為肉品消費時的安全性和沙門氏菌檢測技術的研究提供依據。
1 材料與方法
1.1 菌株與試劑
沙門氏菌標準菌株(ASI.1859F3) 雙匯集團技術中心提供。
U N I Q-1 0 柱式細菌基因組抽提試劑盒 生工生物工程(上海)有限公司;2×PCR Solution Premix PrimeSTAR?HS 寶生物工程大連有限公司;平板計數瓊脂培養基 北京路橋技術有限責任公司。
1.2 儀器與設備
HIRAYAMA高壓滅菌鍋 日本Hirayama公司;UVP凝膠成像系統 美國UVP公司;梯度PCR儀 德國Biometra公司;HH-501恒溫水浴鍋 金壇市杰瑞爾電器有限公司;DYY-12型電泳儀 北京六一儀器廠。
1.3 方法
1.3.1 菌株培養
取沙門氏菌標準菌株ASI.1859F3接種到5mL液體LB培養基中。37℃、180r/min振蕩培養14~16h,使菌液達到對數生長期。平板計數得到初始菌濃。
1.3.2 不同熱處理對沙門氏菌存活狀況的影響
模擬肉品在加工和消費過程中常用的熱處理過程,取1mL過夜培養的標準菌液加入到1.5mL PE管中,分別按照65℃保溫20min、85℃保溫30min、沸水浴2min、沸水浴3min、121℃保溫15min進行加熱處理。處理后的菌液進行平板計數,每種處理3個平行。
1.3.3 基因組DNA的提取
取菌液1mL,10000r/min離心1min,棄上清收集菌體,UNIQ-10柱式細菌基因組抽提試劑盒抽提基因組DNA,制備的DNA樣品溶解于50μL TE緩沖液中,保存備用。
1.3.4 熱處理后沙門氏菌不同放置時間對基因組DNA消亡的影響
對不同熱處理后完全失活的組別進行室溫放置,每隔1d取菌液1mL提取基因組DNA,1.5%的瓊脂糖凝膠電泳120V,25min,EB染色后紫外分析儀進行分析。
1.3.5 熱致死后沙門氏菌殘存DNA的PCR擴增
致死后的菌液經過一段時間放置后按1.3.3節方法提取基因組DNA,進行PCR擴增。引物根據已發表的鼠傷寒沙門氏菌特異性inva基因核苷酸序列(GenBank AE008832)設計,上游引物(5’-GTG AAA TAA TCG CCA CGT CGG GCA A-3’);下游引物(5’-TCA TCG CAC CGT CAA AGG AAC C-3’),擴增片段長度為285bp[19]。引物由寶生物工程大連有限公司合成。采用20μL反應體系:2×PCR Solution Premix PrimeSTAR?HS 10μL、1μmol/L Forward Primer 2μL、1μmol/L Reverse Primer 2μL、DNA模板 2μL、dH2O(滅菌蒸餾水)4μL。反應參數:95℃、30s;95℃、5s;64℃、34s進行40個循環,最后72℃延伸2min。取3μL PCR產物進行電泳,并進行紫外光譜分析。
2 結果與分析
2.1 不同加熱處理后對沙門氏菌存活狀況的影響

表 1 不同加熱處理對沙門氏菌的致死情況Table 1 The death status of Salmonella under different heat treatments
從表1可知,所采取的5種熱處理方式均能有效殺死菌液中的沙門氏菌,其中65℃ 20min、85℃ 30min、沸水浴3min、121℃ 15min處理能完全殺死菌液中沙門氏菌,沸水浴2min處理后雖不能完全殺死菌液中的沙門氏菌,但其菌落形態已發生明顯變化,處理前菌落邊緣光滑,呈乳白色圓形菌落,處理后則菌落較小,顏色暗淡,邊緣呈不規則齒狀或放射狀的怪異形態,繼續培養發現菌落生長緩慢。肉品在食用過程中經常會在沸水中短時間處理,如火鍋中常見的“涮”,通常時間較短,對于沙門氏菌沸水中處理2min尚不能將其殺死,需要至少3min以上。因此,在肉品消費過程中,需要提高殺菌時間以提高其安全性。
2.2 致死后沙門氏菌不同放置時間對基因組DNA消亡的影響
經過平板計數后發現,65℃ 20min、85℃ 30min、沸水浴3min、121℃ 15min處理后的沙門氏菌完全失活。對以上4種方式處理的菌液進行室溫放置,每隔1d提取細菌基因組DNA,電泳后進行分析。
2.2.1 65℃、20min處理后電泳結果
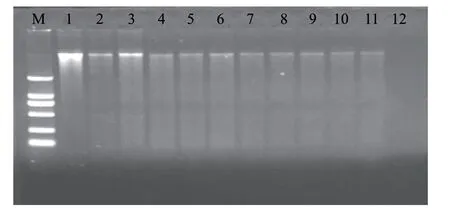
圖 1 65℃、20min處理后沙門氏菌DNA電泳圖譜Fig.1 Electrophoresis results of the DNA from Salmonella subjected to heat treatment at 65 ℃ for 20 min
由圖1可知,與原菌液相比,65℃、20min處理后的菌液DNA的條帶亮度明顯變弱,但仍能看出清晰的條帶。說明65℃、20min處理會破壞部分基因組DNA,影響DNA的提取效果,但不能完全使其降解。隨著放置時間的延長,DNA條帶慢慢變弱,說明致死后的細菌DNA會逐漸降解,但到18d為止,變化并不是很明顯。
2.2.2 85℃、30min處理后電泳結果
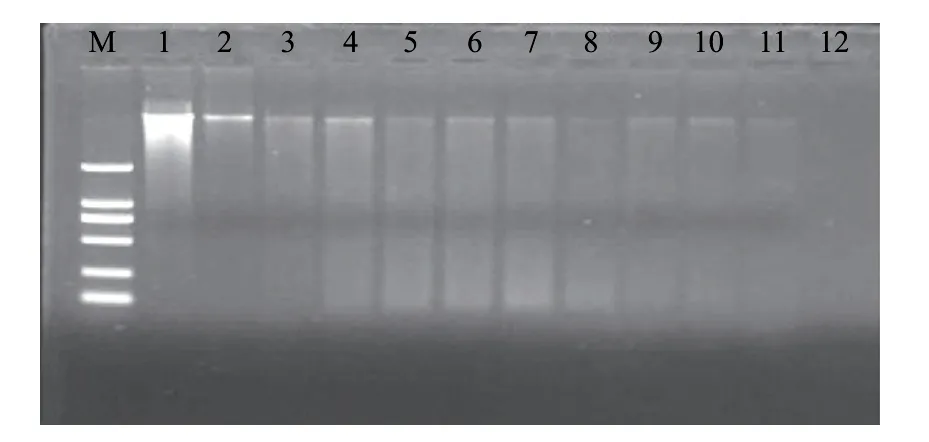
圖 2 85℃、30min處理后沙門氏菌DNA電泳圖譜Fig.2 Electrophoresis results of the DNA from Salmonella subjected to heat treatment at 85 ℃ for 30 min
由圖2可知,與原菌液相比,85℃、30min處理后的菌液DNA的條帶亮度明顯變弱。說明85℃、30min處理會破壞部分基因組DNA,隨著放置時間的延長,DNA條帶逐漸模糊,與65℃、20min處理相比變化更為明顯,說明85℃、30min致死后的細菌DNA降解速度更快,到18d為止,條帶已經很模糊,但仍有完整的基因組DNA存在。
2.2.3 沸水浴3min處理后電泳結果
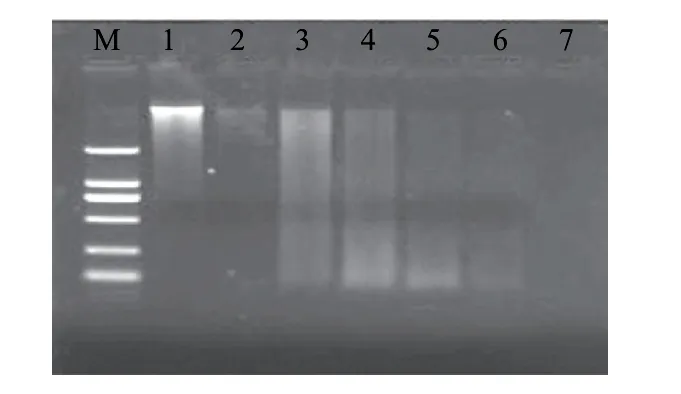
圖 3 沸水浴3min處理后沙門氏菌DNA電泳圖譜Fig.3 Electrophoresis results of the DNA from Salmonella subjected to boiling for 3 min
由圖3可知,沸水浴3min處理后的菌液在放置1、2、4d后可以看到很微弱DNA的條帶,放置6d后條帶消失。這說明沸水浴3min處理對基因組DNA的破壞程度很大,且對DNA提取效果的影響很大。隨著放置時間的延長,DNA降解速度很快,到第6天時基因組DNA已經大部分降解,無可見條帶。
2.2.4 121℃、15min處理后電泳結果
由圖4可知,菌液經過121℃、15min處理后,基因組DNA條帶完全消失。說明121℃、15min處理會嚴重破壞基因組DNA,處理后已經沒有完整的基因組DNA存在。
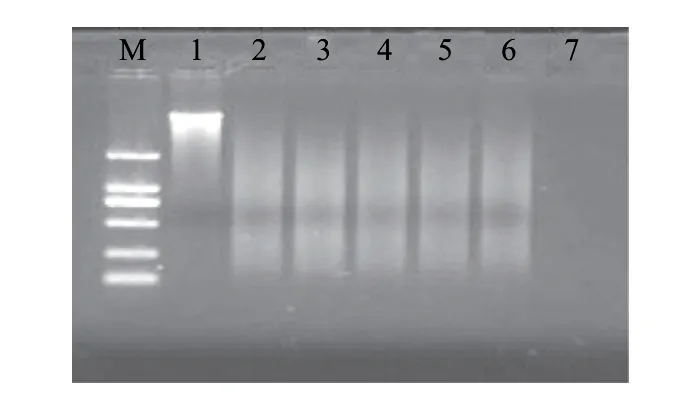
圖 4 121℃、15min處理后沙門氏菌DNA電泳圖譜Fig.4 Electrophoresis results of the DNA from Salmonella subjected to sterilization at 121 ℃ for 15 min
2.2.5 長時間放置后死菌殘存DNA的PCR擴增結果
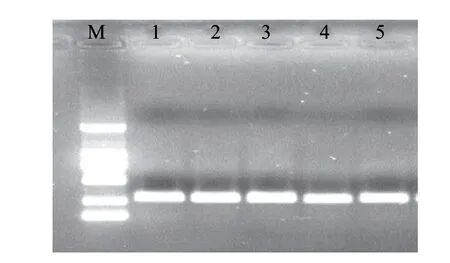
圖 5 長時間放置后死菌殘存DNA的PCR擴增結果Fig.5 PCR amplifi cation of DNA in dead bacilli after long storage period
由圖5可知,沙門氏菌在經過65℃ 20min、85℃ 30min、沸水浴3min、121℃ 15min處理致死并放置相當長一段時間后,其DNA擴增條帶依然很明顯。沸水浴3min和121℃、15min處理后DNA的擴增條帶比65℃、20min和85℃、30min處理后的有些暗淡。這說明雖然DNA電泳條帶已經很模糊或消失,但死亡的細胞中仍存在有大量的目的基因片段存在,且這些基因片段消亡速度很慢,會在很長一段時間內對PCR擴增產生極大的作用。高溫處理對DNA的破壞則更為明顯。
由圖1~5可知,經過不同溫度處理后,完整的基因組DNA會發生不同程度的降解,在經過沸水浴3min和121℃、15min處理后的細胞中已經很少有完整的大分子質量的DNA存在,而是降解為了各種不同大小的基因碎片。沙門氏菌受到較低溫度處理時,其基因組DNA的完整性受到的破壞程度相對較小,但DNA會隨著時間的延長也逐漸降解為分子質量較小的片段。這些片段就包括引起PCR特異性擴增的目的基因片段。這些分子質量相對較小的片段會長期存在于死細胞中并且很不容易消亡,從而對基于DNA技術進行的病原菌檢測等產生干擾作用。沙門氏菌DNA消亡速度與溫度高低和處理的時間長短有關,加熱溫度越高、時間越長,沙門氏菌DNA消亡速度越快。
沙門氏菌是鮮肉及其制品中常見的,也是我國對肉品主要檢測和控制的食源性病原菌之一。肉類食品有多種加工和消費方式,如“涮”、“煎”等,通常時間較短,本實驗研究表明,對于沙門氏菌沸水中處理2min尚不能將其殺死,所以,需要提高殺菌時間以提高其安全性。而目前,PCR等分子技術在病原菌檢測方面的應用越來越多,但從本實驗結果來看,各種加工肉制品在經過不同溫度殺菌以后,雖然肉品中的細菌被滅活,但加熱處理并不能使細菌基因組DNA完全降解消亡,大量的基因片段仍然殘存在死亡的細胞當中,而且消亡速度很慢,尤其在較低溫度處理的肉品中更為明顯,這與死菌DNA會長期存在的研究結果一致[11-13]。121℃、15min處理后沙門氏菌的PCR研究結果與魯玉俠等[10]一致。本實驗結果表明,加熱溫度越高、時間越長,沙門氏菌DNA消亡速度越快,這對于經過不同加工方式處理后的產品,如果應用PCR等技術分析檢測沙門氏菌,會對檢測結果產生很大的干擾作用,直接影響檢測結果的準確性。
3 結 論
肉品在沸水中加熱時至少在3min以上才能使沙門氏菌完全滅活;加熱溫度越高、時間越長,沙門氏菌DNA消亡速度越快;不同溫度加熱后,菌液中仍存在大量的目的基因片段,對應用DNA分析檢測沙門氏菌會產生很大的干擾作用,影響檢測結果的準確性。
[1] TIRADO C, SCHMIDT K. WHO surveillance programme for control of foodborne infections and intoxications, results and trends across greater Europe[J]. Journal of Infection, 2001, 43: 80-84.
[2] WALLACE D J, GILDER T V, SHALLOW S, at al. Incidence of foodborne illnesses reported by the foodborne diseases active surveillance network (foodnet)-1997. foodnetworking group[J]. Journal of Food Protection, 2000, 63: 807-809.
[3] MALORNY B, HOORFAR J, BUNGE C, et al. Multicenter validation of the analytical accuracy of Salmonella PCR: towards an international standard[J]. Applied and Environmental Microbiology, 2003, 69: 290-296.
[4] ZHANG H M, SHI L, GUO S Y, et al. Identification and characterization of class 1 integron resistance gene cassettes among Salmonella strains isolated fromhealthy humans in China[J]. Microbiology and Immunology, 2004, 48(9): 639-645.
[5] MALORNY B, BUNGE C, HELMUTH R. A real-time PCR for the detection of Salmonella enteritidis in poultry meat and consumption eggs[J]. Journal of Microbiological Methods, 2007, 70(2): 245-251.
[6] MINAM H, SRINIVASAN V, GILLESPIE B E, et al. Application of SYBR green real-time PCR assay for specific detection of Salmonella spp. in dairy farm environmental samples[J]. International Journal of Food Microbiology, 2005, 102: 161-171.
[7] KNUT R, BIRGITTEM, SIGNEM D, et al. Use of ethidiummonoazide and PCR in combination for quantification of viable and dead cells in complex samples[J]. Applied and Environmental Microbiology, 2005, 71(2): 1018-1024.
[8] PUSTERLA N, BYRNE B A, HODZIC E, et al. Use of quantitative real-time PCR for the detection of Salmonella spp. in fecal samples from horses at a veterinary teaching hospital[J]. The Veterinary Journal, 2010, 186: 252-255.
[9] PERELLE S, DILASSER F, MALORNY B, et al. Comparison of PCR-ELISA and lightcycler real-time PCR assays for detecting Salmonella spp. in milk and meat samples[J]. Molecular and Cellular Probes, 2004, 18: 409-420.
[10] 魯玉俠, 郭祀遠, 石磊. EMA-LAMP方法快速檢測死/活的食源性沙門氏菌[J]. 食品科學, 2009, 30(22): 324-327.
[11] MALORNY B, TASSIOS P T, COOK N, et al. Standardization of diagnostic PCR for the detection of foodborne pathogens[J]. Food Microbiol, 2003, 83(1): 39-48.
[12] NOCKER A, CHEUNG C Y, CAMPER A K. Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs. dead bacteria by selective removal of DNA from dead cells[J]. Journal of Microbiological Methods, 2006, 67: 310-320.
[13] OLIVEIRA S D, SANTOS L R, SCHUCH D M T, et al. Detection and identification of Salmonella from poultry-related samples by PCR[J]. Veterinary Microbiology, 2002, 87: 25-35.
[14] SEO K H, VALENTIN-BON I E, BRACKETT R E. Detection and enumeration of Salmonella enteritidis in homemade ice creamassociated with outbreak: comparison of conventional and real-time PCR methods[J]. Journal of Food Protection, 2006, 69(3): 639-643.
[15] WOLFFS P, NORLING B, RADSTRFM P. Risk assessment of falsepositive quantitative real-time PCR results in food, due to detection of DNA originating from dead cells[J]. Journal of Microbiological Methods, 2005, 60: 315-323.
[16] NOGVA H, DROMTORP S, NISSEN H, et al. Ethidium monoazide for DNA-based differentiation of viable and dead bacteria by 5V-nuclease PCR[J]. BioTechniques, 2003, 34(4): 804-813.
[17] WHYTE P, GILL K M, COLLINS J, et al. The prevalence and PCR detection of Salmonella contamination in raw poultry[J]. Veterinary Microbiology, 2002, 89: 53-60.
[18] LUO Jianfei, LIN Weitie, GUO Yong. Method to detect only viable cells in microbial ecology[J]. Appl Microbiol Biotechnol, 2010, 86: 377-384.
[19] MALORNY B, HOORFAR J, BUNGE C, et al. Multicenter validation of the analytical accuracy of Salmonella PCR: towards an international standard[J]. Applied and Environmental Microbiology, 2003, 69: 290-296.

