十二烷基苯磺酸鈉暴露對黃顙魚稚魚的遺傳毒性
田海軍,任勝杰,楊鐵柱,楊治國
(1.信陽農林學院水產學院,河南 信陽 464000;2.鹽城工學院海洋與生物工程學院,江蘇 鹽城 224051)
十二烷基苯磺酸鈉(SDBS)因其高效去污性能,較強耐酸堿能力,不受水中的鈣、鎂等離子影響,分散、抗靜電性能優良[1-3],被廣泛應用于工業、農業及日常生活中,隨工農業生產廢水和日常生活污水持續大量地排入水體環境。SDBS 在水環境中自然降解速度慢,且易在水面形成大量積聚不散的泡沫層,影響水體的氧氣交換,使水質惡化,產生生物毒性[4-6]。近年來對凡納濱對蝦(Litopenaeus νannamei)[7]、安氏偽鏢水蚤(Pseudodiaptomus annandalei)[8]、黃河鯉(Cyprinus carpio)[9]、褐點石斑魚(Epinephelus fuscoguttatus)[10]、刺參(Apostichopus japonicus)[11]、雙小核草履蟲(Paramecium primaurelia)[12]、中華倒刺鲃(Spinibarbus sinensis)[13]、尼羅羅非魚(Oreochromis niloticus)[14]等水生動物開展了SDBS的毒性研究,主要集中于SDBS 的急性毒性及高濃度條件下的生理生化的影響,然而實際環境相關濃度下的SDBS對魚類的亞急性毒性效應尤其是遺傳毒性相關研究報道則較少。
魚類尤其是稚魚對水環境變化較為敏感。水環境中殘留的有害物質通常會導致魚類血細胞發生異常,如細胞核的染色體發生畸變,形成微核現象[15-20]。水體有機污染物長期對魚類的暴露可能會誘發DNA 氧化損傷[21-26],研究表明陰離子表面活性劑十二烷基硫酸鈉對草魚的暴露會造成氧化損傷[27]。且在所有DNA 核堿基中鳥苷最易被氧化生成8-羥基脫氧鳥苷(8-OHdG),因此8-羥基脫氧鳥苷成為DNA 氧化損傷的特異性產物[28]。黃顙魚(Pelteobagrus fulνidraco)肉質鮮美深受人們喜愛,是我國的特種經濟養殖魚類之一,開展水環境污染物對黃顙魚生理生化及遺傳毒性的研究具有現實意義。本研究將黃顙魚稚魚暴露于不同質量濃度的SDBS 中,應用微核實驗技術和單細胞凝膠電泳技術測定不同暴露濃度條件下的黃顙魚稚魚的紅細胞微核率和細胞尾部DNA損傷率,測定稚魚組織中8-羥基脫氧鳥苷的含量,以期為黃顙魚的健康養殖提供基礎資料,同時也為科學評估水體環境濃度的SDBS遺傳毒性效應提供依據。
1 材料與方法
1.1 實驗動物
實驗用黃顙魚親本來自湖北省武漢市水產科學研究所,親本雌雄比例為1∶1,雌魚體長(171.3 ±9.0)mm,體質量(101.4 ± 16.5)g;雄魚體長(242.1 ±11.6)mm,體質量(193.4±19.6)g。親本300 尾在學院實訓基地水泥池中流水加曝氣方式培育,設棕櫚產卵巢,巢為半球形(直徑25 cm,深12 cm);培育水溫為(24.5 ± 0.3)℃,pH 為7.0~7.5,溶氧為6.70~9.50 mg/L;光暗周期為12 h:12 h,每日投喂2 次黃顙魚專用飼料。
1.2 主要試劑與儀器
SDBS 為分析純(國藥集團河南化學試劑有限公司)。熒光顯微鏡(Olympus-IX81,日本奧林巴斯),電泳儀(DYCZ-32C,北京六一),高速冷凍離心機(Eppendorf 5424R,德國艾本德),酶標儀(DR200-BC,無錫德朗),8-羥基脫氧鳥苷試劑盒(南京建成生物工程研究所)。
1.3 稚魚暴露實驗
隨機挑選孵化120 h 后發育正常、大小相近的黃顙魚稚魚進行染毒暴露實驗。參考地表水環境質量標準(GB3838-2002)及前期水樣中陰離子表面活性劑檢測數據,設定SDBS 暴露質量濃度為0、0.2、0.4、0.6、0.8 mg/L,每24 h 更換新配制的暴露溶液,以保證濃度恒定。每個濃度處理設置3組平行,暴露實驗容器采用12 孔細胞培養板,每孔放置30尾稚魚。暴露期間水溫保持(24.5±0.3)℃,光暗周期設置為12 h:12 h。暴露96 h 后,進行紅細胞微核實驗和DNA損傷評價。
1.4 稚魚紅細胞微核率測定
每組隨機挑取暴露后的黃顙魚稚魚6尾送實驗室斷尾取外周血常規涂片吉姆薩染色。每組計數5 000 個清晰、完整染色的有核紅細胞,計算微核率[17-20]。
1.5 稚魚全魚細胞DNA損傷評價
每組經SDBS暴露后的8尾稚魚先用0.1 mol/L、pH 7.2 的磷酸鹽緩沖液沖洗,然后將稚魚的全魚制成單細胞懸液;配制好的黃顙魚稚魚單細胞懸液再經過彗星實驗步驟處理后,在熒光顯微鏡下觀察有無彗星及彗尾的長度、亮度、出尾率等[29]。其中裂解時使用的細胞裂解液:2.5 mol/L NaCl,100 mmol/L乙二胺四乙酸二鈉(Na2EDTA),10 mmol/L Tris,質量分數1%肌氨酸鈉,pH=10,用前加入1%體積的Triton X-100、10%體積二甲亞砜。解旋時使用的堿性電泳緩沖液:1 mmol/L Na2EDTA,300 mmol/L NaOH,pH=13。電泳電壓25 Ⅴ,電流300 mA,低溫避光,電泳20~40 min。頭(尾)部DNA是指彗星細胞頭(尾)部DNA 的熒光強度,頭(尾)部DNA 占比是指細胞頭(尾)部DNA 的熒光強度占所有細胞DNA 總熒光強度的百分比[29]。DNA 損傷率是細胞尾部DNA 占比在2%以上的所有細胞數之和除以被觀察的細胞總數,DNA 損傷分級按尾部DNA 占比判斷:0 級,<5%;1 級,5%~20%;2 級,20%~40%;3 級,40%~95%;4 級,>95%[30]。采用CASP彗星分析軟件對彗星圖像統計分析DNA損傷率[29]。
1.6 稚魚組織中8-羥基脫氧鳥苷質量濃度測定
每組隨機取15尾稚魚放入2 mL離心管,以質量(g)∶體積(mL)=1∶9 加入磷酸緩沖液(pH=7),在冰上進行勻漿,4 ℃、2 500 r·min-1條件下離心10 min,取上清液測定8-羥基脫氧鳥苷(8-OHdG)質量濃度。按照試劑盒說明書進行,在酶標儀450 nm 波長條件下測定光密度值。
1.7 數據分析
用SPSS 26.0進行統計學差異檢驗,采用單因素方差分析(one-way ANOⅤA)和鄧肯檢驗(Duncan's)來對組間多重差異顯著性進行比較,P <0.05表示有顯著差異。每組實驗重復3次,數據以平均值±標準差(±SD)表示,使用GraphPad 6.0.1繪制柱狀圖。
2 結果與分析
2.1 不同暴露濃度下稚魚紅細胞微核率
表1 顯示,SDBS 暴露質量濃度為0~0.8 mg/L時,黃顙魚稚魚紅細胞微核率變化范圍為(0.22% ±0.02%)~(0.59% ±0.03%)。隨著SDBS 暴露濃度的升高,對應黃顙魚稚魚紅細胞微核率顯著增加(P <0.05),且不同組間差異顯著(P <0.05)。
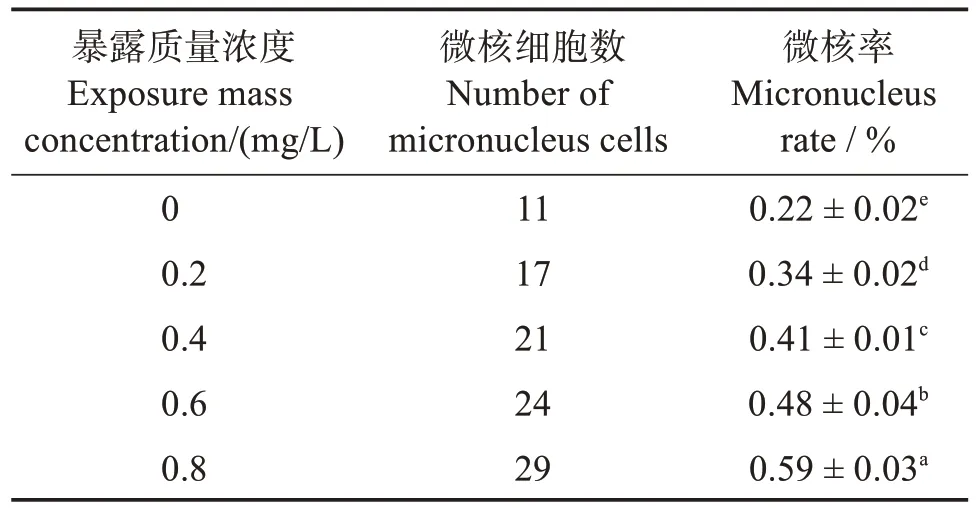
表1 SDBS暴露濃度對黃顙魚稚魚紅細胞微核率的影響Table 1 Erythrocyte micronuclei rate of juvenile Pelteobagrus fulvidraco exposed to different concentrations of SDBS
2.2 不同暴露濃度對稚魚細胞DNA損傷的影響
如表2 所示,隨著SDBS 暴露濃度的升高,稚魚細胞頭部DNA(正常DNA)熒光強度逐漸降低,且SDBS 質量濃度為0.8 mg/L 時,頭部DNA 占比顯著低于對照組及其他SDBS濃度組(P <0.05)。稚魚細胞尾部DNA(斷裂損傷DNA)占比伴隨SDBS暴露濃度的升高依次從1.1%顯著升高到5.2%(P <0.05),說明暴露濃度的升高顯著增加了稚魚細胞DNA損傷,尾部DNA占比顯著增加。隨著SDBS暴露濃度的升高,尾長增加,尾距增大。與對照組相比,其他暴露濃度組黃顙魚稚魚全魚細胞頭部DNA、尾部DNA、尾部DNA占比、尾長和尾矩差異顯著(P <0.05)。

表2 SDBS暴露濃度對黃顙魚稚魚DNA損傷的影響Table 2 Effect of SDBS exposure concentration on the DNA content of juvenile Pelteobagrus fulvidraco
2.3 暴露濃度對黃顙魚稚魚細胞尾部DNA 含量的影響
SDBS 暴露濃度與黃顙魚稚魚細胞尾部DNA占比的關系如圖1 所示,在SDBS 質量濃度為0~0.8 mg/L 時,暴露濃度與稚魚細胞尾部DNA 占比呈現良好的劑量效應關系,對應的回歸方程為=4.6x+1.48(R2=0.939 6,n=24,P <0.05)。
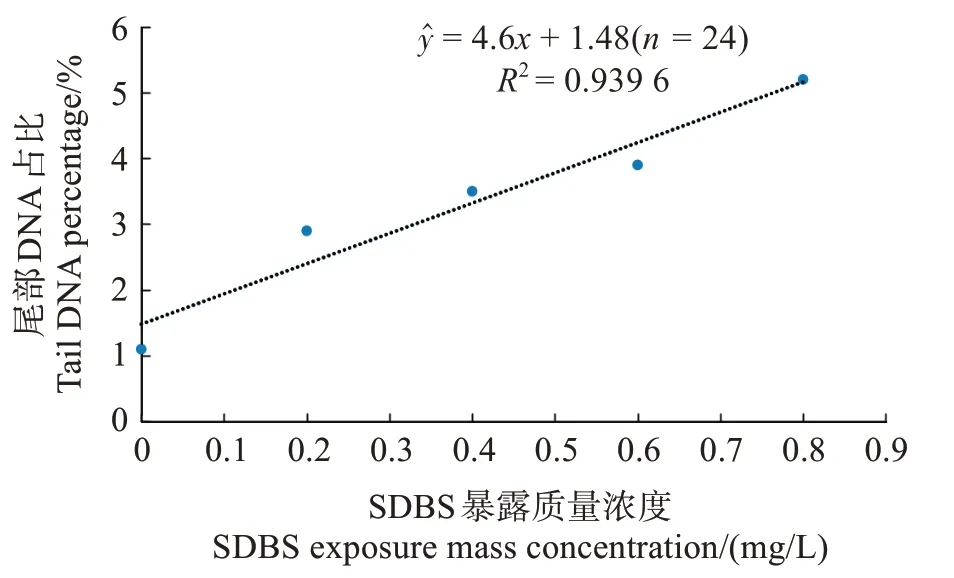
圖1 暴露濃度對黃顙魚稚魚細胞尾部DNA占比的影響Fig.1 Effect of SDBS exposure concentration on tail DNA percentage in the cell of juvenile Pelteobagrus fulνidraco
2.4 不同暴露濃度下黃顙魚稚魚DNA 損傷率及損傷等級
表3所示,從DNA 損傷率來看,SDBS暴露對黃顙魚稚魚細胞均具有不同程度的遺傳損傷,在9.4%~24.7%之間。
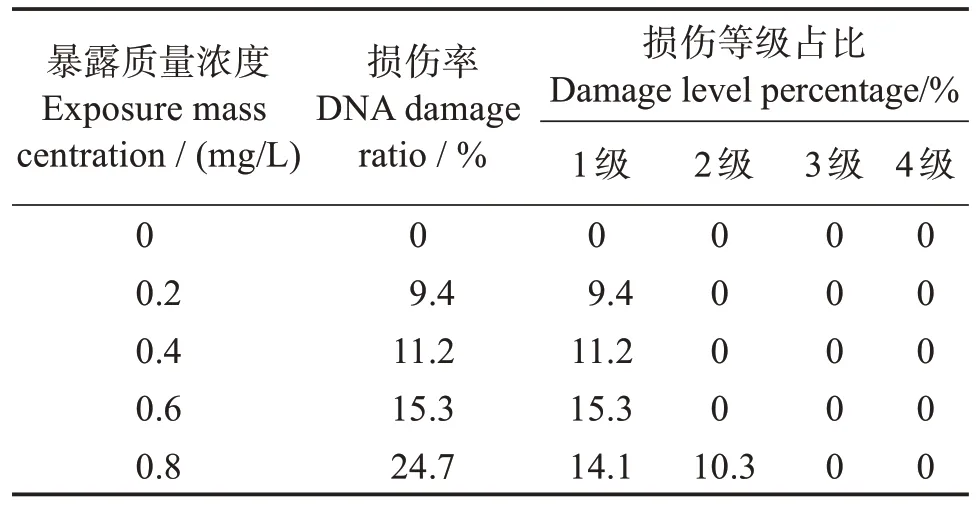
表3 不同暴露濃度下稚魚DNA損傷率及損傷等級Table 3 DNA damage rate and damage grade of juvenile Pelteobagrus fulvidraco under different exposure concentrations
從損傷等級結果來看,0.2~0.6 mg/L 暴露質量濃度的SDBS 對黃顙魚稚魚細胞的損傷程度均為1級,0.8 mg/L 暴露質量濃度的SDBS對稚魚具有1級損傷和一定比例的2 級損傷,但1、2 級的損傷DNA都具有可恢復性,表明SDBS 暴露對黃顙魚稚魚的遺傳毒性為低毒性。
2.5 不同暴露濃度下黃顙魚稚魚組織中8-羥基脫氧鳥苷含量
如圖2所示,SDBS暴露質量濃度為0~0.8 mg/L時,黃顙魚稚魚組織中8-羥基脫氧鳥質量濃度為(1.7 ± 0.36)~(8.0 ± 0.58)μg/L。隨著SDBS 暴露濃度的升高,對應黃顙魚稚魚組織中8-羥基脫氧鳥苷質量濃度顯著增加(P <0.05)。
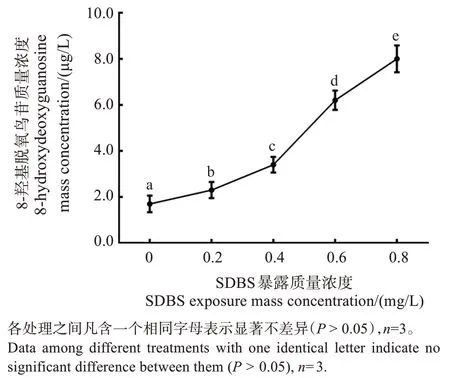
圖2 SDBS暴露濃度對黃顙魚稚魚組織8-羥基脫氧鳥苷含量的影響Fig.2 Effect of SDBS exposure concentration on the mass concentrationt of 8-hydroxydeoxyguanosine in juvenile Pelteobagrus fulνidraco tissues
3 討論
SDBS 可隨日常生活污水和工農業生產廢水等大量排入水體環境,因水體降解能力有限,SDBS 很容易在水面形成大量積聚不散的泡沫層,泡沫層會影響水體的氧氣交換,使水質惡化,而且會影響細胞膜的通透性,產生生物毒性[4-6]。劉淑英等[31]研究表明,暴露在質量濃度為25 mg/L 直鏈烷基苯磺酸鈉等洗滌劑中,鯽(Carassius auratus)鰓組織結構發生變化,膜通透性增大。同時,SDBS 能通過抑制機體的抗氧化作用從而造成細胞遺傳物質的損傷,影響DNA 轉錄與表達等[32]。產生遺傳毒性的原因可能是SDBS可顯著改變表(界)面的物理化學性質,與細胞膜表面疏水部分結合,破壞了細胞膜結構[33-35]。陳清香等[8]研究表明,SDBS對不同發育期稚魚毒性效應不同,對魚卵和仔稚魚或更小規格稚魚影響更大。楊代勤等[36]研究表明,小規格稚魚呼吸系統不完善,依靠皮膚等器官呼吸,接觸洗滌劑多;而大規格稚魚可游至水面吞噬空氣,因此吸入洗滌劑較少,導致其抗毒性增強。
魚類長期生活在水中,尤其是稚魚對水環境污染物更為敏感,可通過檢測魚類紅細胞微核率指示水環境污染狀況[17-20]。水體表面活性劑暴露對魚類的紅細胞微核率影響的研究報道僅見于黃鱔(Monopterus albus)和麥穗魚(Pseudorasbora parνa)中。唐琳等[37]發現,洗衣粉對黃鱔紅細胞的損傷主要表現為微核率的增高,且在一定范圍內,隨著洗衣粉濃度的增加和染毒時間的延長,微核率升高,洗衣粉75 mg/L 處理組的微核率達到顯著差異水平。張海艷等[38]研究十二烷基硫酸鈉在0~7.5 mg/L的濃度范圍對麥穗魚(P.parνa)仔魚微核的產生具有明顯的影響,且隨著濃度的升高而增加,微核率升高速率在4.3~5.6 mg/L 范圍內變慢,可能是高濃度的十二烷基硫酸鈉除對細胞染色體有一定的損傷外,還對細胞分裂產生干擾,使微核的產生變得緩慢。本研究發現SDBS 暴露質量濃度為0~0.8 mg/L 時,黃顙魚稚魚紅細胞微核率變化范圍為(0.22±0.02)%~(0.59±0.03)%。隨著SDBS 暴露濃度的升高,對應黃顙魚稚魚紅細胞微核率也在顯著增加。以上結果說明SDBS等洗滌劑暴露能夠誘發魚類紅細胞染色體異常。
單細胞凝膠電泳技術可以靈敏地檢測水產動物細胞遺傳物質DNA損傷,在水環境污染監測以及有機污染物對水產動物機體的遺傳損害等方面有廣泛的應用[21-26]。本研究發現,SDBS 暴露對黃顙魚稚魚血細胞的DNA 損傷呈現劑量-效應關系。王曉艷等[39]也發現石油烴濃度在0.08 mg/L 在短時間內即可對櫛孔扇貝(Azumapecten farreri)血細胞DNA 造成損傷,扇貝DNA 損傷程度與石油烴濃度呈明顯的量效關系。周海龍等[40]的研究也表明,多氯聯苯、苯并[a]芘、滴滴涕等典型的持久性污染物對紫貽貝(Mytilus edulis)不同組織中DNA 損傷作用均存在較為明顯的濃度-效應關系。這說明暴露在不同濃度污染物下的水生生物組織中的DNA 損傷效應隨著水污染暴露濃度的增加以及暴露時間的延長,表現出一定的量效關系。
DNA 氧化性損傷是最常見的遺傳物質損傷之一,而8-羥基脫氧鳥苷是反應DNA氧化損傷的生物標志物,定量檢測8-羥基脫氧鳥苷水平能夠反映DNA 氧化損傷的程度,對疾病的早期診斷和治療至關重要[41]。當前通過檢測魚類8-羥基脫氧鳥苷水平來反應DNA氧化損傷的程度僅見少量報道,大多數研究對象是面向職業暴露鎳、鉻、汞等方面的工人[42-45]或者小鼠等。劉思思等[46]研究鎘暴露導致錦鯉(Cyprinus carpio)腎臟8-羥基脫氧鳥苷水平明顯升高。王曉樂[47]研究發現啶磺草胺會引起斑馬魚(Danio rerio)胚胎和幼魚體內8-羥基脫氧鳥苷質量分數顯著升高,進而對斑馬魚造成DNA 損傷,且存在劑量-效應關系。本實驗發現隨著SDBS 暴露濃度的升高,對應黃顙魚稚魚組織中8-羥基脫氧鳥苷質量分數也在顯著增加,且不同組間差異顯著。結果提示0.2~0.8 mg/L 的SDBS 暴露造成了黃顙魚稚魚組織中DNA 氧化性損傷的生物標志物8-羥基脫氧鳥苷水平的顯著增加。SDBS 能通過抑制機體的抗氧化作用從而造成細胞遺傳物質的損傷,影響DNA 轉錄與表達等[32]。丁詩華等[27]研究結果表明,采用陰離子表面活性劑直鏈烷基苯磺酸鈉進行草魚(Ctenopharyngodon idella)毒性試驗時,可使草魚機體產生活性氧,體內的抗氧化酶活性發生改變,從而造成氧化損傷。
本研究探討了不同暴露濃度的黃顙魚稚魚的紅細胞微核率和DNA 損傷率,分析了SDBS 對水產動物的遺傳毒性影響的機制,但對黃顙魚遺傳毒性潛在的分子及代謝機制仍需進一步研究。

