VEGF和MVD在下咽鱗癌組織中的表達及其意義
甘衛剛,洪育明,劉 海,梁振源
(1.川北醫學院附屬醫院耳鼻咽喉-頭頸外科,四川南充 637000;2.福建醫科大學附屬第二醫院耳鼻咽喉科,福建泉州362000)
下咽癌作為頭頸部發病率較低的惡性腫瘤,原發于下咽黏膜上皮,以鱗狀細胞癌為主,具有生長部位隱蔽,各種臨床癥狀有出現相對較晚、生長侵襲、轉移率較高等特性,臨床診斷較難,發現較晚,晚期生存率低,生活質量差。因而,研究細胞因子與下咽鱗癌血管發生、腫瘤生長的相關性,觀察下咽鱗癌預后的相關指標,不僅為下咽鱗癌的早期診斷提供合理的理論依據,也將在一定程度上為綜合治療提供指導。
近年來,研究[1-2]表明:CD105在多數實體腫瘤中如胃癌、乳腺癌、大腸癌、前列腺癌等異常表達,與腫瘤發生、發展及預后關系密切。另有研究[3-4]表明,VEGF及CD105標記的MVD在頭頸部惡性腫瘤,如舌鱗癌、喉鱗癌、食管鱗癌等中異常表達,提示其與頭頸部惡性腫瘤的生物學行為具有密切關系。本研究采用免疫組化PV-9000二步法,檢測下咽鱗狀細胞癌和正常下咽黏膜中VEGF、CD105標記的MVD的表達,旨在分析它們與下咽鱗癌發生、發展、分型、分期、淋巴結轉移及預后的相互關系。
1 材料和方法
1.1 研究對象
1.1.1 實驗組 選擇我院及合作醫院下咽鱗狀細胞癌手術切除標本50例(術前均未經放化療),標本采集時間起自2000年1月至2012年8月,其中男性47例,女性3例;年齡42~79歲,平均年齡56.8歲;按腫瘤原發部位可分為:梨狀窩區26例,下咽后壁區15例,環后區9例;臨床分期參照國際抗癌協會(UICC,2002)TNM分期標準:T1~T220例(其中T14例;T216例);T3~T430例(其中,T322例;T48例);腫瘤組織學分化程度:低分化癌9例、中分化癌26例、高分化癌15例;頸部淋巴結轉移情況:頸淋巴結轉移陰性者7例,頸淋巴結轉移陽性者43例。
1.1.2 對照組 選取下咽癌手術癌旁組織(距腫瘤切緣2~3 cm),以及喉癌患者行全喉切除術的環后區或梨狀窩區黏膜,切取標本均為肉眼觀正常,并在HE染色鏡下確認未見癌細胞的下咽正常黏膜組織50例。
1.2 主要試劑
①兔抗人單克隆抗體 VEGF(濃縮型,ZA-0509);②鼠抗人單克隆抗體 CD105(即用型,ZM-0297);③PV-9000二步法免疫組化檢測試劑盒、DAB顯色試劑盒等。以上試劑為北京中杉金橋生物技術有限公司產品。
1.3 實驗方法
按照免疫組化二步法(PV-9000二步法免疫組化檢測試劑盒說明書提示步驟)進行免疫組化染色,VEGF、CD105標記的MVD均用已知血管肉瘤組織作陽性對照,二者均用PBS代替一抗作陰性對照。
1.4 染色結果判斷
VEGF的陽性表達為細胞質呈棕黃色,根據陽性表達的細胞數和陽性表達部位的染色強度兩種標準進行綜合評分:①以著色細胞占視野細胞總數的多少進行評分,0分:0;l分:≤25%;2分:26% ~49%;3分:≥50%。②按表達部位染色強度評分,0分:視野中細胞均無染色;1分:陽性表達部位染成淺棕色;2分:細胞陽性表達部位染成棕色且背景無著色,或細胞陽性表達部位染成深棕色并有淺棕色背景;3分:細胞陽性表達部位染成深棕色且背景無著色。分別按上述標準,在有經驗的病理科診斷醫生指導下采用雙盲法進行評分,評分結果相乘為最終得分:記0分,評分為0分者;記1分,評分為1~2分者;記2分,評分為3~4分者;記3分,評分為6~9分者。陰性,記為0~1分者;陽性,記為2~3分者[5]。
CD105陽性表達主要在血管內皮細胞質呈棕黃色,微血管計數判斷標準參照Weidner等[6]的評判標準,計算腫瘤著色的毛細血管和微小血管,凡呈現棕色單個內皮細胞或內皮細胞群,并與周圍組織有明顯界限者作為一個血管計數,先用低倍鏡下(×40)選擇5個MVD最高區,然后在400倍鏡下計數,取5個視野的微血管數平均值作為MVD,結果以(±s)表示。
1.5 圖像分析
先在OLYMPUS BX41光學顯微鏡下觀察免疫組化切片表達情況,然后選擇每張切片的4個角和中央共5個區域,在400倍視野下,采用 Motic MED6.0數碼醫學圖像分析系統在同一個光源、亮度、色彩飽和度、增益、對比度及白平衡條件下進行拍照,所得圖片應用美國Media Cybemetics公司生產的Image-ProPlus圖像分析軟件(Version6.0)(IPP 6.0)進行圖像分析。
1.6 統計學分析
采用SPSS17.0軟件進行統計學分析:①VEGF在實驗組與對照組之間陽性表達率比較采用Chisquare Test,MVD計數在兩組間比較采用t檢驗;②VEGF圖像分析結果及MVD計數均采用均數±標準差(±s)表示,兩者與臨床特征之間的關系采用t檢驗,3組之間的比較采用F檢驗;③VEGF、MVD計數相關性采用Pearson相關性分析。所有結果均有統計學意義(P<0.05)。
2 結果
2.1 VEGF蛋白在下咽鱗癌及正常下咽黏膜中的表達情況
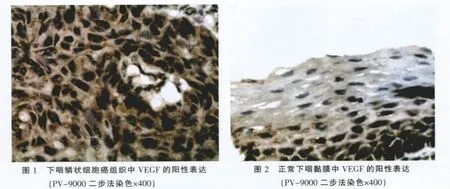
VEGF在下咽鱗癌組織及正常下咽黏膜中的表達均定位于細胞質,呈棕黃色顆粒(圖1、2)。在50例下咽鱗癌中陽性表達者37例,表達率為74.00%(37/50),而在50例正常下咽黏膜中陽性表達者15例,占 30.00%(15/50),兩組間比較 χ2=9.307,P=0.002<0.05,差異具有統計學意義,表明VEGF在下咽鱗癌中的表達顯著高于正常下咽黏膜。
2.2 下咽鱗癌組織中VEGF的表達與臨床病理學指標的關系
下咽鱗癌組織中VEGF的表達與癌組織的臨床分期、組織學分級及淋巴結轉移與否密切相關,差異具有統計學意義,均P<0.05。即下咽鱗癌組織的T分期越高、組織學分級程度越低或伴有淋巴結轉移者,VEGF呈顯著高表達;不同腫瘤原發部位、年齡、性別、吸煙史的患者,VEGF表達無統計學意義,均P>0.05(表1)。
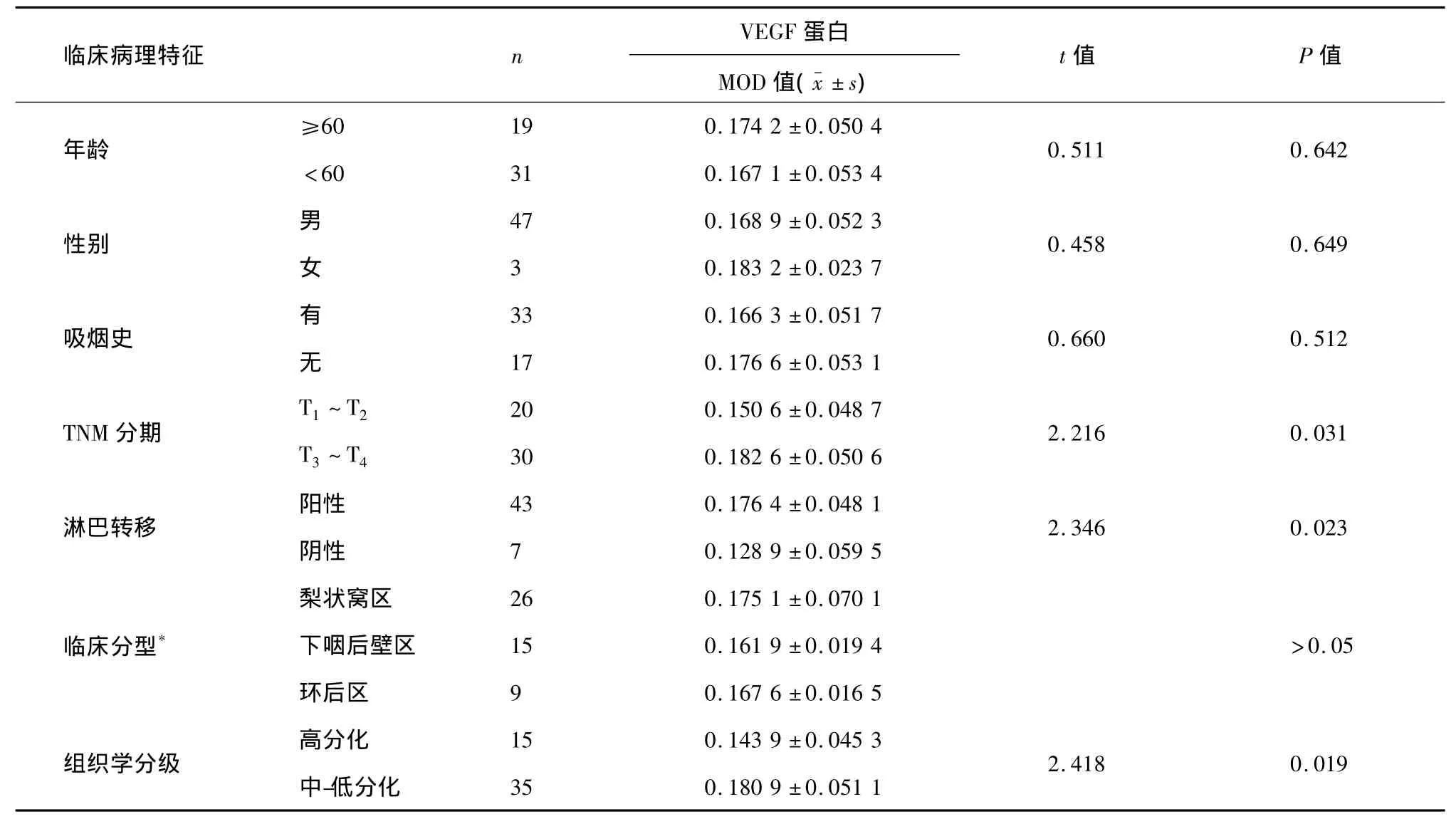
表1 VEGF蛋白在下咽鱗癌中的表達與臨床病理特征的關系
2.3 MVD-CD105在下咽鱗癌及正常下咽黏膜中的表達情況
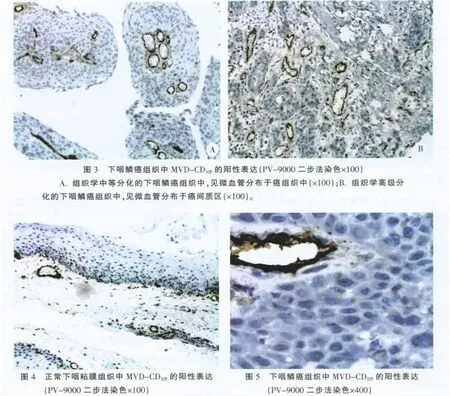
CD105蛋白表達陽性信號主要定位于血管內皮細胞細胞質,呈棕黃色粒狀(圖3-5),利用CD105標記的MVD計數在下咽鱗癌組織中平均為(37.10±5.95),而在正常下咽黏膜組織中MVD計數平均為(8.70±3.34),兩組間差異有的統計學意義,t=25.245,P=0.000<0.05,表明下咽鱗癌組織中MVD計數明顯高于正常下咽黏膜組織。
2.4 下咽鱗癌組織中MVD-CD105的表達與臨床病理學指標的關系
MVD-CD105在下咽鱗癌組織中的表達與癌組織的臨床分期、組織學分級及淋巴結轉移與否密切相關,表達差異具有統計學意義,均P<0.05。下咽鱗癌組織中,MVD計數在T3~T4組顯著高于T1~T2組,高分化組顯著低于中-低分化組,伴淋巴結轉移組顯著高于無淋巴結轉移組,均P<0.05;不同年齡、性別、吸煙史及不同腫瘤原發部位的患者中MVD計數差異無統計學意義,P>0.05(表2)。
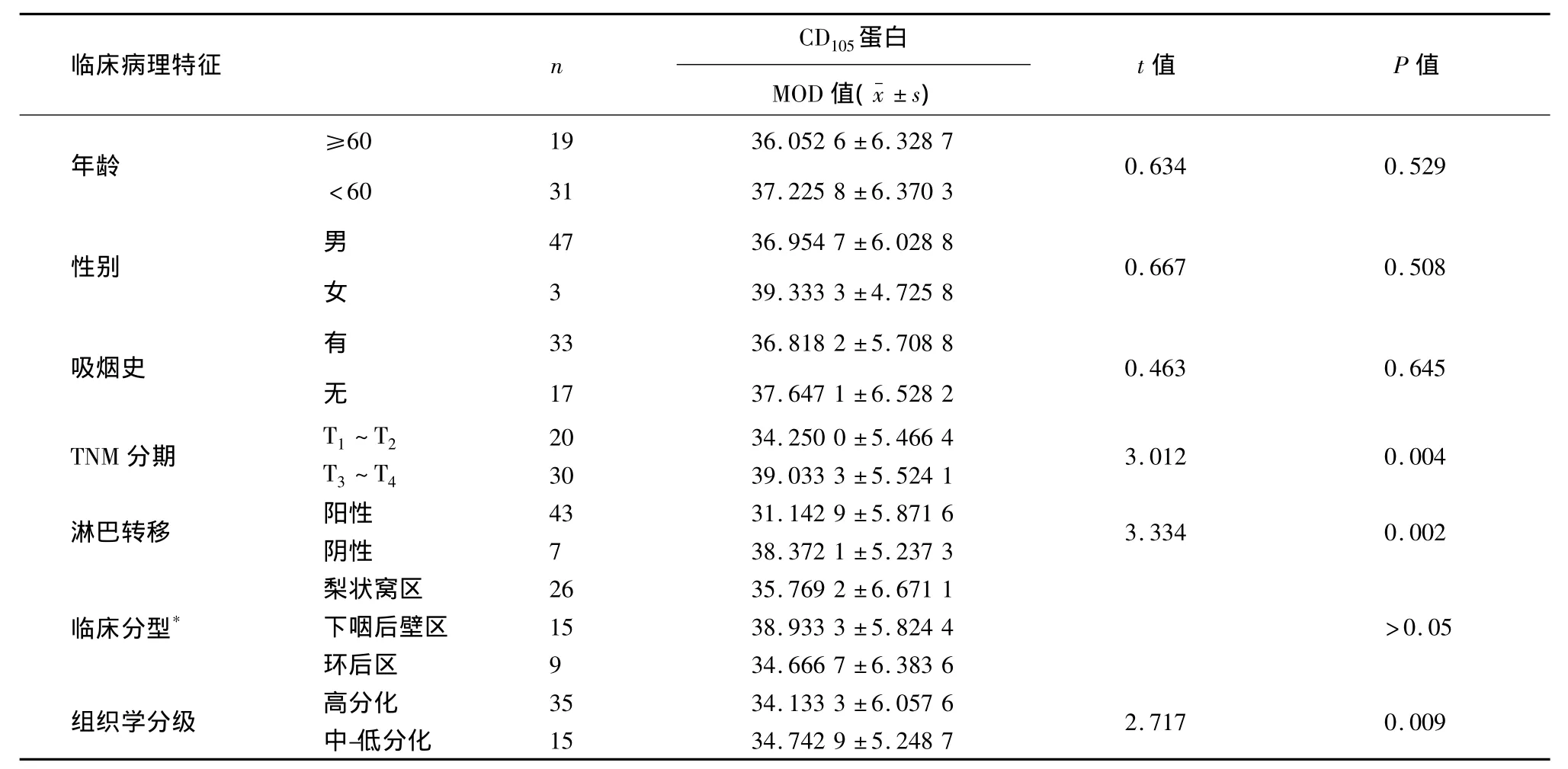
表2 MVD-CD105在下咽鱗癌中的表達與臨床病理特征的關系
2.5 VEGF和MVD表達在下咽鱗癌組織中的相互關系
采用Pearson相關性分析,對VEGF、MVD兩者在下咽鱗癌組織中的表達進行統計學分析,得出:VEGF蛋白表達與MVD計數呈顯著正相關,r=0.582,P=0.000 <0.05(表3)。

表3 下咽鱗癌組織中VEGF蛋白表達與MVD計數的相關性
3 討論
3.1 VEGF在下咽鱗癌中表達的臨床意義
1989年,Ferrara等[7]從牛腦垂體濾泡星形細胞體外培養液中分離并純化一種蛋白質,命名為血管內皮生長因子。VEGF家族是特異性地作用于內皮細胞的生長因子(不光作用于血管內皮),主要成員包 括:VEGF-A,VEGF-B,VEGF-C,和 VEGF-D。VEGF的受體屬于酪氨酸激酶家族,主要包括三個成員:VEGF-R1(Flt-1),R2(Fit-1/KDR)和 R3(Flt-4)。VEGF/VEGF-R2途徑被認為參與誘導血管形成,而 VEGF-C/VEGF-R3或 VEGF-D/VEGF-R3途徑則被認為參與誘導淋巴管形成。故VEGF-C和VEGF-D又被稱為淋巴管生成因子[8]。VEGF使得血管內瘤細胞能夠輕易穿透血管基底[6]。另外,VEGF可顯著地延長血管內皮細胞的壽命,使血管內皮細胞的繁殖次數增加15~20次。
Petruzzelli 等[9]使用酶聯免疫吸附試驗(ELISA)方法對5種不同的頭頸部腫瘤中VEGF的表達進行檢測,結果顯示均有VEGF的顯著表達,并且在使用VEGF抗體處理的細胞株中觀察到內皮細胞的增殖明顯被抑制,表明VEGF與頭頸部腫瘤組織的內皮細胞有絲分裂有關。
本實驗研究發現VEGF在下咽鱗癌組織中的表達明顯高于下咽正常黏膜,且具有統計學意義(P=0.004)。結果與國外學者分別利用原位雜交[10]、免疫組化方法[11]分析VEGF在頭頸部惡性腫瘤中的表達情況得出的結論基本一致,這可能提示VEGF與下咽鱗狀細胞癌的發生、發展密切相關。我們認為其可能機制為VEGF促進血管內皮細胞增殖,促進血管支持物的生成,增加血管通透性,為下咽鱗癌生長提供營養基礎;同時,促進淋巴管增生,引起腫瘤淋巴轉移,與其預后不良相關,其確切機制有待進一步研究。
Salven等[12]用免疫組化技術對頭頸鱗癌患者的VEGF表達進行了研究,并進行了5年生存率隨訪,檢測結果發現癌細胞質中VEGF顯著表達;同時,血管內瘤細胞能夠輕易穿透血管基底,促進淋巴轉移。VEGF的高表達也在一些腫瘤滲入的炎性細胞(包括血細胞和組織巨噬細胞)中表現出來。
在本研究中,我們還采用圖像分析系統對下咽鱗癌組織中的VEGF蛋白表達水平進行分析,發現VEGF表達在下咽鱗癌組織T3~T4組顯著高于T1-T2組(t=-2.216,P=0.031 <0.05),組織學高級分化組顯著低于中-低分化組(t=-2.418,P=0.019<0.05),伴淋巴結轉移組顯著高于無淋巴結轉移組(t=-2.346,P=0.023<0.05)。同類研究中,Dray等[13]利用免疫組化法對108例原發頭頸腫瘤病人的VEGF表達進行了相關研究,研究發現VEGF在頭頸鱗癌細胞中的表達經常被鄰近組織及炎癥細胞所介導,故VEGF的表達在頭頸鱗癌中不作為一個判斷預后的獨立指標。
VEGF除了通過刺激內皮細胞生長,介導新生血管生成為下咽鱗癌生長提供營養和氧氣外,更能夠改變新生血管通透性,使得癌細胞能夠穿過血管基底,進入血流,分布到鄰近和遠處組織,促進腫瘤生長浸潤和遠處轉移。研究證實,VEGF還可誘導新生淋巴管形成,介導癌細胞進入淋巴循環,導致淋巴轉移,在下咽鱗癌中常見為頸部淋巴轉移。
3.2 MVD-CD105在下咽鱗癌中表達的臨床意義
MVD是通過采用血管標記因子,如CD31、CD34、CD105、vWF及Ⅷ因子等檢測腫瘤組織中新生血管的數量、形態及分布的指標,可以量化腫瘤組織中血管生長速度,反應腫瘤組織接受氧供和營養支持的程度,在較多研究中,學者們仍以CD34作為標記物,研究結果多可反應血管生成情況[14]。然而,近年來,CD105被發現是目前腫瘤組織中標記未成熟血管的最特異指標,更能精確地反應腫瘤微血管密度值。
Wikstrom 等[15]發現:CD105主要在未成熟的血管上表達。Saad等[16]研究證實,CD105比 CD34和vWF更好作為腫瘤血管標志物及預測腫瘤預后,CD105可作為一種標記新生血管生成的較理想的標志物。
另外,CD105可作為一氧化氮的調節因子,在小鼠股動脈中,CD105的表達水平調節內皮型一氧化氮合酶的數量。在培養的內皮細胞中,CD105表達的強弱相應導致內皮型一氧化氮合酶明顯的上升或下降。因此,CD105與血管的發生、生成及血管壁完整性維護有關。因CD105受低氧條件和TGF-β1的共同作用誘導表達,而腫瘤組織,尤其是惡性腫瘤,在早期階段生長迅速,需要充足的氧氣和營養支持,而正常的血管發生和形成速度難以滿足其需求,經上述調解模式,此時便出現CD105在活性血管生成區內皮細胞中高表達,這也就解釋了為什么大血管及正常組織的血管內皮細胞中CD105呈表達顯著下降或呈陰性表達[17]。
顧欣等[18]研究發現,CD105標記的MVD在喉鱗狀細胞癌高分化組和低分化組的差別有顯著意義,隨腫瘤浸潤范圍的增大而增加,且隨臨床分期升高而增加。Schimming等[19]發現 CD105標記口腔鱗狀細胞癌微血管密度值明顯高于鄰近的正常黏膜;并且與腫瘤的增殖、分期、轉移顯著相關。Akagi等[20]研究發現,在結、直腸腺瘤由輕度、重度不典型增生至腺癌發展的過程中,CD105標記的微血管密度值逐漸升高,提示CD105有助于早期診斷。
本研究進一步發現,CD105標記的MVD與下咽鱗狀細胞癌患者的性別、年齡、吸煙史及腫瘤原發部位之間差異無統計學意義(均P>0.05)。而MVD計數在下咽鱗癌組織T3~T4組顯著高于T1~T2組,組織學高級分化組顯著低于中-低分化組,伴淋巴結轉移組顯著高于無淋巴結轉移組,與 Chien等[21]學者對舌鱗癌組織的研究結果相一致,故可認為CD105標記的MVD與下咽鱗癌的發生、生長和轉移密切相關,其檢測結果有助于我們對下咽鱗癌的早期認識及對病情、預后等的綜合判斷。
腫瘤組織中的新生血管在形態學、數量變化和分布規律方面反應腫瘤的生物學行為變化,根據MVD表達與下咽鱗癌的臨床進展一致,我們認為下咽鱗癌中微血管密度與病情發展程度密切相關,在一定意義上可以量化腫瘤新生血管,從而推測MVD可以作為下咽鱗狀細胞癌病情評估的量化指標。CD105是目前腫瘤新生血管的良好標志物,主要表達于未成熟血管內皮細胞表面,可顯示出單個內皮細胞和較小的微血管,即體現出腫瘤發生和初步形成階段,腫瘤血管的數量變化。
本研究還發現,下咽鱗癌組織中,CD105標記的微血管分布主要呈現兩種趨勢,即在中-低分化組,微血管主要分布于癌組織間(圖3A);而在高分化組中,微血管則可見分布于癌巢內,也可見分布于癌間質區(圖3B),這種分布紊亂可能在一定程度上利于腫瘤細胞遷徙入血管,加速腫瘤生長、增強侵襲潛能。對于組織學分化不同的下咽鱗癌組織中,微血管分布的差異性,未在此次實驗中進行詳細闡述,但可在以后的研究工作中,進一步觀察導致上述現象出現的具體機制。
3.3 下咽鱗癌中VEGF表達及MVD計數的相互關系
VEGF在腫瘤血管形成中的重要作用已得到證實,MVD計數則為評估腫瘤血管生成提供客觀依據,根據實驗結果顯示,VEGF與MVD-CD105在下咽鱗狀細胞癌中的表達均顯著升高,兩者具有正相關性。這一結果提示VEGF蛋白的過度表達與腫瘤MVD計數升高密切相關,可以認為VEGF蛋白促進下咽鱗狀細胞癌的新生血管生成,并促進下咽鱗狀細胞癌組織的增殖與轉移,與MVD計數的變化一致,并與不良預后密切相關。
[1] Tanaka F,Otake Y,Yanagihara K,et al.Evaluation of angiogenesis in non-small cell lung cancer:comparison between anti-CD34,anti-body and anti-CD105antibody[J].Clin Cancer Res,2001,7(11):3410-3415
[2] 黃一凡,唐瓊蘭,謝賢鏞,等.VEGF基因在結腸癌中的表達及意義[J].川北醫學院學報,2007,22(3):216-218
[3] 吳 群,王志寬.人舌鱗狀細胞癌中整合素α5β1、αvβ3表達的生物學意義[J].實用口腔醫學雜志,1999,15(6):178-180
[4] Fujieda S,Sunaga H,Tsuzuki H,et al.Expression of platelet-derived endothelial cell growth factor in oral and oropharyngeal carcinoma[J].Clin Cancer Res,1998,4(7):1583-1590
[5] Segerman B,Holmfeldt P,Morabito J,et al.Autonomous and phosphorylation-responsive microtublue-regulating activities of the N-terminus of Op18/Stathmin[J].J Cell Sci,2003,116(1):197-205
[6] Weidner N,Folkman J,Pozza F,et al.Tumor angiogenesis:a new significant and independent prognostic ind icator in earlystage breast carcinoma[J].J Natl Cancer Inst,1992,84(24):1875-1876
[7] Ferrara N,Davis-Smyth T.The biology of vascular endothelial growth factor[J].Endocr Rev,1997,18(1):24-25
[8] Stacker SA,Caesar C,Baldwin ME,et al.VEGF-D promotes the metastatic spread of tumor cells via the lymphatics[J].Nat Med,2001,7(2):186-191
[9] Petruzzelli GJ,Benefield J,Taitz AD,et al.Heparin-binding growth factor(s)derived from head and neck squamous cell carcinomas induce endothelial cell proliferations[J].Head Neck,1997,19(7):576-582
[10] Denhart BC,Guidi AJ,Tognazzi K,et al.Vascular permeability factor/vascular endothelial growth factor and its receptors in oral and laryngeal squamous cell carcinoma and dysplasia[J].Lab Invest,1997,77(6):659-664
[11] Eisma RJ,Spiro JD,Kreutzer DL.Vascular endothelial growth factor expression in head and neck squamous cell carcinoma[J].Am J Surg,1997,174(5):513-517
[12] Salven P,Lymboussaki A,Heikkila P.Vascular endothelial growth factors VEGF-B and VEGF-C are expressed in human tumors[J].Am J Pathol,1998,153(1):103-108
[13] Dray TG,Hardin NJ,Sofferman RA.Angiogenesis as a prognostic marker in early head and neck cancer[J].Ann Otol Rhinol Laryngol,1995,104(9):724-729
[14]李 佽,劉都禮,劉 莉.食管鱗癌中環氧化酶-2與Ki-67及微血管密度的相關性[J].川北醫學院學報,2006,21(5):413-415
[15] Wikstrom P,Lissbrant IF,Statin P,et al.Endoglin(CD105)is expressed on immature blood vessels and is a marker for survival in prostate cancer[J].Prostate,2002,51(4):268-270
[16] Saad RS,Jasnosz KM,Tung MY,et al.Endoglin(CD105)expression in endometfial carcinoma[J].Im J Gynecol Pathol,2003,22(3):248-253
[17] Li C,Guo B,Wilson PB,et al.Plasma a levels of soluble CD105correlate with metas-tasis in patients with breast cancer[J].Int J Cancer,2000,89(2):122-126
[18]顧 欣,徐陽陽,吳 鶴,等.CD105與喉鱗狀細胞癌血管生成及生物學行為的關系[J].臨床耳鼻咽喉科雜志,2006,20(3):125-128
[19] Schimming R,Marine D.Endoglin(CD105)expression in squamous cell carcinoma of the oral cavity[J].Head Neck,2002,24(2):151-156
[20] Akagi K,Ikeda Y,Sumiyoshi Y,et al.Estimation of angiogenesis with anti-CD105immunostaining in the process of colorectal cancer development[J].Surgery,2002,131(1):109-113
[21] Chien CY,Su CY,Hwang CF,et al.Clinicopathologic significance of CD105expression in squamous cell carcinoma of the hypopharynx[J].Head Neck,2006,28(5):441-446

