黑火藥煙霧致吸入性肺損傷大鼠模型的建立與評價
劉一凡,唐紅衛,吳小利,謝尹晶,張洪瑞,段晉燕,向代軍,蘭曉梅,李綿洋,王成彬,李登清
在戰爭或軍事演習的特殊環境中,火藥通常被用于掩護我方﹑攻擊敵方或模擬實戰環境。火藥在爆炸﹑燃燒過程中會釋放大量的有毒氣體﹑粉塵及顆粒,軍事人員極易因長期暴露于此環境而引發急性呼吸道和肺損傷,如化學性肺水腫﹑吸入性肺炎等,嚴重者甚至發展為呼吸衰竭[1]。黑火藥是軍事活動中常用的彈藥材料,因其煙霧的致傷因素復雜,目前其致傷機制研究僅限于體外實驗[2],若要進一步探索黑火藥煙霧導致的肺部損害的發病機制﹑藥物預防及治療效果評價,尚需構建穩定﹑可靠的動物模型。為此,本研究在火藥煙霧吸入毒理學分析平臺的基礎上改進裝置[3],構建火藥煙霧致吸入性肺損傷的大鼠模型,并對該模型進行評價。
1 材料與方法
1.1 實驗動物 健康雄性Wistar大鼠,體重210~230g,由解放軍總醫院實驗動物中心提供,合格證號SCXK(京)2012-0001。大鼠于動物中心清潔房中飼養,溫度21~24℃,濕度50%~60%,晝夜12h節律,自由進食﹑飲水。
1.2 儀器及設備
1.2.1 火藥煙霧發生裝置 由煙霧發生室和動物煙熏室兩部分組成,材質均為聚乙烯。煙霧發生室內徑32cm×28cm×34cm ,內置遙控電磁加熱器﹑發煙盤﹑氣泵(輸出功率150W),其頂蓋距邊線10cm處分別接有3個直徑為5cm的導煙管,其中1個導煙管一端與緩沖袋相連,另外2個導煙管與氣泵兩端相連,作為推動兩室氣體循環流動的通道。動物煙熏室內徑32cm×24cm×34cm,側壁有供氣體檢測儀和溫度檢測儀采樣的端口(圖1)。
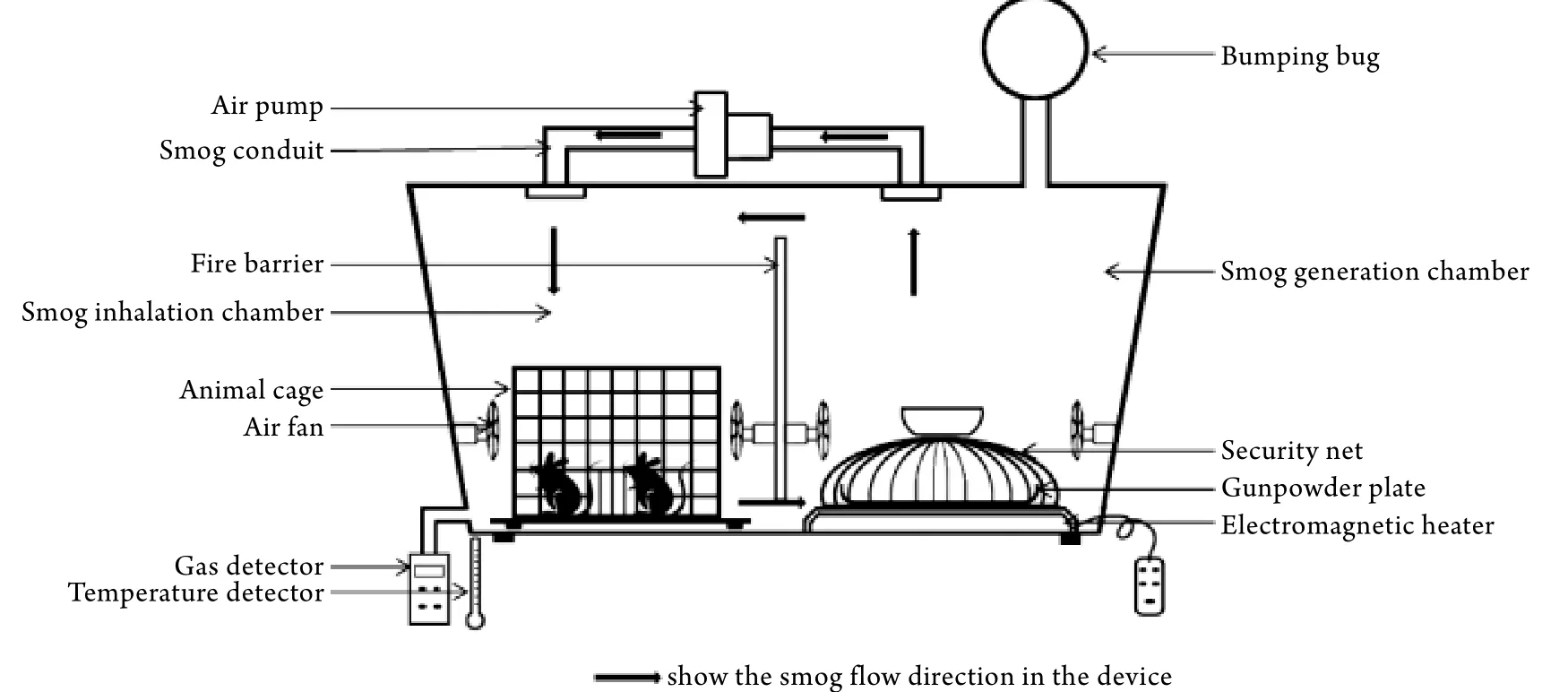
圖1 火藥煙霧發生裝置模型示意圖Fig. 1 Schematic layout of smog-generating device
1.2.2 火藥成分 依據民用黑火藥國家標準GB18450-2001配制火藥,即按質量百分比將75%硝酸鉀(分析純,北京化學試劑公司)﹑10%硫黃粉(純度99.9%,200目,北京西四化工原料公司)﹑15%碳粉(分析純,國藥集團化學試劑公司)分別研磨后混勻,并經100目篩過濾,37℃干燥24h后收集于潔凈塑料盒中密封保存。
1.2.3 氣體成分及溫度檢測 采用一氧化碳檢測儀CO-180(北京金泰科儀檢測儀器有限公司)檢測CO濃度,泵吸式紅外二氧化碳氣體分析儀(北京寶云興業科貿有限公司)檢測CO2濃度,GDYK-402S空氣現場二氧化硫測定儀(長春吉大小天鵝儀器有限公司)檢測SO2濃度,GDYK-101S空氣現場硫化氫速測儀(長春吉大小天鵝儀器有限公司)檢測H2S濃度,溫度快速檢測儀(長春吉大小天鵝儀器有限公司)測定煙霧溫度。
1.3 實驗設計
1.3.1 火藥劑量﹑暴露時間與死亡率的關系 ①將大鼠在固定煙熏時間(21min)的條件下分別暴露于不同火藥劑量(5﹑7.5﹑9﹑10﹑11﹑12.5﹑15g)所產生的煙霧中;②將大鼠在固定煙霧濃度(火藥劑量為10g)的條件下分別放置不同時間(8﹑9﹑10﹑15﹑21min)。記錄并分析整個煙熏過程中及煙熏處理后連續4d內大鼠的死亡情況。
1.3.2 肺損傷模型 42只Wistar大鼠隨機分為對照組和建模后1﹑2﹑6﹑24﹑48﹑96h組(n=6),建模組大鼠置于密閉的動物煙熏箱并在10g火藥產生的煙霧中暴露8min,然后依據分組在相應時間點處死。對照組大鼠暴露于動物煙熏箱的空氣中8min,于暴露后96h處死。
“專業發展環境”主要用來衡量學校的整體氛圍對教師專業發展的影響。有關要素包括:學校領導對教師專業發展的重視程度和其他管理層的態度;學習與研修場所;外聘專家來校指導;教師外出學習、經費等。其中,除了“外出學習機會與經費”的認可度接近高,其他要素的認可度均為高。
1.4 煙熏處理 稱固定質量的火藥放入發煙室的不銹鋼發煙盤中,置于遙控電磁加熱器上,上方扣上安全網蓋,每次于動物煙熏室中放入裝有2只待處理大鼠的動物籠,蓋緊,打開兩室內風扇,并關閉裝置頂蓋,檢查氣密情況,使用遙控裝置將電磁加熱器調至功率最大擋位,火藥燃盡至無明火后,關閉電磁加熱器,并啟動氣泵。待暴露時間到達后,打開煙熏箱取出大鼠,置于空氣中。
1.5 觀測指標
1.5.1 煙霧中CO﹑CO2﹑SO2﹑H2S濃度及溫度 檢測火藥燃燒后3﹑9﹑12min時各氣體成分的濃度及煙霧的溫度。
1.5.2 臨床表現 觀察大鼠在吸入煙霧過程中及煙熏結束后的呼吸情況﹑活動情況及精神狀態﹑發紺程度等。
1.5.3 動脈血氣 在相應時間點用4%水合氯醛(1ml/kg)腹腔注射麻醉大鼠,暴露分離腹主動脈,取血1ml后放血處死大鼠,于半小時內進行動脈血氣分析。
1.5.4 肺濕/干比(W/D) 取右肺前葉﹑中葉,用濾紙拭干表面血液,以電子天平稱重(濕重),然后放入60℃烘箱烘烤48h至恒重,電子天平稱重(干重),計算W/D值。
1.5.5 支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)白細胞計數及蛋白含量測定 腹主動脈放血處死大鼠后,打開胸腔,分離主支氣管,夾閉右主支氣管,在主支氣管切開處置入自制灌洗針并結扎固定,用4℃生理鹽水2.5ml行左肺灌洗,重復3次,記錄回收量。BALF經1500r/min離心10min,收集上清液,BAC法測定總蛋白含量,取沉淀重懸于1ml生理鹽水,進行白細胞計數。
1.5.6 肺組織病理學檢查 打開胸腔后觀察肺組織大體病理改變,取右肺后葉浸入4%中性甲醛溶液中固定24h,石蠟包埋,4μm連續切片,常規HE染色后光鏡下觀察。
1.6 統計學處理 采用SPSS 17.0軟件進行統計分析。符合正態分布及方差齊性的計量資料以±s表示,組間比較采用單因素方差分析(One-way ANOVA),建模組與對照組比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 火藥劑量﹑暴露時間與死亡率的關系 將暴露時間固定為21min,火藥劑量為5g時未見大鼠死亡,火藥劑量從7.5g增高到10g時,大鼠死亡率自12.5%增至77.8%,當火藥劑量為15g時,死亡率達到100%。當固定火藥劑量為10g時,死亡率隨暴露時間延長而增加,暴露時間為8min時,煙熏處理后4d內未見大鼠死亡,而當時間增至21min時,4d內大鼠死亡率達到77.8%。
2.2 煙霧中CO﹑CO2﹑SO2﹑H2S濃度及溫度測定結果 10g黑火藥完全形成煙霧后3﹑9﹑12min,動物煙熏箱中CO﹑CO2﹑SO2﹑H2S濃度及溫度差異無統計學意義(P<0.05,表1)。
表1 煙霧形成后不同時間點氣體濃度﹑溫度變化(±s,n=10)Tab. 1 Smog concentration and temperature at each time point after smog emergence (±s, n=10)

表1 煙霧形成后不同時間點氣體濃度﹑溫度變化(±s,n=10)Tab. 1 Smog concentration and temperature at each time point after smog emergence (±s, n=10)
CO. 1ppm=2.86×10-8mol/L; H2S. 1ppm=1.94×10-8mol/L; SO2.1ppm=5.47×10-9mol/L
Time(min)CO2(%) CO(ppm) H2S(ppm)SO2(ppm) T(℃)3 2.04±0.11 249.67±16.07 0.51±0.09 1.36±0.02 27.40±0.70 9 2.11±0.10 243.00±14.73 0.48±0.04 1.36±0.02 26.40±1.29 12 1.97±0.09 239.33±5.5 0.43±0.03 1.37±0.03 26.00±1.14
2.3 臨床表現 對照組大鼠至實驗結束時無異常,精神可,反應靈活,活動正常,體毛光滑,呼吸平穩。建模組大鼠在煙熏處理后立即出現呼吸急促﹑張口呼吸并伴隨口鼻分泌物增多,可聞及因呼吸困難產生的嗚咽聲,四肢﹑口唇處可見發紺。煙熏處理1h后,建模組大鼠呼吸由急促變深大,呼吸困難及發紺癥狀稍減輕,至煙熏后96h均表現為精神萎靡,反應差,活動少,毛發無光澤并伴有深大呼吸。
2.4 動脈血氣分析結果 對照組大鼠PaO2為83.27±4.99mmHg,煙霧吸入1h后,建模組大鼠PaO2迅速降至47.79±13.28mmHg,6h后逐漸升高至64.10±12.61mmHg,但仍顯著低于對照組(P<0.05),至96h仍未恢復至對照組水平。PaCO2在煙熏處理后24h內呈升高趨勢,至24h達最高值(60.56±8.42mmHg),此后逐漸降低,96h恢復至對照組水平。對照組COHb水平為0.60%±0.11%,建模組大鼠煙熏后1 h C O H b水平迅速增至11.22%±4.98% (P<0.05),煙熏后6h恢復至對照組水平,SO2%﹑O2Hb變化趨勢與COHb相反(表2)。
表2 各組大鼠煙霧吸入前后PaO2﹑PaCO2﹑SO2的變化(±s,n=6)Tab. 2 Changes of PaO2, PaCO2 and SO2 before and after smog inhalation (±s, n=6)
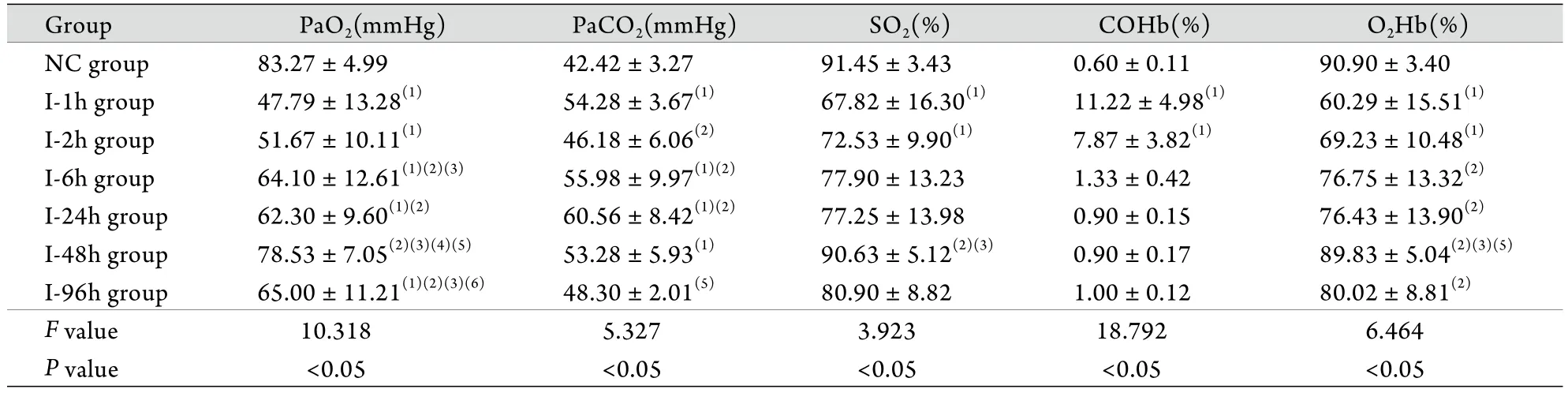
表2 各組大鼠煙霧吸入前后PaO2﹑PaCO2﹑SO2的變化(±s,n=6)Tab. 2 Changes of PaO2, PaCO2 and SO2 before and after smog inhalation (±s, n=6)
(1)P<0.05 compared with NC group; (2)P<0.05 compared with I-1h group; (3)P<0.05 compared with I-2h group; (4)P<0.05 compared with I-6h group; (5)P<0.05 compared with I-24h group; (6)P<0.05 compared with I-48h group
Group PaO2(mmHg) PaCO2(mmHg) SO2(%) COHb(%) O2Hb(%)NC group 83.27±4.99 42.42±3.27 91.45±3.43 0.60±0.11 90.90±3.40 I-1h group 47.79±13.28(1) 54.28±3.67(1) 67.82±16.30(1) 11.22±4.98(1) 60.29±15.51(1)I-2h group 51.67±10.11(1) 46.18±6.06(2) 72.53±9.90(1) 7.87±3.82(1) 69.23±10.48(1)I-6h group 64.10±12.61(1)(2)(3) 55.98±9.97(1)(2) 77.90±13.23 1.33±0.42 76.75±13.32(2)I-24h group 62.30±9.60(1)(2) 60.56±8.42(1)(2) 77.25±13.98 0.90±0.15 76.43±13.90(2)I-48h group 78.53±7.05(2)(3)(4)(5) 53.28±5.93(1) 90.63±5.12(2)(3) 0.90±0.17 89.83±5.04(2)(3)(5)I-96h group 65.00±11.21(1)(2)(3)(6) 48.30±2.01(5) 80.90±8.82 1.00±0.12 80.02±8.81(2)F value 10.318 5.327 3.923 18.792 6.464 P value <0.05 <0.05 <0.05 <0.05 <0.05
2.5 W/D及BALF白細胞計數﹑蛋白含量測定結果 煙霧吸入后1﹑2﹑6﹑96h時間點建模組大鼠W/D顯著高于對照組(P<0.05),并于2h時達最高值。各組BALF回收量均達80%以上,BALF中白細胞數自煙霧吸入后2h開始上升,至24h時達峰值,為(39.00±15.67)×105/ml,隨后降低。BALF中蛋白含量于煙霧吸入后1h達最高值,隨后逐漸下降,至48h恢復至對照組水平(表3)。
表3 肺W/D及BALF白細胞計數﹑總蛋白含量的變化(±s,n=6)Tab. 3 Changes of W/D, leukocytes and protein before and after smog inhalation (±s, n=6)
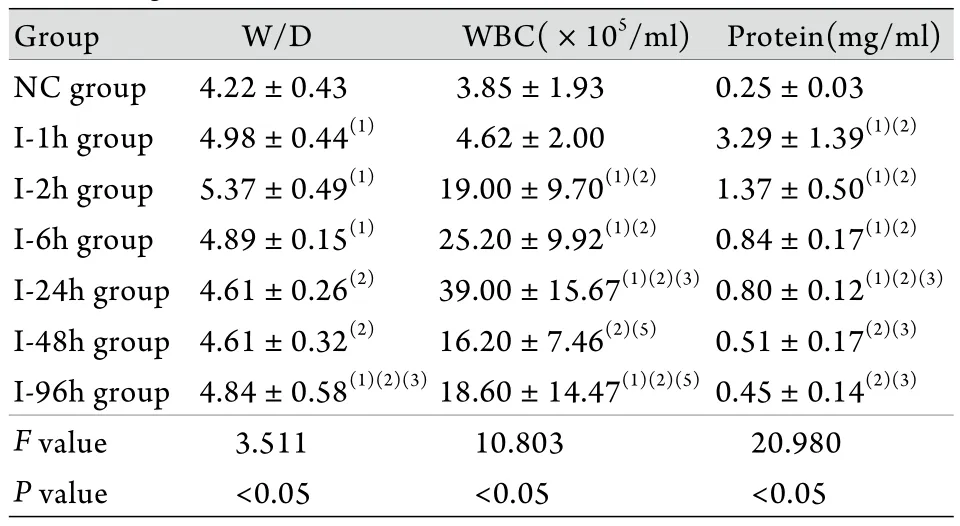
表3 肺W/D及BALF白細胞計數﹑總蛋白含量的變化(±s,n=6)Tab. 3 Changes of W/D, leukocytes and protein before and after smog inhalation (±s, n=6)
(1)P<0.05 compared with NC group; (2)P<0.05 compared with I-1h group; (3)P<0.05 compared with I-2h group; (4)P<0.05 compared with I-6h group; (5)P<0.05 compared with I-24h group; (6)P<0.05 compared with I-48h group
Group W/D WBC(×105/ml) Protein(mg/ml)NC group 4.22±0.43 3.85±1.93 0.25±0.03 I-1h group 4.98±0.44(1) 4.62±2.00 3.29±1.39(1)(2)I-2h group 5.37±0.49(1) 19.00±9.70(1)(2) 1.37±0.50(1)(2)I-6h group 4.89±0.15(1) 25.20±9.92(1)(2) 0.84±0.17(1)(2)I-24h group 4.61±0.26(2) 39.00±15.67(1)(2)(3)0.80±0.12(1)(2)(3)I-48h group 4.61±0.32(2) 16.20±7.46(2)(5) 0.51±0.17(2)(3)I-96h group 4.84±0.58(1)(2)(3)18.60±14.47(1)(2)(5)0.45±0.14(2)(3)F value 3.511 10.803 20.980 P value <0.05 <0.05 <0.05
2.6 肺組織病理觀察結果 肺組織大體觀:對照組大鼠肺組織顏色均勻,呈肉粉色,組織質地柔軟,彈性好,未見腫脹﹑出血及壞死。建模組大鼠在吸入煙霧24h內,肺組織正面及背面均明顯充血水腫,呈暗紅色,肺表面可見多處斑片狀出血,氣管腔內含有乳白色泡沫,至吸入后96h可見肺組織恢復至淡紅色,肺葉邊緣出現斑片狀暗紅色梗死灶,彈性差(圖2)。光鏡下觀察:對照組大鼠肺泡腔結構清晰﹑完整,腔內無滲出液,肺泡間隔均勻一致;煙霧吸入1h后血管外即出現明顯出血﹑水腫,至6h可見毛細血管擴張,肺泡腔內可見透明膜及漏出紅細胞,24h后可見炎性細胞浸潤,48h后肺泡腔明顯增寬,肺泡間隔明顯增厚,炎性細胞浸潤增多,96h可見大量肺泡間隔斷裂,大量炎性細胞浸潤,以單核﹑巨噬細胞為主(圖3)。
3 討 論
既往研究構建吸入性肺損傷模型所采用的發煙材料主要為煤油及干燥的松木屑,但這種方法產生的煙霧成分及燃燒方式與實戰環境差別較大[4-5]。本研究采用戰爭中常用的黑火藥,保證了燃燒材料的單一,既利于致傷因素分析,又能準確模擬戰場環境。
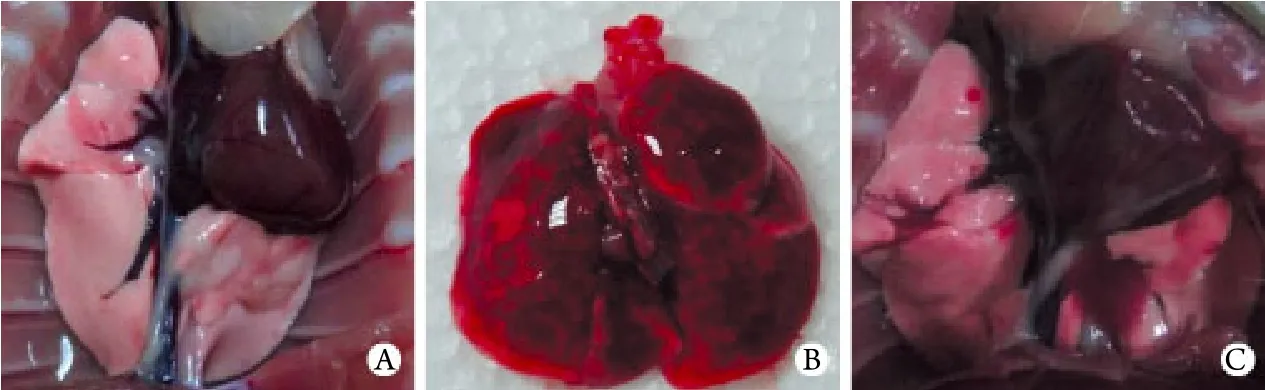
圖2 肺組織大體觀Fig. 2 Gross examination of the rat lungs
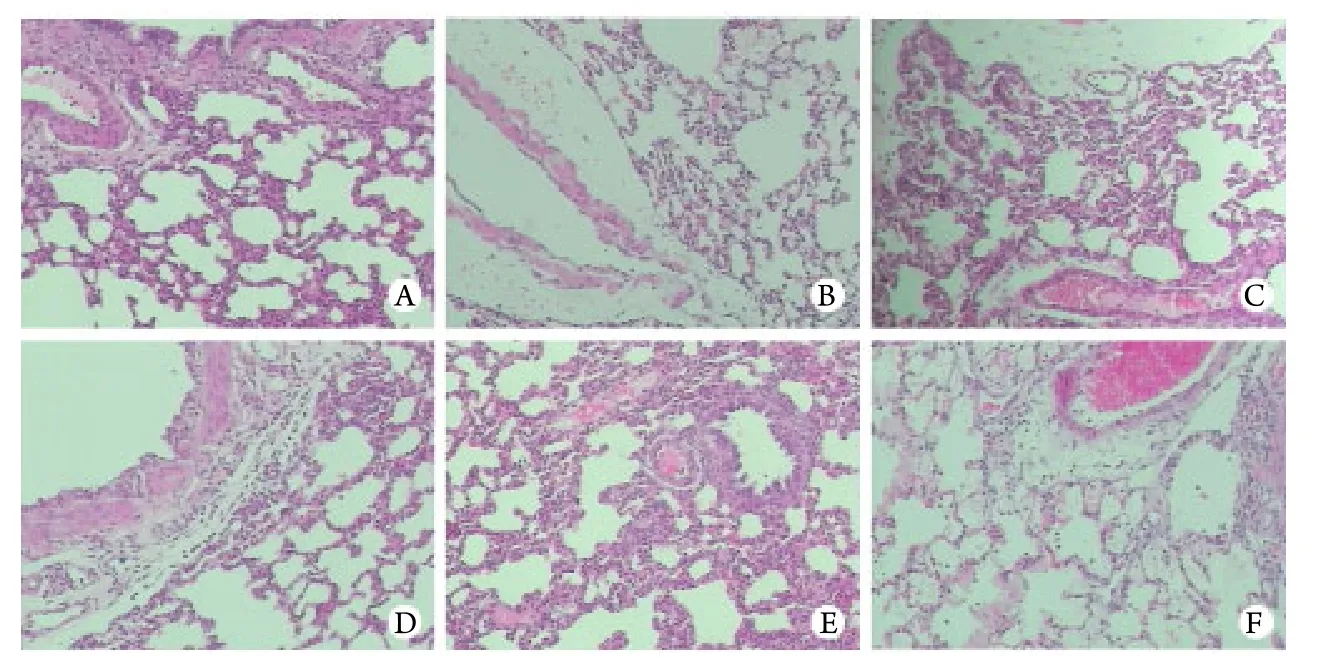
圖3 肺組織病理學觀察(HE ×100)Fig. 3 Histopathological observation of the lung tissues (HE ×100)
本研究在火藥煙霧吸入毒理學分析平臺的基礎上進行改裝,制作了適合建立動物吸入性肺損傷模型的發煙裝置。裝置中煙霧在風泵產生的氣流推動下形成閉合回路,形成濃度分布均勻的煙霧環境。該裝置中發煙室與動物煙熏室相互獨立,排除了火藥可能導致的燒傷﹑沖擊傷等復合致傷因素,保證了吸入性損傷為單一致傷因素。氣體濃度和溫度的檢測與監控確保了構建模型條件的一致性和可靠性。此外,本裝置在確保重復性和可靠性的條件下,體積小,組裝簡單,便于推廣應用。本研究的不足之處是未能進行煙霧成分中相關顆粒物的成分及粒徑檢測。
本研究分別改變火藥燃燒劑量和煙霧暴露時間,觀察大鼠在4d內的生存情況,發現其死亡率隨火藥劑量增加及暴露時間延長而升高,與文獻報道趨勢一致[5-6],但火藥劑量為11.0~12.5g時大鼠死亡率低于劑量為10g時,分析原因可能與動物個體差異及數量較少有關。暴露時間為21min時,半數致死劑量在8~10g之間,取10g火藥燃燒,暴露10min時4d內死亡率為40%,接近半數死亡率,而暴露8min時,4d內未見動物死亡,因此選擇10g火藥燃燒﹑暴露10min為致傷條件。
黑火藥燃燒原理為硝酸鉀分解放出的氧氣,使碳和硫劇烈燃燒,瞬間產生大量N2﹑CO2等氣體。本研究表明,在煙霧產生12min內,CO2﹑CO﹑SO2﹑H2S氣體濃度及煙熏室中溫度均保持穩定。CO2及CO濃度遠高于空氣中的正常含量,CO是一種常見的窒息性毒物,同時有研究表明高濃度CO2也可能是導致肺部損傷的因素[7-8]。動脈血氣分析結果顯示大鼠在煙熏處理后即出現低氧血癥,隨后PaO2逐漸恢復,PaCO2先升高,至吸入后48h逐漸降低。COHb是由CO與血紅蛋白相結合而形成,可使血紅蛋白失去輸氧能力,肺部因缺氧致傷,其含量通常被認為是判斷CO中毒的可靠指標[9]。本研究大鼠動脈血中COHb含量在煙霧吸入1h后即達到峰值,6h后恢復至正常水平,因此推測煙霧吸入后早期的低氧血癥可能是由大量吸入CO引起的。
W/D是評價肺水腫嚴重程度的良好指標,而BALF中蛋白含量與肺微血管通透性呈正比[10]。本模型中,W/D和BALF蛋白含量在煙霧吸入后均迅速升高,提示大鼠經煙霧刺激后肺部微血管通透性增加,并出現肺水腫。BALF中白細胞計數是反映氣道及肺部炎癥的重要指標,本研究結果顯示,煙霧暴露后大鼠BALF中白細胞計數呈進行性增加,至吸入后24h達峰值,96h仍未恢復至正常水平,與人類及其他動物模型煙霧吸入后變化趨勢一致[6],提示煙霧吸入可致肺局部炎癥細胞聚集,繼而活化并釋放相關炎性因子﹑氧自由基等,最終導致炎癥反應的發生。病理組織學觀察結果與上述指標變化趨勢一致,至煙霧暴露后96h仍表現出典型的急性肺損傷的病理學特征。
綜上所述,采用本研究中的發煙裝置引燃10g火藥,并使大鼠在所產生的煙霧中暴露8min能夠成功構建吸入性肺損傷大鼠模型,且在實驗觀察時相內出現典型的急性肺損傷病理學特征,同時未見動物因窒息而死亡。本模型的成功構建為進一步研究火藥煙霧所致吸入性肺損傷的發病機制及防治措施奠定了基礎。
[1] Huang KL, Chen CW, Chu SJ, et al. Systemic inflammation caused by white smoke inhalation in a combat exercise[J]. Chest,2008, 133(3): 722-728.
[2] Feng L, Yue JX, Lan YT, et al. The role of ROS in human bronchial epithelial cell injury caused by gunpowder smoke[J].Labeled Immunoassays Clin Med, 2010, 17(1): 27-29.[馮亮, 樂家新, 蘭亞婷, 等. ROS在火藥煙霧致人支氣管上皮細胞損傷中的作用[J]. 標記免疫分析與臨床, 2010, 17(1): 27-29.]
[3] Lan X, Feng L, Liu Y, et al. In vitro study of injury on human bronchial epithelial cells caused by gunpowder somg[J]. Inhal Toxicol, 2013, 25(2): 118-125.
[4] Zhou M, Yao B, Yan SX, et al. Establishment of a rat model of inhalation lung injury induced by powder combustion[J]. Med J Chin PLA, 2005, 30(8): 734-737. [周敏, 姚斌, 嚴尚學, 等. 爆炸及火藥燃燒致吸入性肺損傷大鼠實驗模型的建立[J]. 解放軍醫學雜志, 2005, 30(8): 734-737.]
[5] Zhu F, Qiu XC, Wang JJ, et al. A rat model of smoke inhalation injury[J]. Inhal Toxicol, 2012, 24(6): 356-364.
[6] Matthew E, Warden G, Dedman J. A murine model of smoke inhalation[J]. Am J Physiol Lung Cell Mol Physiol, 2001,280(4): 716-723.
[7] Abolhassani M, Guais A, Chaumet-Riffaud P, et al. Carbon dioxide inhalation causes pulmonary in fl ammation[J]. Am J Physiol Lung Cell Mol Physiol, 2009, 296(4): 657-665.
[8] Zhou Y, Lan XM, Wang CB. Study on the secretion of IL-8 and IL-6 by bronchial epithelial cells (BEAS-2B) injured by black[J].Med J Chin PLA, 2012, 37(3): 260-262.[周瑩, 蘭曉梅, 王成彬.葛根素對火藥煙霧致支氣管上皮細胞損傷的防護效應[J].解放軍醫學雜志, 2012, 37(3): 260-262.]
[9] Lange M, Cox RA, Enkhbaatar P, et al. Predictive role of arterial carboxyhemoglobin concentrations in ovine burn and smoke inhalation-induced lung injury[J]. Exp Lung Res, 2011, 37(4):239-245.
[10] Qiu X, Li H, Tang H, et al. Hydrogen inhalation ameliorates lipopolysaccharide-induced acute lung injury in mice[J]. Int Immunopharmacol, 2011, 11(12): 2130-2137.

