干細胞治療終末期肝病的進展與挑戰
施明,劉振文,張政,王福生
肝移植是治療終末期肝病最有效的方法,但供肝來源短缺與肝移植需求之間的巨大差距促使人們努力尋求其他的替代療法。近來,干細胞治療終末期肝病越來越受到關注,特別是骨髓來源的干細胞[主要含造血干細胞(HSC)和間質干細胞(MSC)]治療已有體外和動物實驗支持,自體回輸骨髓干細胞治療亦有相關臨床報道。此外,其他來源的MSC治療肝病亦取得了較好進展。本文就此方面的研究進展綜述如下。
1 研究背景
干細胞根據其發育階段可分為胚胎干細胞(ES)和成體干細胞,其重要特征是具有無限自我更新能力,可以分化成特定組織,在細胞發育過程中處于較原始階段。骨髓是成體干細胞的重要來源,主要含HSC和MSC。MSC在骨髓中含量最多,在其他組織器官如臍帶組織﹑臍帶血﹑胎盤﹑外周血﹑脂肪組織中的含量也較豐富。基于干細胞強大的分化潛能,人們開始嘗試應用干細胞治療各種疾病。自1999年Petersen等[1]發現骨髓中某些干細胞具有向肝細胞分化的潛能以來,人們開始研究應用干細胞治療肝病的可行性,后來發現不同來源的干細胞如骨髓HSC﹑骨髓MSC等均可定向誘導分化為肝細胞樣細胞,具有正常肝細胞功能,如分泌尿素和白蛋白等[2],且得到動物實驗的驗證,臨床亦有自體回輸骨髓干細胞治療肝病的報道。目前開展的肝病治療研究的干細胞類型如圖1所示。
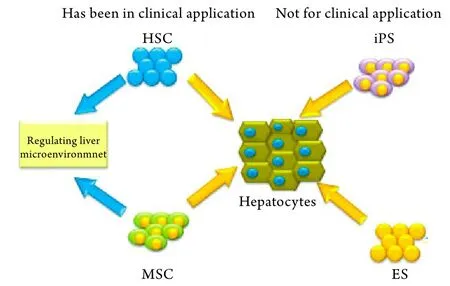
圖1 目前已經開展的治療肝病的干細胞類型及其治療機制Fig.1 Types of stem cells on current liver disease therapy and its mechanism
2 臨床前研究
2.1 骨髓干細胞治療肝病 以前認為只有具備HSC特性的細胞才能轉化為肝細胞,1999年Petersen等[1]發現骨髓干細胞或HSC能夠在鼠肝內轉化為肝卵圓細胞甚至成熟的肝細胞和膽管細胞。2000年Theise等[3]在異性間骨髓移植或肝移植的受體中也發現了源于供體的肝細胞和膽管細胞。Lagasse等[4]用正常小鼠骨髓細胞移植治療延胡索酰乙酰乙酸鹽水解酶缺乏(FAH-/-)導致的遺傳性Ⅰ型酪氨酸血癥小鼠,發現骨髓中只有HSC能在體內轉分化為肝細胞,并在受體內形成供體源造血和肝細胞再生,受體小鼠血液生化指標明顯改善。之后,人們嘗試應用粒細胞集落刺激因子(G-CSF)直接動員骨髓釋放干細胞來治療肝病。動物部分肝切除后應用G-CSF可以促進肝再生,其機制可能與血液中CD133+或CD34+細胞動員有關,且體外培養G-CSF動員后CD133+細胞可表達肝細胞特異性標志物[5]。為進一步驗證CD133+細胞對肝再生的促進作用,am Esch等[6]將分選出的自體骨髓CD133+細胞回輸至選擇性門靜脈栓塞的中央巨型肝臟腫瘤患者中,發現CD133+細胞移植組非栓塞部分肝臟體積明顯增大,有利于患者接受進一步手術。
Sakaida等[7]應用四氯化碳(CCl4)建立的小鼠肝纖維化模型進行研究發現,異體骨髓細胞移植能減輕肝纖維化程度,提高小鼠生存率。大鼠未受損的肝血竇內皮細胞上有HSC表面標志(CD45+和CD33+)及內皮細胞的表面標志(CD31+),肝血竇內皮細胞受損后,回輸骨髓來源的CD133+干細胞,在受體肝臟中可發現供體來源的肝血竇內皮細胞,替代了原來的受損細胞[8]。
也有部分學者對HSC向肝細胞分化的潛能及治療意義提出了質疑,他們應用動物的骨髓造血祖細胞在體外并不能誘導成功能性的肝細胞[9],應用轉基因的HSC研究發現,在體內只有極少部分HSC來源的肝細胞與受體的肝細胞形成融合細胞,幾乎沒有任何治療意義[10]。
2.2 MSC治療肝病 由于骨髓細胞成分復雜,何種細胞更適合用于肝細胞再生治療尚不清楚,但越來越多的研究傾向于骨髓MSC。Sato等[11]比較了人骨髓中的MSC﹑CD34+﹑非MSC/CD34–等3種細胞直接注射到大鼠肝內后轉分化成肝細胞的能力,結果骨髓MSC顯示出最強的向肝細胞分化的潛能。
在適當條件尤其是肝臟損傷的情況下,骨髓MSC可以分化為肝細胞樣細胞,這些分化細胞表現出成熟肝細胞的形態和特征,如表達肝細胞特異性基因,具有合成和分泌白蛋白﹑儲存糖原﹑代謝尿素及解毒功能等。Kuo等[12]應用人骨髓來源的MSC進行移植治療,使小鼠暴發型肝衰竭得到有效恢復,并促進了肝臟的再生。脂肪組織來源的MSC與骨髓來源的MSC相似,在體外可誘導成肝細胞樣細胞,將這些肝細胞樣細胞移植到CCl4肝損傷模型的小鼠體內,可整合入宿主的肝臟中,使其肝臟功能得到改善[13-14]。Van Poll等[15]應用D-半乳糖胺建立小鼠急性肝損傷模型,再輸入MSC條件培養基(MSC-CM),結果有效地減少了肝細胞壞死,促進了肝細胞增殖,并抑制了肝損傷標志物的釋放。Chamberlain等[16]將人MSC分別通過腹腔和肝內注射至胎羊中,發現經肝內途徑注射MSC后,人來源的肝細胞廣泛分布于肝實質中,而通過腹腔途徑注射MSC后,人來源的肝細胞主要分布于門靜脈周圍。用人羊水來源的MSC,以及由MSC誘導分化的肝祖細胞樣細胞和肝細胞樣細胞治療CCl4損傷的急性肝衰竭動物模型,結果羊水來源的MSC和肝祖細胞樣細胞取得了很好的治療效果,且回輸肝祖細胞樣細胞條件培養基也能取得較好效果[17]。人肝干細胞及其條件培養基對暴發性肝衰竭也有很好的保護作用,可通過分泌細胞因子抑制肝細胞凋亡,促進肝細胞再生[18]。最近國內有學者研究發現,通過門靜脈輸注人骨髓來源的MSC可提高急性肝衰竭豬的生存率,促進肝細胞再生[19]。
但同時也有研究表明,MSC不能在體外誘導成成熟的肝細胞,但可在體內分化為肝細胞,且免疫原性很低,是MSC治療肝病的良好細胞來源[20]。將人骨髓來源的MSC直接注入免疫抑制的肝臟損傷大鼠中,其分布只限于注射部位周圍,雖然可以分化成肝細胞,但分化效率很低,且供體的MSC并不與受體的肝細胞發生融合,MSC分化的肝細胞單純來源于供體MSC[11]。Arikura等[21]將先天性白蛋白缺乏癥大鼠行70%肝切除后植入正常大鼠骨髓MSC,4周后在受體肝臟中可檢測到表達白蛋白mRNA的肝細胞。
2.3 胚胎干細胞(ES)治療肝病 ES是指從囊胚期的內細胞團中分離出來的尚未分化的胚胎細胞,可分化形成各種類型的組織[22]。ES具有在體外無限增殖并保持分化成所有細胞類型的特性,理論上可以向3個胚層的任何類型細胞分化,其中也包括肝細胞[23-25]。已有研究表明ES對大鼠肝衰竭[26]和小鼠肝硬化[27]均有顯著療效。目前,有關ES研究的限制主要集中在倫理學﹑組織相容性以及移植后畸胎瘤發生等方面。
2.4 誘導多能干細胞(iPS)治療肝病 已有研究顯示iPS細胞可以誘導分化為肝細胞[28],也可將人原代肝細胞重編程為肝細胞來源的iPS細胞,此iPS細胞可定向誘導分化為內胚層細胞﹑肝祖細胞和成熟的肝細胞[29]。有研究發現小鼠iPS細胞可以在四倍體囊胚中發育成完整的胎肝,同時人iPS細胞可在體外誘導分化為具備相關功能的肝細胞樣細胞,這些細胞可以在小鼠的肝臟內增殖并整合到肝實質中[30]。最近發現應用三種轉錄因子(缺少轉錄因子c-Myc)的iPS細胞及其誘導的具肝細胞表型和功能的肝細胞樣細胞,均能減輕CCl4所致的急性肝損傷,提高動物生存率[31]。有研究者建立了以代謝性疾病患者真皮成纖維細胞制備的人iPS細胞系平臺,此iPS細胞系能誘導分化成具有肝細胞表型﹑基因型和功能的肝細胞樣細胞,顯示出較強的治療潛力[32]。利用iPS細胞治療肝病的具體療效及其安全性尚需在動物模型中進一步驗證。
3 臨床研究
3.1 HSC治療肝病的臨床研究 2000年Alison等[33]在移植了男性骨髓細胞的女性患者肝臟內發現了Y染色體陽性的肝細胞,2002年Korbling等[34]在移植了男性外周血干細胞的女性患者肝臟內也發現了來自男性的肝細胞,證明骨髓和外周血干細胞在人體內可以分化為肝細胞。骨髓干細胞治療可以通過G-CSF動員或直接抽取骨髓的方式進行。
3.1.1 G-CSF動員的骨髓干細胞 Gaia等[35]應用G-CSF動員骨髓干細胞治療終末期肝病,患者有較好的耐受性,部分患者Child和終末期肝病模型(MELD)評分改善,臨床癥狀好轉。Garg等[36]應用G-CSF動員骨髓CD34+干細胞治療慢加急性肝衰竭,結果患者耐受性良好,Child﹑MELD和序貫器官衰竭估計(SOFA)評分均顯著改善,生存率顯著提高。Levicar等[37]應用G-CSF動員骨髓,通過免疫磁珠分選外周血中的CD34+干細胞,并通過門靜脈或肝動脈回輸治療慢性肝衰竭,結果未發現短期和長期不良反應,患者的肝臟功能有一定程度改善。Salama等[38]應用G-CSF動員骨髓,而后通過收集外周血中的骨髓HSC治療終末期肝病,結果患者白蛋白升高,膽紅素和丙氨酸轉氨酶(ALT)下降,國際標準化比值(INR)恢復正常,所有患者均耐受。但也有報道通過門靜脈回輸自體骨髓CD133+細胞和單個核細胞治療失代償性肝硬化效果均不十分理想[39]。
3.1.2 未經動員的骨髓干細胞 Terai等[40]通過骨髓穿刺獲取骨髓干細胞后,經外周靜脈回輸治療肝硬化(包括失代償),在24周隨訪期內,患者血漿白蛋白水平明顯升高,Child評分明顯改善,肝臟活檢組織中甲胎蛋白(AFP)及增殖細胞核抗原(PCNA)水平明顯升高。Lyra等[41-42]分離終末期肝病患者骨髓單個核細胞后經肝動脈回輸,結果無明顯不良反應,患者Child﹑MELD評分明顯改善,血清總膽紅素下降,白蛋白升高,INR明顯下降,通過肝動脈回輸骨髓干細胞治療終末期肝病安全可行。Mohamadnejad等[43]采用抽取自體骨髓體外培養的方法,將富含干細胞標記的細胞亞群回輸至等待肝移植的患者,4例患者在等待期內均存活,1年內MELD評分有所改善。Kim等[44]應用自體骨髓干細胞(包括造血干細胞和上皮細胞等單核細胞)治療慢性乙肝相關的肝硬化患者,結果患者生活質量明顯改善,80%患者肝臟體積增大,腹水減少,Child評分改善,肝臟祖細胞(HPC)活性增強,可在6個月繼續分化成肝細胞,但肝硬化的臨床分級無明顯改善(表1)。
3.2 MSC治療肝病的臨床研究 Mohamadnejad等[43]最早報道應用自體骨髓MSC治療終末期肝病患者,經穿刺獲取骨髓后通過密度梯度離心獲得骨髓單個核細胞,在體外誘導成MSC后,經外周靜脈回輸至患者,經過12個月的隨訪,該方法安全無副作用,患者癥狀明顯改善,血漿白蛋白升高,腹水減少,肝體積增大,MELD評分改善。Khayaziha等[45]報道應用自體骨髓MSC經外周或門靜脈回輸治療由乙肝﹑丙肝﹑酒精性肝硬化及不明原因導致的終末期肝病患者,結果表明該方法安全無副作用,能提升血漿白蛋白,降低膽紅素水平,促進凝血酶原時間(PT)復常,改善MELD評分。近兩年Amer等[46]用骨髓MSC體外誘導成肝細胞樣細胞后進行自體回輸治療丙肝相關的終末期肝病,結果患者癥狀明顯改善,腹水減少,白蛋白顯著增加,Child和MELD評分改善。
國內學者最近應用MSC治療終末期肝病取得了較好進展。Peng等[47]應用自體骨髓MSC治療乙肝相關的肝衰竭患者,結果短期(4周)內患者白蛋白﹑PT水平明顯增加,而總膽紅素水平和MELD評分明顯下降,無明顯不良反應,但長期效果不明顯。Zhang等[48]應用臍帶MSC移植治療慢性乙肝相關失代償性肝硬化,結果患者腹水明顯減少,肝臟功能明顯改善,白蛋白增加,血清膽紅素水平和MELD評分明顯下降。Shi等[49]應用臍帶MSC移植治療慢性乙肝相關的慢加急性肝衰竭患者,結果發現可顯著提高患者生存率,改善MELD評分,增加白蛋白﹑膽堿酯酶﹑凝血酶原活動度水平,而總膽紅素和轉氨酶水平明顯下降。Wang等[50]采用臍帶MSC治療原發性膽汁性肝硬化患者,結果血清膽堿磷酸和γ-谷氨酰轉移酶水平明顯下降(表1)。
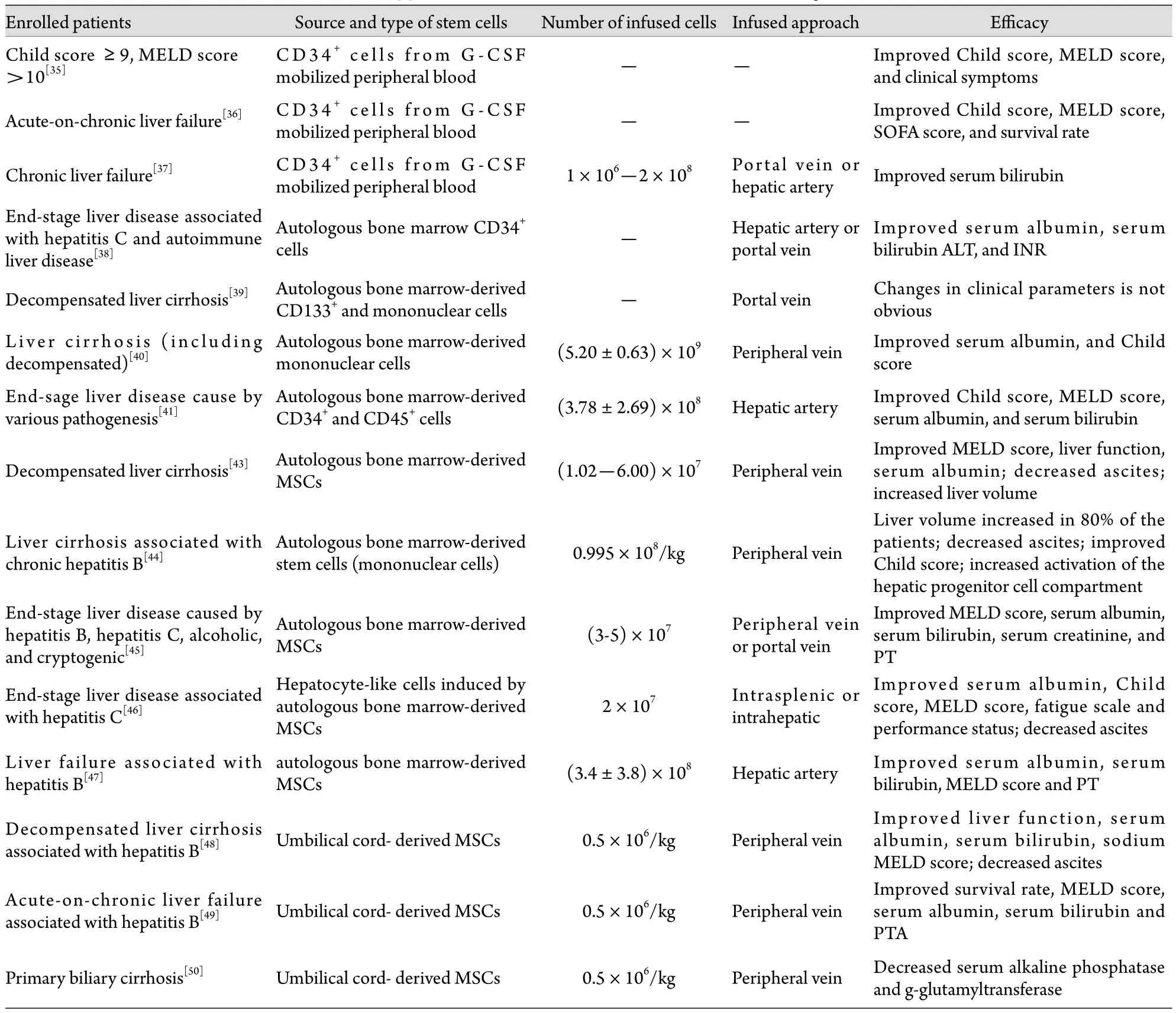
表1 干細胞治療終末期肝病的臨床應用情況Tab. 1 Clinical application of stem cells on treatment of end-stage liver disease
3.3 干細胞回輸與移植途徑 目前,干細胞治療肝病的主要移植途徑有外周循環移植﹑門靜脈移植﹑肝動脈移植等,現有的結果顯示安全性好,患者可耐受,無明顯不良反應。但也有報道經穿刺獲得骨髓后應用免疫磁珠分選出CD34+干細胞,經過肝動脈回輸,結果發生顯影劑性腎病,最后發展成1型肝腎綜合征[51]。因此,通過肝動脈回輸干細胞的安全性尚需進一步觀察。
3.4 療效評價及影響療效的因素 移植前的肝功能狀況直接影響干細胞移植的結局。Barba等[52]報道HSC移植前高膽紅素和高谷酰轉肽酶(GGT)水平可影響移植后病死率和生存率。現有肝功能改善的評價方法主要包括Child和MELD評分﹑血液生化﹑臨床表現﹑生活質量﹑生存時間(率),以及應用甲胎蛋白和PCNA評價肝細胞再生,利用TNF﹑IL-6和IL-10等評價肝臟炎癥環境的改善等[53]。利用磁性標記的大鼠MSC進行肝臟移植,再行磁共振成像活體示蹤,可在肝實質中發現標記的移植細胞[54]。肝組織活檢對評價肝再生及移植細胞狀態有重要意義,但有創性使其對終末期肝病患者的應用受到限制。一些無創或微創的活體內移植細胞示蹤方法如Y染色體探查等,可應用于不同性別間的細胞移植,放射性同位素標記移植細胞后應用核素顯像或PET-CT等也已有臨床報道[55]。這些方法均可在不同程度上說明移植細胞的存活和增殖情況,為評價干細胞移植的作用提供依據。
4 干細胞治療肝病的機制
4.1 干細胞歸巢功能 肝臟微環境改變是MSC歸巢的始動因素,肝組織損傷時存在炎癥反應,局部可表達及分泌多種趨化因子﹑黏附因子﹑生長因子﹑基質金屬蛋白酶9(MMP-9)等,這些因子與其受體的相互作用可引導干細胞特異性遷移至病損部位[56-58]。基質細胞衍生因子SDF-1及其受體CXCR4構成的SDF-1/CXCR4軸是引導MSC向損傷組織遷移的重要生物軸[59]。此外,肝細胞生長因子(HGF)及其受體c-met構成的HGF/c-met軸﹑G-CSF﹑血管內皮生長因子(VEGF)﹑MMP等均與MSC的歸巢有關[58,60-61]。還有研究認為,肝臟受損后肝臟環境中的鞘脂代謝物——鞘氨醇1-磷酸鹽(S1P)水平增高,且其與骨髓之間的濃度梯度差通過S1P3受體介導是骨髓MSC向肝臟歸巢的重要因素[62]。
4.2 干細胞分化功能 Petersen等[1]于1999年首先報道,在性別交叉骨髓細胞移植或全肝移植受體肝臟中發現來源于供體骨髓的肝細胞,隨后Alison等[33]和Theise等[3]相繼發現骨髓移植和肝移植患者的肝臟中也有來源于供體骨髓的肝細胞。Lagasse等[4]在延胡索酰乙酰乙酸水解酶(FAH)缺陷大鼠模型中發現骨髓HSC可在肝臟內分化為具有功能的肝細胞,改善FAH缺陷大鼠的癥狀。Schwartz等[63]也報道,從大鼠﹑小鼠和人的骨髓中分離得到多能成體祖細胞,體外經成纖維細胞生長因子(FGF)和HGF誘導可分化為功能肝細胞。骨髓中存在可分化為肝細胞的干細胞,直接將其移植到肝臟,在肝臟微環境下可分化為肝細胞。因此骨髓干細胞移植為多種嚴重肝病的治療提供了新的策略(圖1)。
MSC具有跨胚層多向分化潛能,在合適的條件下,如HGF﹑FGF﹑表皮生長因子(EGF)或制瘤素M(OSM)等誘導下,通過特定的細胞信號傳導途徑,可以跨胚層向內胚層的肝細胞樣細胞﹑膽管細胞和血管內皮樣細胞分化[64-66],而Notch/Jagged信號通路在此過程中可能起重要作用[67-68]。在此分化系統中,肝臟局部微環境,如細胞因子﹑細胞外基質(ECM)﹑激素﹑基質細胞等,是誘導MSC定向分化的決定因素,其中細胞因子的類型﹑濃度和添加次序是影響MSC分化的主要因素[69]。
4.3 干細胞旁分泌功能 以往認為,干細胞移植可提供大量肝細胞樣細胞替代受損的肝細胞功能,然而急性肝損傷所造成的疾病進展快,肝功能恢復不能依賴于干細胞分化為肝細胞過程,而更大程度上依賴其他機制,目前認為干細胞旁分泌機制改變組織微環境比向肝細胞的轉分化更重要[70]。如MSC可以分泌多種細胞因子﹑生長因子,發揮局部效應,促進受損肝臟增生及肝臟血管再生,抑制免疫細胞增殖及向肝臟遷移,調節肝臟及全身免疫炎癥反應,從而減輕肝臟的急性損傷,提高生存率[12,71-72]。MSC的條件培養基能抑制肝細胞的抗凋亡,刺激肝臟再生[15],機制可能與MSC的旁分泌功能一致,即為損傷的肝臟提供營養和有利的生存環境,因為蛋白質組分析顯示條件性培養基中含有許多抗炎癥因子,如IL-10﹑IL-1ra﹑IL-13和IL-27等[17],以及促進肝細胞再生﹑抑制肝細胞凋亡的細胞因子,如HGF﹑IL-10﹑VEGF﹑IL-6和IL-8等[18]。此外,研究還發現移植的骨髓MSC可通過釋放促細胞增生因子和MMP-9刺激內源性肝細胞再生[73-74]。
5 存在的問題與展望
基于干細胞具有自我更新﹑無限增殖的能力以及多向分化潛能的特性,將其應用于終末期肝病的臨床研究取得了令人鼓舞的進展,但干細胞治療終末期肝病的長期安全性(特別是致畸或癌變的風險)和遠期療效仍有待觀察,在療效評價方面如何檢測受體肝臟內移植細胞的狀態和功能,如何減少和避免排斥反應及其他不良反應,特別是MSC具有形成肝細胞或促進肝纖維化的雙刃劍作用[75],仍需進一步探討。此外,干細胞的來源﹑誘導培養條件﹑細胞質量控制(包括表型﹑功能﹑微生物安全)﹑使用時機﹑途徑和劑量﹑臨床適應證等都可能對治療的后果產生影響,這一系列與安全和療效密切相關的問題還須進一步深入研究。因此,要在闡明其機制的基礎上,不斷積累各方面的資料,明確其臨床應用的安全性和有效性,保證患者利益。
總之,干細胞強大的治療潛力有可能成為終末期肝病患者的有效治療手段,從而給患者帶來新的希望。
[1] Petersen BE, Bowen WC, Patrene KD, et al. Bone marrow as a potential source of hepatic oval cells[J]. Science, 1999,284(5417): 1168-1170.
[2] Jiang Y, Jahagirdar BN, Reinhardt RL, et al. Pluripotency of mesenchymal stem cells derived from adult marrow[J]. Nature,2002, 418(6893): 41-49.
[3] Theise ND, Nimmakayalu M, Gardner R, et al. Liver from bone marrow in humans[J]. Hepatology, 2000, 32(1): 11-16.
[4] Lagasse E, Connors H, AL-Dhaling M, et al. Purified hematopoietic stem cells can differentiate into hepatocytes in vivo[J]. Nat Med, 2000, 6 (11): 1229-1234.
[5] Gehling UM, Willems M, Dandri M, et al. Partial hepatectomy induces mobilization of a unique population of haematopoietic progenitor cells in human healthy liver donors[J]. J Hepatol,2005, 43(5): 845-853.
[6] am Esch JS 2nd, Knoefel WT, Klein M, et al. Portal application of autologous CD133+ bone marrow cells to the liver: a novel concept to support hepatic regeneration[J]. Stem Cells, 2005,23(4): 463-470.
[7] Sakaida I, Terai S, Yamamoto N, et al. Transplantation of bone marrow cells reduces CCl4-induced liver fibrosis in mice[J].Hepatology, 2004, 40(6): 1304-1311.
[8] Harb R, Xie G, Lutzko C, et al. Bone marrow progenitor cells repair rat hepatic sinusoidal endothelial cells after liver injury[J].Gastroenterology, 2009, 137(2): 704-712.
[9] Lian G, Wang C, Teng C, et al. Failure of hepatocyte marker expressing hematopoietic progenitor cells to efficiently convert into hepatocytes in vitro[J]. Exp Hematol, 2006, 34(3): 348-358.[10] Yamaguchi K, Itoh K, Masuda T, et al. In vivo selection of transduced hematopoietic stem cells and little evidence of their conversion into hepatocytes in vivo[J]. J Hepatol, 2006, 45(5):681-687.
[11] Sato Y, Araki H, Kato J, et al. Human mesenchymal stem cells xenografted directly to rat liver differentiated into hepatocytes without fusion[J]. Blood, 2005, 106(2): 756-763.
[12] Kuo TK, Hung SP, Chuang CH, et al. Stem cell therapy for liver disease: parameters governing the success of using bone marrow mesenchymal stem cells[J]. Gastroenterology, 2008, 134(7):2111-2121.
[13] Banas A, Teratani T, Yamamoto Y, et al. Adipose tissue-derived mesenchymal stem cells as a source of human hepatocytes[J].Hepatology, 2007, 46(1): 219-228.
[14] Taléns-Visconti R, Bonora A, Jover R, et al. Human mesenchymal stem cells from adipose tissue: differentiation into hepatic lineage[J]. Toxicol In Vitro, 2007, 21(2): 324-329.
[15] Van Poll D, Parekkadan B, Cho CH, et al. Mesenchymal stem cell derived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo[J]. Hepatology, 2008, 47(5):1634-1643.
[16] Chamberlain J, Yamagami T, Colletti E, et al. Efficient generation of human hepatocytes by the intrahepatic delivery of clonal human mesenchymal stem cells in fetal sheep[J]. Hepatology,2007, 46(6): 1935-1945.
[17] Zagoura DS, Roubelakis MG, Bitsika V, et al. Therapeutic potential of a distinct population of human amniotic fluid mesenchymal stem cells and their secreted molecules in mice with acute hepatic failure[J]. Gut, 2012, 61(6): 894-906.
[18] Sanchez MB, Fonsato V, Bruno S, et al. Human liver stem cells improve liver injury in a model of fulminant liver failure[J].Hepatology, 2013, 57(1): 311-319.
[19] Li J, Zhang LY, Xin JJ, et al. Immediate intraportal transplantation of human bone marrow mesenchymal stem cells prevents death from fulminant hepatic failure in pigs[J]. Hepatology, 2012,56(3): 1044-1052.
[20] Campard D, Lysy PA, Najimi M, et al. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells[J]. Gastroenterology, 2008, 134(3): 833-848.
[21] Arikura J, Inagaki M, Huilin g X, et al. Colonization of albuminprodusing hepatocytes derived from transplanted F344 rat bone marrow cells in the live of congenic Nagase's anabuminemic rats[J]. J Hepatol, 2004, 41(2): 215-221.
[22] Thomson JA, Itskovitz-Eldor J, Shapiro SS, et al. Embryonic stem cell lines derived from human blastocysts[J]. Science,1998, 282(5391): 1145-1147.
[23] Chinzei R, Tanaka Y, Shimizu-Saito K, et al. Embryoid body cells derived from amouse embryonic stem cell line show differentiation into functional hepatocytes[J]. Hepatology, 2002,36(1): 22-29.
[24] Yin Y, Lim YK, Salto-Tellez M, et al. AFP(+), ESC derived cells engraft and differentiate into hepatocytes in vivo[J]. Stem Cells,2002, 20(4): 338-346.
[25] Heo J, Factor VM, Uren T, et al. Hepatic precursors derived from murine embryonic stem cells contribute to regeneration of injured liver[J]. Hepatology, 2006, 44(6): 1478-1486.
[26] Miyazaki M, Hardjo M, Masaka T, et al. Isolation of a bone marrow-derived stem cell line with high proliferation potential and its application for preventing acute fatal liver failure[J].Stem Cells, 2007, 25(11): 2855-2863.
[27] Teratani T, Yamamoto H, Aoyagi K, et al. Direct hepatic fate specification from mouse embryonic stem cells[J]. Hepatology,2005, 41(4): 836-846.
[28] SullivanG J, Hay DC, Park IH, et al. Generation of functional human hepatic endoderm from human induced pluripotent stem cells[J]. Hepatology, 2010, 51(1): 329-335.
[29] Liu H, Ye Z, Kim Y, et al. Generation of endoderm derived human induced pluripotent stem cells from primary hepatocytes[J].Hepatology, 2010, 51(5): 1810-1819.
[30] Si-Tayeb K, Noto FK, Nagaoka M, et al. Highly efficient generation of human hepatocyte like cells from induced pluripoten t stem cells[J]. Hepatology, 2010, 51(1): 297-305.
[31] Chang HM, Liao YW, Chiang CH, et al. Improvement of carbon tetrachloride- induced acute hepatic failure by transplantation of induced pluripotent stem cells without reprogramming factor c-Myc[J]. Int J Mol Sci, 2012, 13(3): 3598-3617.
[32] Rashid ST, Corbineau S, Hannan N, et al. Modeling inherited metabolic disorders of the liver using human induced pluripotent stem cells[J]. J Clin Invest, 2010, 120(9): 3127-3136.
[33] Alison MR, Poulsom R, Jaffery R, et al. Hepatocytes from nonhepatic adult stem cells[J]. Nature, 2000, 406(6793): 257.
[34] Korbling M, Katz RL, Khanna A, et al. Hepatocytes and epithelial cells of donor origin in recipients of peripheral blood stem cells[J]. N Engl J Med, 2002, 346(10): 738-746.
[35] Gaia S, Smedile A, Omedè P, et al. Feasibility and safety of G-CSF administration to induce bone marrow-derived cells mobilization in patients with end stage liver disease[J]. J Hepatol, 2006,45(1): 13-19.
[36] Garg V, Garg H, Khan A, et al. Granulocyte colony-stimulating factor mobilizes CD34+cells and improves survival of patients with acute-on-chronic liver failure[J]. Gastroenterology, 2012,142(3):505-512.
[37] Levicar N, Pai M, Habib NA, et al. Long-term clinical results of autologous infusion of mobilized adult bone marrow derived CD34+ cells in patients with chronic liver disease[J]. Cell Prolif,2008, 41(Suppl1): 115-125.
[38] Salama H, Zekri AR, Zern M, et al. Autologous hematopoietic stem cell transplantation in 48 patients with end-stage chronic liver diseases[J]. Cell Transplant, 2010, 19(11): 1475-1486.
[39] Nikeghbalian S, Pournasr B, Aghdami N, et al. Autologous transplantation of bone marrow-derived mononuclear and CD133+ cells in patients with decompensated cirrhosis[J]. Arch Iranian Med, 2011, 14(1): 12-17.
[40] Terai S, Ishikawa T, Omori K, et al. Improved liver function in patients with liver cirrhosis after autologous bone marrow cell infusion therapy[J]. Stem Cells, 2006, 24(10): 2292-2298.
[41] Lyra AC, Soares MB, da Silva LF, et al. Infusion of autologous bone marrow mononuclear cells through hepatic artery results in a short-term improvement of liver function in patients with chronic liver disease: a pilot randomized controlled study[J].Eur J Gastroenterol Hepatol, 2010, 22(1): 33-42.
[42] Lyra AC, Soares MB, da Silva LF, et al. Feasibility and safety of autologous bone marrow mononuclear cell transplantation in patients with advanced chronic liver disease[J]. World J Gastroenterol, 2007, 13(7): 1067-1073.
[43] Mohamadnejad M, Alimoghaddam K, Mohyeddin-Bonab M,et al. Phase I trial of autologous bone marrow mesenchymal stem cell transplantation in patients with decompensated liver cirrhosis[J]. Arch Iranian Med, 2007, 10(4): 459-466.
[44] Kim JK, Park YN, Kim JS, et al. Autologous bone marrow infusion activates the progenitor cell compartment in patients with advanced liver cirrhosis[J]. Cell Transplant, 2010, 19(10):1237-1246.
[45] Khayaziha P, Hellstr?m PM, Noorinayer B, et al. Improvement of liver function in liver cirrhosis patients after autologous mesenchymal stem cell injection: a phase I-II clinical trial[J].Eur J Gastroenterol Hepatol, 2009, 21(10): 1199-1205.
[46] Amer ME, El-Sayed SZ, El-Kheir WA, et al. Clinical and laboratory evaluation of patients with end-stage liver cell failure injected with bone marrow-derived hepatocyte-like cells[J]. Eur J Gastroenterol Hepatol, 2011, 23(10): 936-941.
[47] Peng L, Xie DY, Lin BL, et al. Autologous bone marrow mesenchymal stem cell transplantation in liver failure patients caused by hepatitis B: short-term and long-term outcomes[J].Hepatology, 2011, 54(3): 820-828.
[48] Zhang Z, Lin H, Shi M, et al. Human umbilical cord mesenchymal stem cells improve liver function and ascites in decompensated liver cirrhosis patients[J]. J Gastroenterol Hepatol, 2012, 27(Suppl 2): 112-120.
[49] Shi M, Zhang Z, Xu RN, et al. Human mesenchymal stem cell transfusion is safe and improves liver function in acute-onchronic liver failure patients[J]. Stem Cells Transl Med, 2012,1(10): 725-731.
[50] Wang LF, Li J, Liu HH, et al. A pilot study of umbilical cordderived mesenchymal stem cell transfusion in patients with primary biliary cirrhosis[J]. J Gastroenterol Hepatol, 2013, 28 Suppl 1: (Proof).
[51] Mohamadnejad M, Namiri M, Bagheri M, et al. Phase 1 human trial of autologous bone marrow-hematopoietic stem cell transplantation in patients with decompensated cirrhosis[J].World J Gastroenterol, 2007, 13(24): 3359-3363.
[52] Barba P, Pinana JL, Fernandez-Aviles F, et al. Pretransplantation liver function impacts on the outcome of allogeneic hematopoietic stem cell transplantation: a study of 455 patients[J]. Biol Blood Marrow Transplant, 2011, 17(11): 1653-1661.
[53] Dinant S, Vetelainen RL, Florquin S, et al. IL-10 attenuates hepatic I/R injury and promotes hepatocyte proliferation[J]. J Surg Res, 2007, 141(2): 176-182.
[54] Cai J, Zhang X, Wang X, et al. In vivo MR imaging of magnetically labeled mesenchymal stem cells transplanted into rat liver through hepatic arterial injection[J]. Contrast Media Mol Imaging, 2008, 3(2): 61-66.
[55] Modo M, Meade TJ, Mitry RR. Liver cell labeling with MRI contrast agents[J].MethodsMol Biol, 2009, 481: 207-219.
[56] Honczarenko M, Le Y, Swierkowski M, et al. Human bone marrow stromal cells express a distinct set of biologically functional chemokine receptors[J]. Stem Cells, 2006, 24(4):1030-1041.
[57] Wang X, Montini E, Al-Dhalimy M, et al. Kinetics of liver repopulation after bone marrow transplantation[J]. Am J Pathol,2002, 161(2): 565-574.
[58] Kollet O, Shivtiel S, Chen YQ, et al. HGF, SDF-1, and MMP-9 are recruitment to the liver[J]. J Clin Invest, 2003, 112(2): 160-169.
[59] Kitaori T, Ito H, Schwarz EM, et al. Stromal cell-derived factor 1/CXCR4 signaling is critical for the recruitment of mesenchymal stem cells to the fracture site during skeletal repair in a mouse model[J]. Arthritis Rheum, 2009, 60(3): 813-823.
[60] Son BR, Marquez-Curtis LA, KuciaM, et al. Migration of bone marrow and cord blood mesenchymal stem cells in vitro is regulated by stromal-derived factor-1-CXCR4 and hepatocyte growth factor-c-met axes and involves matrix metalloproteinases[J]. Stem Cells, 2006, 24(5): 1254-1264.
[61] Lapidot T, Dar A, Kollet O. How do stem cells find their way home[J]? Blood, 2005, 106(6): 1901-1910.
[62] Li CY, Kong YX, Wang H, et al. Homing of bone marrow mesenchymal stem cells mediated by sphingosine 1-phosphate contributes to liver fibrosis[J]. J Hepatol, 2009, 50(6): 1174-1183.
[63] Schwartz RE, Reyes M, Koodie L, et al. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells[J]. J Clin Invest, 2002, 109(10): 1291-1302.
[64] Okuyama H, Krishnamachary B, Zhou YF, et al. Expression of vascular endothelial growth factor receptor 1 in bone marrowderived mesenchymal cells is dependent on hypoxia-inducible factor[J]. J Biol Chem, 2006, 281(22): 15554-15563.
[65] Aurich H, Sgodda M, Kaltwasser P, et al. Hepatocyte differentiation of mesenchymal stem cells from human adipose tissue in vitro promotes hepatic integration in vivo[J]. Gut, 2009,58 (4): 570-581.
[66] Campard D, Lysy PA, NajimiM, et al. Native umbilical cord matrix stem cells express hepatic markers and differentiate into hepatocyte-like cells[J]. Gastroenterology, 2008, 134(3): 833-848.
[67] Kohler C, BellA W, Bowen WC, et al. Expression of Notch-1 and its ligand Jagged-1 in rat liver during liver regeneration[J].Hepatology, 2004, 39(4): 1056-1065.
[68] Shafritz DA, Oertel M, Menthena A, et al. Liver stem cells and prospects for liver reconstitution by transplanted cells[J].Hepatology, 2006, 43 (2 Suppl 1): S89-S98.
[69] Moore KA, Lemischka IR. Stem cells and their niches[J].Science, 2006, 311(5769): 1880-1885.
[70] Phinney DG, Prockop DJ. Concise review: mesenchymal stem/multipotent st romal cells: the state of transdifferentiation and modes of tissue repair-current views[J]. Stem Cells, 2007,25(11): 2896-2902.
[71] Parekkadan B, van Poll D, Suganuma K, et al. Mesenchymal stem cell-derived molecules reverse fulminant hepatic failure[J]. PLos One, 2007, 2(9): e941.
[72] van Poll D, Parekkadan B, Cho CH, et al. Mesenchymal stem cellderived molecules directly modulate hepatocellular death and regeneration in vitro and in vivo[J]. Hepatology, 2008, 47(5):1634-1643.
[73] Nakamura T, Torimura T, Sakamoto M, et al. Significance and therapeutic potential of endothelial progenitor cell transplantation in a cirrhotic liver rat model[J].Gastroenterology, 2007, 133(1): 91-107.
[74] Taniguchi E, Kin M, Torimura T, et al. Endothelial progenitor cell transplantation improves the survival following liver injury in mice[J]. Gastroenterology, 2006, 130(2): 521-531.
[75] Bonzo LV, Ferrero I, Cravanzola C, et al. Human mesenchymal stem cells as a two-edged sword in hepatic regenerative medicine: engraftment and hepatocyte differentiation versus profibrogenic potential[J]. Gut, 2008, 57(2): 223-231.

