氟啶胺在土壤中的吸附解吸與淋溶特性
許秀瑩 ,宋穩成 ,王鳴華 * (.南京農業大學植物保護學院,江蘇 南京 0095;.農業部農藥檢定所,北京0006)
農藥在土壤環境中的行為和歸宿,包括遷移、滯留(吸附解吸、浸漬等)、轉化(生物、化學及光降解)是農藥環境安全性評價的重要內容,其中農藥在土壤-水環境中的吸附-解吸是影響其行為和歸宿的支配要素之一[1].
氟啶胺是由日本石原株式會社開發的2,6-二硝基苯胺類低毒殺菌劑,對交鏈孢屬、葡萄孢屬、食植性螨類和十字花科植物根腫病等均有良好預防效果[2-4],常用于防治辣椒疫病、馬鈴薯和番茄晚疫病[5].Draper等[6]表明,接觸環境殘留的氟啶胺可引發哮喘病和皮炎等破壞人類免疫系統的疾病.目前有關氟啶胺的環境行為的研究較少.駱愛蘭等[7-8]研究了氟啶胺對土壤中過氧化氫酶、蔗糖酶活性的影響,但氟啶胺在土壤中吸附解吸和遷移特性方面的研究還未見報道.
本文通過研究氟啶胺在 3種土壤中的吸附解吸和淋溶特性,為氟啶胺在土壤環境中的安全評價及合理使用提供科學依據.
1 材料與方法
1.1 試驗材料與儀器
氟啶胺標準品(質量分數 98.24%,農業部農藥檢定所).乙酸乙酯、乙腈、丙酮、氯化鈉、無水硫酸鈉均為分析純(南京化學試劑有限公司).Agilent7890A氣相色譜儀帶電子捕獲檢測器(μ-ECD)(美國 Agilent科技有限公司).R-200型旋轉蒸發儀(瑞士BUCHI公司).N-EVAP111型氮吹儀(美國Organomation公司).BS110S型電子天平(北京塞多利斯天平有限公司).MUL9000(A)-H-30型超純水系統(南京總馨純水設備有限公司).ZQLY-180恒溫振蕩培養箱(上海知楚儀器有限公司).
1.2 土壤樣品
供試土壤為江西紅壤、南京黃棕壤和東北黑土.土壤均采自大田表層 0~15cm 耕作層,對大田的用藥以及耕作歷史進行調查表明土壤未受污染,采回后自然風干碾磨,過2 mm篩后密封備用,基本理化性質表1.
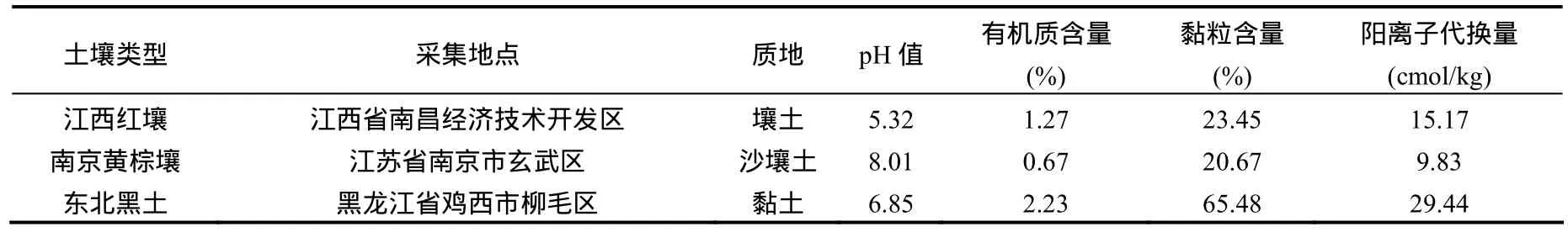
表1 供試土壤的理化性質Table 1 Physical and chemical properties of the test soils
1.3 試驗方法
1.3.1 吸附試驗 在一系列250mL具塞三角瓶中分別稱取2.0g供試土壤.吸附動力學試驗中每個三角瓶中加入50.0mL濃度為3.0mg/L的氟啶胺溶液(0.01mol/LCaCl2溶液配制),于恒溫振蕩器(25±1)℃以120r/min振蕩,分別于0, 0.5, 2, 4, 6,8, 12, 24h取土壤懸濁液于4000r/min離心10min,上清液加入40mL×2乙酸乙酯萃取2次,合并提取液,經無水硫酸鈉過濾至 150mL圓底燒瓶,旋轉蒸發儀濃縮近干,氮吹儀吹干,2mL丙酮定容,氣相色譜檢測.吸附等溫試驗以每個三角瓶中分別加入50mL濃度為0.05, 0.5, 1, 2.5, 5mg/L的氟啶胺溶液(0.01mol/LCaCl2溶液配制),于恒溫振蕩器(25±1)℃以120r/min振蕩24h.離心測定上清液中氟啶胺的濃度.
1.3.2 解吸試驗 將1.3.1離心后的土壤再加入與 1.3.1離心得到上清液相同體積的0.01mol/LCaCl2水溶液進行振蕩.解吸動力學試驗于0, 0.5, 2, 4, 6, 8, 12, 24h取樣分析.解吸等溫試驗于 24h后取樣.離心測定上清液中氟啶胺的濃度.
以上所有試驗均重復3次,同時設置未加土壤的農藥水溶液(0.01mol/LCaCl2介質)為空白對照.
1.3.3 土壤遷移試驗 稱取400g(±0.1g)過2mm篩的土壤,裝于塑料管中(內徑5cm、柱長35cm),裝成30cm高的土柱,在上端添加1cm厚的石英砂,柱中加水至土壤飽和持水量的60%.將0.5mL的氟啶胺 1000μg/mL的甲醇母液標樣加于土柱上層,蠕動泵 30mL/h的速度用 0.01mol/LCaCl2水溶液淋洗土柱10h.淋洗完畢后,收集淋出液,將土柱均勻切成 3段,分別測定各段土壤及淋出液中農藥含量.
1.4 色譜條件
色譜柱 DB-1701(30m×0.32mm×0.25μm)毛細管柱.進樣口溫度 250℃,進樣量:1μL.進樣模式:不分流.載氣(N2):1mL/min.尾吹氣:40mL/min.柱溫:起始 60℃,保留 1min,以30℃/min 升至 270℃,保留 5min.檢測器 300℃.氟啶胺在 0.05~10.00mg/L濃度范圍內線性良好,相關系數達0.9997.
水樣回收率測定:分別將50mL水與3種土壤各2g混勻,4000r/min離心10min,取上清液分別添加理論濃度為0.05, 0.5, 1, 5mg/L的氟啶胺水溶液,40mL×2乙酸乙酯萃取2次,合并提取液,經無水硫酸鈉過濾至150mL圓底燒瓶,旋轉蒸發儀濃縮近干,氮吹儀吹干丙酮定容氣相色譜檢測.每個添加濃度設3個平行,2組重復.
回收結果表明,基質水樣中,4個濃度的平均回收率為90%~95%,RSD<1%.
1.5 計算方法
根據我國“化學農藥環境安全評價試驗準則”[9]進行計算:
吸附率:A=100(M-Ce·V0)/M=100X/M(1)式中:A為吸附率;M為未加土壤的農藥水溶液平衡時農藥含量,mg;Ce為經土壤吸附平衡時水相中農藥濃度,mg/L;V0為水溶液體積,mL;X為吸附于土壤中的農藥量,mg.
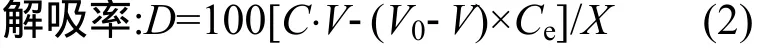
式中:D為解吸率;C為解吸液中農藥的質量濃度,mg/L;V為解吸試驗后水相體積,mL.
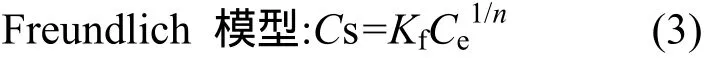
式中:Cs為吸附平衡時土壤吸附的氟啶胺濃度,mg/kg;Ce為平衡溶液中氟啶胺濃度,mg/L;Kf(mg1-1/n·L1/n/Kg)為吸附常數;1/n為吸附系數.
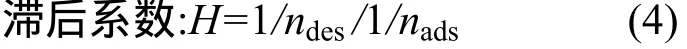
式中:nads為吸附經驗常數;ndes為解吸經驗常數.
有機質吸附常數(KOM)、吸附自由能(ΔG,KJ/mol)計算公式如下:
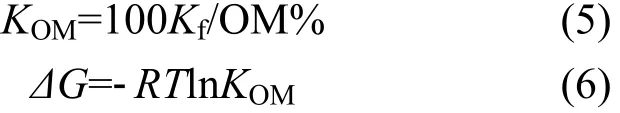
式中:R為氣體摩爾常數,8.314J/(K·mol);T為絕對溫度,K.
土柱淋溶:根據三段土壤及淋出液中的農藥含量,分別求出其占總量的百分比.

式中:Ri為各組分中農藥含量的比例,%;mi為各組分中農藥質量,mg;i=1,2,3,4,分別表示組分 0~10cm、10~20cm、20~30cm 土壤及淋出液;M為農藥添加總量,mg.
2 結果與討論
2.1 氟啶胺在土壤中的吸附-解吸動力學特性
質量平衡試驗表明,在振蕩的 24h內未發現氟啶胺因微生物分解、水解或光解而明顯降解.
土壤對有機物的吸附可分為快速反應階段和慢速平衡階段[10].由圖1可知,氟啶胺與土壤溶液接觸1h可以完成快速吸附階段,溶液中氟啶胺的比例急劇降低,2~12h為慢速平衡階段,12~24h間,溶液中氟啶胺的濃度保持一致,此時可認為吸附已達到平衡,因此,確定平衡時間為24h.吸附與解吸是性質相反的過程,吸附越快則解吸越慢,如圖2所示,3種土壤解吸在8h左右達到平衡.為保證氟啶胺在土壤中的吸附與解吸達到完全平衡,試驗統一確定24h作為平衡時間.
吸附動力學試驗結果表明,氟啶胺在 3種土壤中的吸附能力順序是:東北黑土>江西紅壤>南京黃棕壤;其吸附率分別為 90.34%、78.21%、70.09%.
解吸動力學試驗結果表明,氟啶胺在 3種土壤中的解吸能力順序是:南京黃棕壤>江西紅壤>東北黑土,即吸附能力越強則解吸能力越弱.
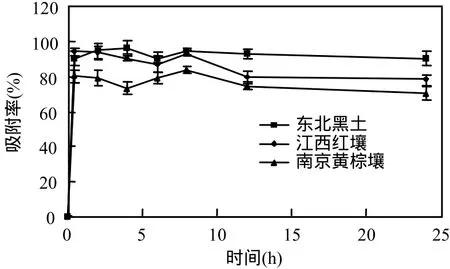
圖1 吸附時間與吸附率的關系Fig.1 Relationship between adsorption rate and adsorption time

圖2 解吸時間與解吸率的關系Fig.2 Relationship between desorption rate and desorption time
2.2 氟啶胺在土壤中的等溫吸附特性
將試驗數據采用吸附模型擬合.結果表明氟啶胺的吸附等溫線符合 Freundlich方程(表2).Kozak等[11]發現土壤中的有機質含量對農藥的吸附-解吸起著重要的作用,尤其是非離子型農藥.一般情況下,OM 含量高,吸附越強.氟啶胺在3種土壤中的吸附常數分別為:東北黑土 311.88,江西紅壤 202.23,南京黃棕壤 119.34,將吸附常數與與土壤有機質含量、土壤陽離子交換量、黏粒含量以及 pH值進行回歸分析,得到回歸方程分別為Y=122.57X+40.782,R2=0.9973;Y= 9.3774X+40.981,R2=0.9690;Y=3.5606X+81.07,R2=0.8586;Y=-25.503X+382.7,R2=0.1269.結果表明土壤有機質含量、陽離子代換量和黏粒含量與吸附系數有良好的相關性,而pH值與吸附系數相關性較差.
有研究表明[12],n值的大小與土壤有機質的均勻性、土壤吸附位點的分布、土壤的硬度、土壤有機質的熟化程度均有關,n值越低,土壤吸附位點的分布越復雜,有機質熟化程度越高.由表 2可以看出,東北黑土的土壤有機質熟化程度高,吸附位點的分布更復雜.
氟啶胺在 3種土壤中的吸附等溫線見圖 3.通常吸附等溫線有 3種類型即 S、L、H型.Calvet[13]研究表明,Freundlich等溫吸附方程中,1/nads通常可以用來表示吸附過程的強烈程度,吸附機理不同是產生這種吸附強烈程度差異的原因,當 1/nads>1,該類等溫吸附線屬于 S型,表明在低濃度的情況下,與土壤的親合力比與水相的親和力要弱,隨著濃度的增加,與土壤親合力增加,吸附增加;而如果 1/nads<1,該類等溫吸附線屬于L型,表明在較低濃度下與土壤的親和力比對水的親和力要強,而隨著濃度的增加,與土壤的親和力降低,吸附減弱.圖3可以看出,氟啶胺在南京黃棕壤上有較高的親和力,隨著吸附位點被連續占領,尋找吸附位點越來越困難,因此隨著濃度的增加,吸附平衡濃度趨于平緩.在東北黑土和江西紅壤的吸附等溫線為 S型,表明氟啶胺在較低濃度下與水分子有較強的親和力,隨著濃度增加與土壤親和力增強.

表2 氟啶胺在三種土壤中的吸附解吸參數Table 2 The adsorption-desorption parameters of fluazinam in three soils
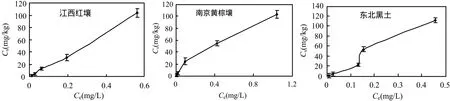
圖3 氟啶胺在三種土壤中的吸附等溫線Fig.3 Adsorption isotherms of fluazinam in three soils
2.3 氟啶胺在土壤中的等溫解吸特性
Barriuso等[14]把吸附與解吸的不可逆現象定義為解吸的滯后效應.Cox[15]把滯后作用定義為吸附-解吸等溫線擬合參數n值的百分比,用H(Hysteretic Index)表 示 .O’Connor 等[16]用Freundlich方程中擬合參數1/ndes/1/nads比值作為滯后程度指標.1/ndes/1/nads=1表示無滯后效應;1/ndes/1/nads<1表示正滯后效應;1/ndes/1/nads>1表示負滯后效應.由表2結果可知,氟啶胺在黑土和黃棕壤中的解吸為正滯后作用,紅壤中為無滯后作用.這種差異可能與土壤的理化性質及吸附解吸機制有關,有待進一步驗證.
2.4 氟啶胺在土壤中的吸附自由能
土壤吸附自由能(ΔG)的大小是反映土壤吸附特性的重要參數,根據其大小可以推斷土壤吸附的機制,當吸附自由能變化|ΔG|<40kJ/mol時為物理吸附;反之為化學吸附.物理吸附的吸附平衡速率較快,吸附是可逆過程;而化學吸附的吸附平衡速率較慢,吸附是不可逆過程.
由表 2可以看出,3種土壤對氟啶胺農藥的吸附的自由能變化均為負值,表示土壤對農藥的吸附為放熱反應,降低溫度有利吸附作用進行;3種土壤對氟啶胺的吸附的自由能變化均小于40kJ/mol,因此均屬于物理吸附,即其吸附主要發生在土壤表面.
2.5 氟啶胺在土壤中的淋溶特性
淋溶作用是指農藥隨滲透水在土壤中垂直向下的過程,是農藥與水-土壤顆粒之間吸附-解吸和分配的一種綜合行為,農藥的移動性強弱是評價農藥對地下水安全性的重要依據之一.實驗室常采用土柱淋溶法模擬自然界土壤中農藥的遷移情況.結果表明氟啶胺在南京黃棕壤中移動性略強于東北黑土和江西紅壤.在 0~10cm 土柱段氟啶胺含量東北黑土中為88.68%,江西紅壤中為80.76%,南京黃棕壤中為 0;10~20cm土柱段氟啶胺含量東北黑土中為11.32%,江西紅壤中為19.24%,南京黃棕壤中為 76.05%;20~30cm 土柱段氟啶胺含量東北黑土和江西紅壤中為0,南京黃棕壤中為23.95%.根據各段土柱中農藥的百分含量可將農藥的移動性能進行等級劃分,東北黑土和江西紅壤屬難淋溶等級,南京黃棕壤屬較難淋溶等級[9].
3 結論
3.1 批量平衡法結果表明,氟啶胺在3種土壤中的吸附能力大小順序為東北黑土>江西紅壤>南京黃棕壤,解吸能力相反,吸附以物理吸附為主.
3.2 氟啶胺在3種土壤中的吸附常數分別為:南京黃棕壤 119.34,江西紅壤 202.23,東北黑土311.88,與土壤有機質含量、陽離子代換量和粘粒含量有良好的相關性.
3.3 氟啶胺在南京黃棕壤上的等溫吸附曲線呈L型,在東北黑土和江西紅壤的吸附等溫線為 S型.在東北黑土中屬易吸附,江西紅壤和南京黃棕壤屬較易吸附.
3.4 氟啶胺在江西紅壤和東北黑土中難淋溶,南京黃棕壤較難淋溶.
[1]歐曉明,張 俐,裴 暉,等.新農藥硫肟醚在土壤中的降解 [J].中國環境科學, 2005,25(6):705-709.
[2]Johnson D A, Atallah Z K.Timing fungicide applications for managing sclerotinia stem rot of potato [J]. Plant Disease,2006,90(6):755-758.
[3]Matheron M E, Porchas M. Comparative ability of six fungicides to inhibit development of phytophthora gummosis on citrus [J].Plant Disease, 2002,86(6):687-690.
[4]Mitani S, Sugimoto K, Hayashi H, et al. Effects of cyazofamid againstPlasmodiophora brassicae Woroninon Chinese cabbage[J]. Pest Management Science, 2003,59(3):287-293.
[5]Dowley L J, O′ Sullivan E. Activity of fluazinam against late blight of potatoes [J]. Irish Journal of Agricultural and Food Research, 1995,34(1):33-37.
[6]Draper A, Cullinan P, Campbell C, et al. Occupational asthma from fungicides fluazinam and chlorothalonil [J]. Occupational and Environmental Medicine, 2003,60(1):76-77.
[7]駱愛蘭,余向陽.氟啶胺對土壤中蔗糖酶活性及呼吸作用的影響[J]. 中國生態農業學報, 2011,19(4):902-906.
[8]駱愛蘭,余向陽.氟啶胺脅迫對土壤過氧化氫酶活性的影響 [J].江蘇農業科學, 2011,39(6):478-480.
[9]化學農藥環境安全評價試驗準則 [S].
[10]趙俊嶺.農藥西維因在土壤上的吸附行為機理研究 [D]. 北京:北京交通大學, 2008.
[11]Kozak J, Weber J B, Sheets T J. Adsorption of prometryn and metolachlor by selected soil organic matter fractions [J]. Soil Science, 1983, 136(2):94.
[12]Tang Z W, Zhang W, Chen Y M. Adsorption and desorption characteristics of monosulfuron in Chinese soils [J]. Journal of Hazardous Materials, 2009,166(2/3):1351-1356.
[13]Calvet R. Adsorption of organic chemicals in soil [J].Environmental Health Perspectives, 1989,83:145-177.
[14]Barriuso E, Laird D A, Koskinen W C, et al. Atrazine desorption from smectites [J]. Soil Science Society of American Journal,1994,58(6):1632-1638.
[15]Cox L. Sorption-desorption of imidacloprid and its metabolites in soils [J]. Journal of Agricultural and Food Chemistry, 1997,45(4):1468-1472.
[16]O′Connor G A, Wierenga P J, Cheng H H, et al. Movement of 2, 4,5-T through large soil columns [J]. Soil Socience, 1980,130(3):157-162.

