四溴雙酚A在鯽魚不同器官中的分布、富集及病理研究
楊蘇文,徐范范,趙明東 (中國環境科學研究院湖泊生態環境研究中心,環境基準與風險評估國家重點實驗室,北京 100012)
四溴雙酚 A(TBBPA)是世界范圍內被廣泛應用的溴代阻燃劑,主要通過塑料和電子產品的制造與加工處置和循環利用過程進入環境[1],目前已在土壤、水體、沉積物和大氣等環境介質以及人體內檢測到[2-8].TBBPA的水環境暴露水平日益升高,對水生生物具有潛在毒害影響.
環境污染物對水生生物的毒性效應是進行毒性效應研究及生態風險評價的基礎.鯽魚是分布于我國大部分地區的經濟性魚類,為本土物種,對TBBPA毒性效應及生態系統風險評價研究具有廣泛代表性,目前已被普遍應用于生態毒理學方面的研究,但有關 TBBPA在魚體中組織分布和富集效應的研究還較鮮見[9].因此本研究以鯽魚(Carassius auratus)為受試生物,通過分布動力學定量地確定魚體各組織器官中 TBBPA含量,研究TBBPA在魚體肝臟、腎臟、鰓和肌肉中的吸收與富集效應,結合不同暴露時間鯽魚肝臟、腎臟、鰓、性腺的組織病理學,以期初步確定TBBPA在鯽魚體內的分布特征及作用靶器官,為闡明TBBPA的毒性效應機制機理及生態風險評價提供參考.
1 材料與方法
1.1 組織分布與生物富集實驗方法
1.1.1 實驗動物 鯽魚(Carassius auratus)購于北京市通州區花鳥魚蟲市場,體長為(6.95±1.05)cm,體重為(5.90±0.80)g,在室內馴化 2 周,死亡率穩定在 1%~2%以下,試驗用水為自來水,室內靜置 48h 去氯,溫度(25±1)℃,光周期為 14h:10h,溶液 氧 為 (7.5±0.5)mg/L,pH 值 (7.8±0.2),水 硬 度(109±10)mg/L (以 CaCO3計).
1.1.2 實驗方法 TBBPA工業品(97%)為美國Alfa Aesar公司進口,采用乙醇作為助溶劑配制50mg/mL的儲備液備用.將360條鯽魚隨機放入盛有60L處理液的玻璃缸內,每缸30條魚,根據TBBPA對鯽魚的 96h-LC50值[10]及慢性毒性實驗濃度設置的一般規則[11-12],設定亞致死處理濃度為 0.5mg/L和2.0mg/L,24h更換一次相同濃度的處理液,并以助溶劑乙醇處理的魚作對照,實驗期間每天喂食1次.實驗周期為32d[13].在暴露時間分別為2,4,8,16,32d取樣,進行前處理后(方法參見文獻[9]),HPLC測定肝臟、腎臟、鰓和肌肉中TBBPA含量,并利用公式計算生物富集系數(公式見2.2節).
1.2 組織病理切片實驗方法
1.2.1 實驗儀器 Thermo Shandon Excelsior組織處理機,TKY-BMB,湖北泰康醫療設備有限公司石蠟包埋機,Leica RM2235型切片機,Thermo Shandon Varistain Gemini 全自動染片機,Thermo Shandon Consul 全自動封片機,德高 Zeiss Imager. M1顯微鏡.
1.2.2 實驗方法 暴露實驗第2,4,8,16,32d每次隨機取10尾鯽魚.取鯽魚肝臟、腎臟、鰓、精巢和卵巢組織放置于4%甲醛溶液中固定24h,固定后的組織在清水沖洗15h以上,經50%~100%各級乙醇梯度脫水,2:1、1:1、1:2的二甲苯/石蠟和全石蠟逐級滲透,最后包埋于切片用石蠟中,制成組織蠟塊.將埋有組織的蠟塊固定在切片機上,7μm 切片,用明膠甘油將組織薄片貼于載玻片上,37℃烘干.組織切片經二甲苯脫蠟和70%~ 100%各級乙醇梯度脫水,用蘇木精染色,經過1%鹽酸分化和0.1%氨水顯色后,再經50%~90%各級乙醇梯度脫水,用0.5%酒精伊紅(95%酒精配制)染色,95%和 100%的乙醇進一步脫水,最后用中性樹膠封片.顯微鏡下觀測并拍照,采用Photoshop軟件進行圖像處理和分析.觀察各染毒組中甲狀腺濾泡上皮厚度、細胞肥大和增生、膠質減少和濾泡上皮細胞周圍血管增生等病變現象.
1.3 數據分析
數據采用origin 7.5和sigma Plot 10.0處理.
2 結果與分析
2.1 TBBPA在鯽魚不同器官的組織分布
由圖1可見,鯽魚肝臟組織在第8d出現吸收高峰,隨后下降,其中0.5mg/L暴露組32d TBBPA的濃度低于第2d的濃度,而2.0mg/L暴露組32d后的肝組織濃度為第 2d濃度的 4.1倍,達到146.61ng/g.0.5mg/L組腎臟組織在4d達到最大值,隨后逐步降低,32d時濃度稍高于第 2d,為對照的4.5倍.2.0mg/L組在第8d達到最大值,32d時濃度為第2d濃度的3.4倍,為對照組的7.3倍.0.5mg/L組的肌肉組織中TBBPA含量隨暴露時間延長緩慢升高,高濃度組在第8d出現吸收高峰,后快速下降,在暴露終點又顯著回升,為對照組的4倍.低濃度組鰓中TBBPA隨時間變化幅度較小,第32d與對照組極為接近,高濃度組第 4d時出現吸收高峰,32d時為對照組的5.2倍.
結果顯示,各濃度組肝臟和腎臟 TBBPA含量都表現出先升高后下降的趨勢,鰓和肌肉在0.5mg/L時TBBPA含量變化不大,高濃度時先升高后下降,肌肉在暴露后期又出現升高趨勢.
2.2 TBBPA在鯽魚不同組織器官的生物富集
根據時間(x)和TBBPA在鯽魚不同組織器官的濃度(y)擬合得到式(1),符合毒代動力學一級吸收模型,根據所得方程得到各個參數見表1,TBBPA暴露實驗中各器官組織富集系數(a)隨暴露時間的變化見圖2.
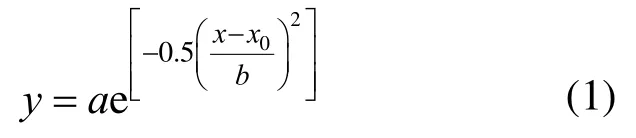
式中:y為TBBPA在鯽魚不同組織器官的濃度;x為暴露時間;擬合公式后得到參數a,b,x0,其中,a為各器官組織富集系數;x0為相應變化時間.
結果顯示,各器官富集系數隨暴露時間的延長先升高再逐漸減小.在實驗濃度下肝臟富集系數相近,最大富集系數為 395,均落在 10~11d之間;0.5mg/LTBBPA組鯽魚腎臟的最大富集系數為 945,2.0mg/L組腎臟的富集系數遠小于0.5mg/L處理組,表明鯽魚腎臟功能可能受損不能執行正常的排泄和解毒機能.2.0mg/L組鯽魚鰓的富集系數顯著高于 0.5mg/L組,最大富集系數為72,時間為10.26d,肌肉富集系數變化不大.
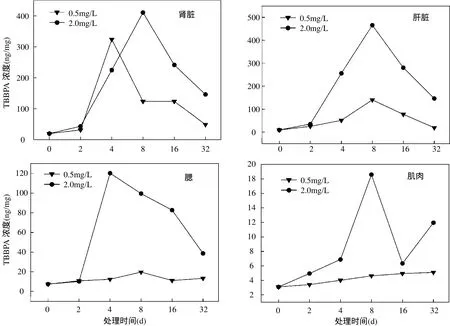
圖1 TBBPA在鯽魚不同器官的組織分布Fig.1 Tissue distribution of TBBPA in Carassius auratus
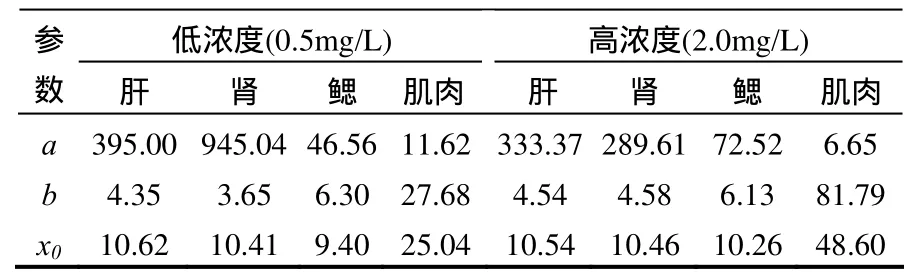
表1 鯽魚各器官的富集系數及參數Table 1 Bioaccumulation factor and the parameters in
2.3 TBBPA暴露對鯽魚器官組織的組織病理變化
對照組肝組織切片(圖3A)的肝細胞呈多角型,細胞核大而圓,核仁居中,胞質染色深,細胞膜界限清晰.暴露后2d,肝細胞輕微腫脹,胞質淡染,部分細胞空泡化,單位面積內肝細胞數量減少.暴露后 4~8d,肝細胞腫脹嚴重,肝細胞索狀結構破壞,肝細胞彌散.暴露后 16d,肝細胞索狀結構消失,部分細胞的胞膜破裂、溶解,胞漿基質變淡,胞核高度濃縮,有的甚至核仁都不可見,發現色素沉積物.暴露后32d(圖3B),肝細胞腫脹擴展到整個肝,細胞基質大量丟失,胞核固縮(壞死),高濃度組中發現大量色素沉積物,經普魯士藍染色證實為含鐵血黃素沉積物.實驗中暴露TBBPA后,鯽魚肝臟表現出時間-劑量依賴性的病理損傷,具體分析見表 2,說明肝臟可能是TBBPA作用的靶器官.
對照組腎組織切片(圖 3C)的正常腎小體為一圓囊結構,腎小球是一團毛細血管,腎小囊包在腎小球外面,兩層之間為腎小囊腔.暴露后 2~4d,腎小管中有彌散的色素沉積,部分腎小球毛細血管明顯萎縮,甚至壞死,并在腎小管上皮細胞內發現少量色素沉積物.暴露后 8~16d,腎小球毛細血管明顯萎縮,腎小囊腔變寬,腎小球及其附近區域發現大片的色素沉積物,腎小管上皮細胞中色素沉積增多.暴露后32d(圖3D),腎小球囊內大片的色素沉積,可能為壞死的腎小球毛細血管球殘骸,經普魯士藍染色證明是含鐵血黃素.暴露TBBPA后腎臟的病變呈時間依賴性增長,具體分析見表3,主要表現為腎小球毛細血管萎縮、壞死,腎小囊腔變寬,腎小球及腎小管上皮細胞內色素沉積增多,但兩劑量組之間差異不顯著.
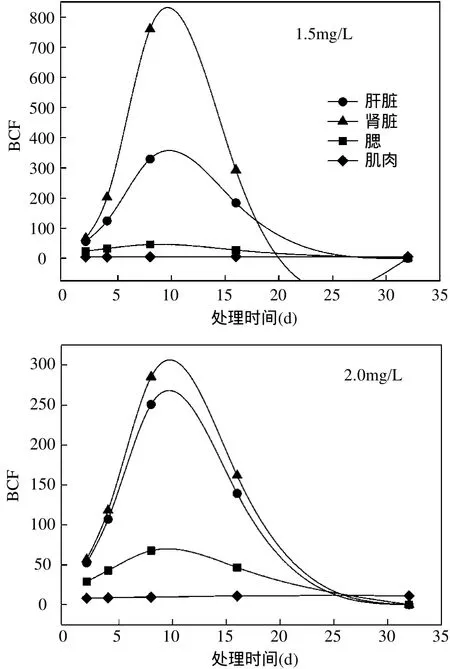
圖2 長期暴露后TBBPA在鯽魚不同器官組織的生物富集系數(BCF)變化Fig.2 Bioconcentration factor (BCF) of TBBPA in different tissues of Carassius auratus after longterm exposure
對照組鰓絲切片(圖 3E)結構完整清晰,鰓小片排列整齊有序.暴露后 2~4d,鰓切片中觀察到鰓小片上皮細胞輕度增生,部分還伴有鰓小片細胞的脫落,使鄰近鰓小片相互粘連.暴露后 8~6d,鰓小片上皮細胞增生加劇,部分鰓小片扭曲、細胞脫落.暴露后 32d(圖 3F),在兩劑量組均可觀察到鰓小片大量融合.
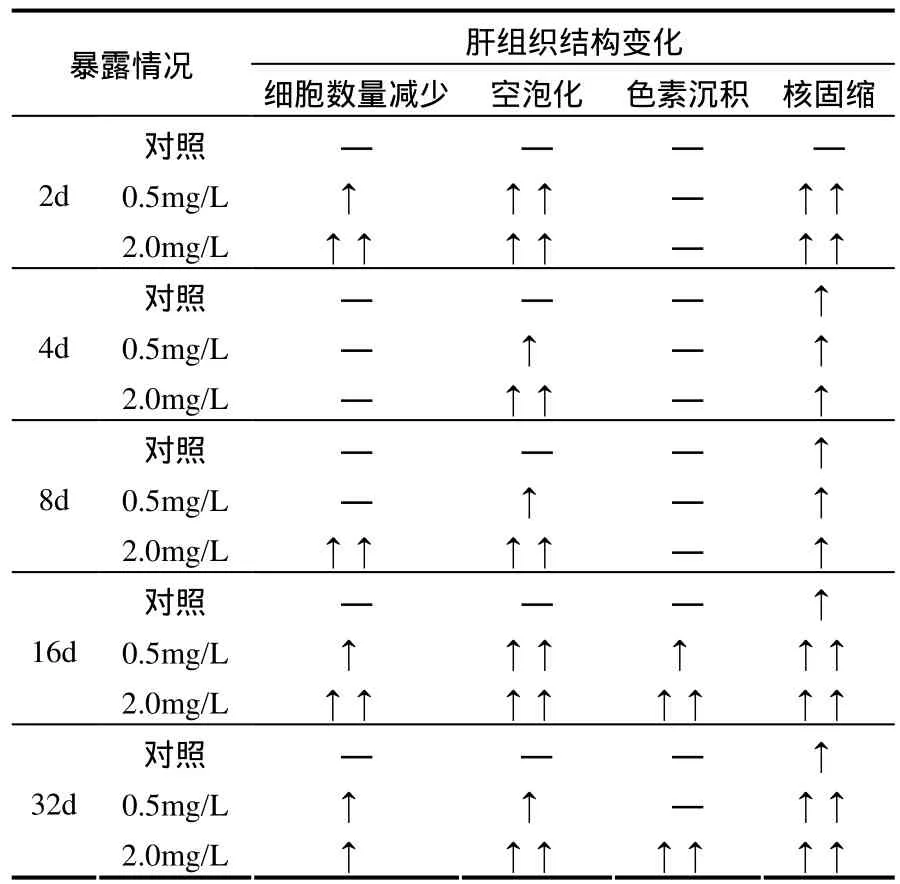
表2 鯽魚肝組織結構隨暴露時間變化Table 2 Liver structure changes of Carassius auratus with time in chronic exposure test

表3 鯽魚腎組織結構隨暴露時間變化Table 3 Kidney structure changes of Carassius auratus with time in chronic exposure test
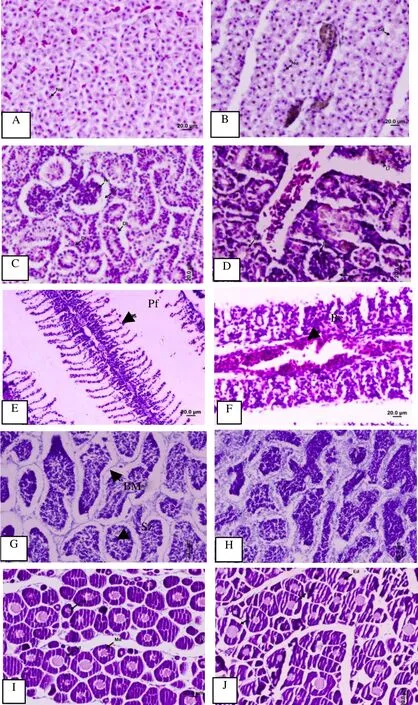
圖3 鯽魚TBBPA暴露的器官組織病理觀察Fig.3 Observation of histopathology exposured TBBPA in Carassius auratus
對照組精巢切片(圖 3G)可見排列整齊完整的精小葉,精小葉腔內充滿大量的精子細胞,核圓形,較致密,聚集在一起形成大的團塊.暴露后 2~4d,精小葉排列混亂,基膜局部溶解,間質細胞增多.暴露后8~16d,精小葉基膜部分溶解,小葉間質進一步擴大.暴露后 32d(圖 3H),精小葉基膜相互溶解,精子聚集在一起形成大的團塊,基膜外間質細胞局部增多.
對照組和兩劑量組卵巢切片觀察(圖3I,J),卵母細胞呈圓形、橢圓形或多角形,細胞質嗜堿性,核淺藍色,位于細胞中央.核仁沿核膜內緣分布.經對比發現,對照組與處理組未見異常現象.
3 討論
肝臟是生物體最主要的物質代謝場所和解毒器官,污染物易造成肝臟的脂肪化和細胞擴增等組織損傷[14],還可造成線粒體囊泡化和細胞核損傷等超微結構的變化[15].組織學研究表明,TBBPA能引起孕期小鼠的肝臟損傷[16].本研究結果表明,TBBPA暴露對肝臟表現為時間-劑量依賴性關系,同時病理切片顯示,鯽魚肝細胞空泡變性,細胞核膜破裂、核仁溶解消失,部分肝細胞壞死,表明 TBBPA蓄積對肝臟具有較強毒害作用[17-19].陳瑪麗等[20]發現 TBBPA 低劑量(0.025,0.25mg/L)暴露12周能夠引起紅鯽肝臟脂肪化、空泡化和線粒體囊泡化等現象,而高劑量暴露還導致肝臟細胞核損傷和細胞間隙增大等現象,造成紅鯽肝臟的損傷.這可能與污染物通過引起肝臟的物質代謝紊亂[20],或者通過誘導活性氧的產生導致肝臟細胞代謝增強, 進而引起肝臟中物質代謝紊亂[21-24]有關.
腎臟是魚體最重要的毒物排泄器官,腎功能受損時,以腎臟作為主要去除途徑的毒物消除速度減慢,可產生蓄積和病變,排泄 TBBPA 機能受損,導致血液 TBBPA含量升高使血流不豐富的肌肉組織也出現 TBBPA的積累現象.Schauer等[25]在研究小鼠一次口服300mg TBBPA/kg bw的代謝動力學時發現,TBBPA在小鼠體內的代謝半衰期為13h,由于TBBPA與谷胱甘肽等生物轉化酶或發生硫化反應使其生物利用性降低,TBBPA對機體的損害是通過與受體或酶的結合進行的.而 kang等[26]研究發現小鼠完全排泄TBBPA需要2d,TBBPA不會在體內積累,對腎臟沒有損傷.本研究表明低濃度 TBBPA暴露鯽魚肝臟和腎臟可正常代謝,高濃度組則代謝受阻.這可能與 TBBPA隨血液進入腎臟后,自由基對細胞中的各種酶造成損傷,使魚類機體抗氧化系統損傷所致[27-28],產生蓄積和病變,排泄機能受損有關.
本研究中鯽魚精巢的病理損傷嚴重,精小葉基膜破裂,這可能導致小葉內部環境的紊亂,激素營養物質的平衡受到破壞,不利于精子的成熟和發育,這一結論與陳瑪麗[29]的研究結果一致,而本研究同時發現,在相同 TBBPA濃度暴露下鯽魚卵巢組織未發現病理損傷,表明 TBBPA暴露下鯽魚精巢比卵巢更易受到毒害威脅.在對鯽魚鰓切片的的觀察表明,鰓小片上皮細胞大面積增生、融合會嚴重影響鰓的正常氣體交換,這必然影響鰓的呼吸、分泌和排泄功能,這些與在試驗過程中觀察到的實驗組的魚經常將嘴露出水面或鰓蓋煽動速度加快的缺氧現象相吻合.
4 結論
4.1 組織分布動力學的研究表明,肝臟和腎臟是 TBBPA含量最高的部位,具有較強生物富集能力. 在暴露10~11d時,肝臟和腎臟富集能力最強,最大富集系數分別達到395和945.鰓和肌肉的富集能力較低.
4.2 不同濃度 TBBPA暴露后,鯽魚肝臟、腎臟和鰓均表現出時間-劑量依賴性的病理損傷,低濃度肝組織切片未見明顯病變; 腎臟有彌散性沉積;鰓小片上皮細胞輕度增生,部分伴有鰓小片細胞的脫落,后期有融合現象.高濃度肝細胞腫脹嚴重,肝細胞索狀結構破壞,肝細胞彌散,細胞基質大量丟失,胞核固縮;腎小球毛細血管明顯萎縮,甚至壞死;鰓小片上皮細胞的大面積增生,致使數條鰓小片融合在一起.
4.3 在相同暴露濃度下,雄魚的性腺損傷程度高于雌魚.精巢在2.0mg/L TBBPA暴露下病理損傷嚴重,卵巢未發現明顯病變.
[1]Hale R C, Alaee M, Manchester-neesving J B, et al.Polybrominated diphenyl ether flame retardants in the North American environment [J]. Environ. Int., 2003,29:771-779.
[2]Watanabe I, Kashimoto T, Tatsukawa R, et al. Identification of the flame retardant tetrabromobisphenol A in the river sediment and mussel collected in Osaka. Bull. Environ [J]. Contam. Toxicol.,1983,31:48-52.
[3]De Wit C A. An overview of brominated flame retardants in theenvironment [J]. Chemosphere, 2002,46:583-624.
[4]Cariou R, Antignac J P, Zalko D, et al. Exposure assessment of French women and their newborns to tetrabromobisphenol-A:occurrence measurements in maternal adipose tissue, serum,breast milk and cord serum [J]. Chemosphere, 2008,73:1036-1041.
[5]Geens T, Roosens L, Neels H, et al. Assessment of human exposure to bisphenol-A, triclosan and tetrabromobisphenol-A through indoor dust intake in Belgium [J]. Chemosphere,2009,76:755-760.
[6]Labadie P, Tlili K, Alliot F, et al. Development of analytical procedures for trace-level determination of polybrominated diphenyl ethers and tetrabromobisphenol A in river water and sediment [J]. Anal. Bioanal. Chem., 2010,396:865-875.
[7]張普青,李玉文,李敬瑤,等.巢湖沉積物及水體中四溴雙酚 A濃度分布及時空分布特征 [J]. 內蒙古科技與經濟, 2011,5(31):51-55.
[8]肖 瀟,陳德翼,梅 俊,等.貴嶼某電子垃圾拆解點附近大氣顆粒物中氯代/溴代二英、四溴雙酚A污染水平研究 [J]. 環境科學學報, 2012,32(5):1142-1148.
[9]楊蘇文,王圣瑞,閆振廣,等.四溴雙酚A在5種巢湖魚類體內的組織分布與生物濃縮因子研究 [J]. 環境科學, 2012,33(6):1852-1857.
[10]Yang S W, Yan Z G, Xu F F, et al. Developme nt of freshwater aquatic life criteria for Tetrabromobisphenol A in China [J].Environmental Pollution, 2012,169:59-63.
[11]Li H, Jiang H, Gao X, et al. Acute toxicity of the pesticide methomyl on the topmouth gudgeon (Pseudorasbora parva):Mortality and effects on four biomarkers [J]. Fish Physiol.Biochem., 2008,34:209-216.
[12]孫翰昌,丁詩華,陳大慶,等. Cu2+對中華倒刺鲃抗氧化功能的毒理效應 [J]. 農業環境科學學報, 2006,25(1):69-72.
[13]GB 21808-2008 生態毒理試驗方法 [S]. 北京:中國標準出版社, 2010.
[14]Nero V, Farwell A,Lister A, et al. Gill and liverhistopathologicalchanges in yellowperch (Perca flavescens)and goldfish (Carassius auratus) exposed to oil sands processaffected water [J]. Ecotoxicol. Environ. Saf., 2006,63(3):365-377.
[15]Hugla J L, Thome J P. Effects of polychlorinated biphenyls on liver ultrastructure, hepatic monooxygenases, and reproductive success in the barbel [J]. Ecotoxicol. Environ Saf,. 1999,42(3):265-273.
[16]Tada Y, Fujitan I T, Ogat A A, et al. Flame retardant tetrabromobisphenol A induced hepatic changes in ICR male mice[J]. Environ. Toxicol. Pharmacol., 2007,23(2):174-178.
[17]Weater P W, Canton J H. Histopathological study ofPoeciliareticulata( guppy) after long-term exposure to bis( tri-n-butyltin)oxide (TBTO ) and di-n-butyltindichloride(DBTC) [J]. Aquatic toxicology, 1987,10:143-165.
[18]Weater P W, Canton J H, Van Iersel A A J, et al. The toxicity of bis( tri-n-butyltin) oxide( TBTO) and di-n-butyltindichloride( DBTC) in the small fish speciesOryzias latipes( medaka) andPoecilia reticulata guppy[J]. Aquatic Toxicology, 1990,16:53-72.
[19]王錫珍,陸宏達.關于阿維菌素對異育銀鯽的急性毒性和組織病理研究 [J]. 大連水產學院學報, 2010,25(1):66-70.
[20]陳瑪麗,瞿臻琰,劉青坡,等.四溴雙酚 A和五溴酚對紅鯽肝臟組織和超微結構的影響 [J]. 安全與環境學報, 2008,8(4):8-11.
[21]Ronisz D, Farmen F E, Karlsso H N, et al. Effects of the brominated flame retardants hexabromocyclododecane (HBCDD),and tetrabromobisphenol A (TBBPA), on hepatic enzymes and other biomarkers in juvenile rainbow trout and feral eelpout [J].Toxicology, 2004,69:229-245.
[22]Shi H, Wang X, Karlsso H N, et al. Electron paramagnetic resonance evidence of hydroxyl radical generation and oxidative damage induced by tetrabromobisphenol A in carassius auratus [J].Aquatic toxicology, 2005,74(4):365-371.
[23]瞿璟琰,姚晨嵐,施華宏,等.四溴雙酚A和五氯酚對紅鯽甲狀腺組織結構的影響 [J]. 環境化學, 2007,26(3):29-32.
[24]瞿璟琰,施華宏,劉青坡,等.四溴雙酚-A和五溴酚對紅鯽甲狀腺激素和脫碘酶的影響 [J]. 環境科學學報, 2008,28(8):1625-1630.
[25]Schauer U M D, V?lkeland W, Dekant W. Toxicokinetics of tetrabromobisphenol A in humans and rats after oral administration [J]. Toxicol. Sci., 2006,91(1):49-58.
[26]Kang M J, Kim J H, Shin S, et al. Nephrotoxic potential and toxicokinetics of tetrabromobisphenol a in rat for risk assessment[J]. Journal of Toxicology and Environmental Health, Part A:Current Issues, 2009,72:1439-1445.
[27]張紅梅,姜會民.分子氨對黃河鯉魚血清抗氧化反應的影響 [J].西南大學學報, 2011,33(8):88-93.
[28]姜會民.氨氮脅迫對黃河鯉幼魚肝胰臟、腎臟抗氧化性的影響[J]. 山東大學學報(理學版), 2012,47(1):17-22.
[29]陳瑪麗.四溴雙酚-A對魚類的毒性效應 [D]. 上海:華東師范大學, 2008.

