三葉草病毒病癥狀類型及發病條件研究
相 棟, 梁巧蘭, 徐秉良, 劉雪峰
(甘肅農業大學草業學院,草業生態系統教育部重點實驗室,甘肅省草業工程實驗室,中-美草地畜牧業可持續發展研究中心,蘭州 730070)
三葉草又名車軸草,廣泛應用于城市美化、水土保持、綠肥壓青、飼用牧草和醫藥等領域[1-3]。適宜生長在溫暖濕潤的環境中,為各種病蟲害的滋生提供了機會,病毒病作為三葉草主要病害之一,在世界范圍內普遍發生[4]。已報道可以感染三葉草的病毒至少有十余種,其中,以苜蓿花葉病毒(AWV)和白三葉草花葉病毒(WCMV)危害較嚴重[5-7]。三葉草感染病毒后,常表現為葉片壞死,系統花葉畸形等癥狀,嚴重影響其品質和價值。國內外至今還沒有找到防治包括三葉草病毒病在內的植物病毒病切實有效的方法。因此,加強檢測檢疫工作,了解病情的分布動態,從而有針對性地采取無毒種苗、隔離檢疫、銷毀病株等措施,是防控該類病害的重要措施之一。
近年來,隨著三葉草在我國綠肥作物以及園林設計中的應用不斷增多,三葉草在甘肅省種植面積也逐年擴大,然而,病毒病的發生也日益加重,嚴重影響其長勢和品質,使其經濟價值得不到充分發揮,已成為影響三葉草栽培和持續利用的主要限制因素之一。為此對甘肅省蘭州市綠化帶及種植區三葉草病毒病的發生情況進行了詳細的調查,對其主要病毒病原進行了鑒定,并測定了其寄主范圍,試驗結果對指導甘肅省三葉草的種植,減輕病毒病的發生具有重要意義。現將結果報道如下。
1 材料與方法
1.1 病害調查和毒源采集
2010-2012年間,于每年4-9月中、下旬對蘭州市不同區綠化帶(南北濱河路綠化帶、五泉山綠化區、西湖公園綠化區、南昌路綠化帶等)、甘肅農業大學校園、甘肅農業大學紅三葉草試驗田、蘭州市榆中縣紅三葉草試驗田三葉草病毒病的發生定期定點進行調查,其中,除了甘肅農業大學紅三葉草試驗田、蘭州市榆中縣紅三葉草試驗田以紅三葉草為調查和采集對象,其余地塊均為白三葉草。所有調查采用五點取樣法,每樣點取1m2,調查其中50株的150片葉,共750片葉,按以下9級分級標準,統計發病情況,計算發病率及病情指數。
三葉草病毒病分級標準[8]為,0級:無癥狀;1級:輕度花葉;3級:中度花葉;5級:輕微皺縮或輕花葉皺縮;7級:花葉或皺縮或畸形;9級:重度花葉且皺縮或壞死。
按以下公式計算發病率和病情指數:


調查過程中用無菌塑料袋采集具病毒病典型癥狀的白三葉草和紅三葉草葉片為試材,樣品一式3份,一份于4℃冰箱短期保存、一份于-20℃冰箱保存,另一份長期保存于-70℃冰箱中,部分樣品將病株整體移回,種植于實驗室隔蟲網室中,進一步觀察研究。
1.2 環境因素對白三葉草病毒病發生的影響
以白三葉草(Trifolium repens Linn.)作為供試植物,將消毒三葉草種子播種在滅菌的土壤中,置于防蟲網室中培養。等株高達到13cm左右時,將采集的白三葉草病葉用pH7.0磷酸緩沖液按1∶2(m/V)冰浴勻漿后摩擦接種[9]于供試植株上,分別置于相對濕度為45%,溫度5、10、15、20、25、30℃下和溫度為25℃,相對濕度為30%、45%、60%、75%、90%下觀察其發病狀況并統計病情指數[10]。每種供試植物接種5株,以接種磷酸緩沖液為對照,重復3次。溫度、濕度通過RXZ型智能人工氣候箱控制。
1.3 三葉草病毒病病原鑒定及寄主范圍測定
1.3.1 三葉草病毒病病原鑒定
采用雙抗體夾心法(double antibody sandwich ELISA DAS-ELISA),按武漢基因美公司提供的AMV、WCMV DAS-ELISA試劑盒試驗步驟進行測定。田間采集的正常植株葉片及具有典型病毒病癥狀的三葉草葉片為試驗材料,分別記為,W0:正常;W1:黃斑花葉;W2:斑駁花葉;W3:花斑花葉;W4:叢簇矮化;W5:皺縮褪綠;W6:環斑及環紋每個樣品設4個重復。
最后結果首先通過目測法觀察,即如果陽性對照變色,空白、陰性對照都沒有變色,觀察待測材料是否發生顏色變化;然后進一步進行酶標儀測定法,即用550型酶聯免疫測定儀(Bio-Rad廠家產品),分別測定450nm下各孔的A值,并根據公式:臨界值(CUT OFF)=陰性對照A 平均值+0.15,當樣品A值≥臨界值者,為陽性(+)帶毒;當樣品A值<臨界值者,為陰性(-)不帶毒。
1.3.2 三葉草病毒病病原提純
根據金磊磊[11]報道的苜蓿花葉病毒提純方法和Wetter[12]報道的白三葉草花葉病毒提純方法,分別對AMV、WCMV進行提純,然后將提純的病毒分別接種于心葉煙、菜豆上進一步擴繁保存。
1.3.3 寄主范圍測定
以種植于隔蟲網室中的昆諾藜、莧色藜、心葉煙、普通煙、本氏煙、番茄、辣椒、龍葵、菜豆、豇豆、苜蓿、地三葉、豌豆、藿香薊、鵝絨藤、萵苣、向日葵、黃瓜、千日紅、雞冠花、大白菜等7科21種植物作為供試寄主,將提純擴繁的AWV、WCMV采用汁液摩擦分別接種(方法同1.2)于以上2~3葉期供試寄主幼苗,以接種磷酸緩沖液為對照,每種植物接種6~10株,重復2次,置于防蟲網室中觀察記錄癥狀表現。
2 結果與分析
2.1 三葉草病毒病田間發病情況
2.1.1 田間發生情況
通過2010-2012年連續3年對蘭州市三葉草病毒病調查發現,4-9月三葉草病毒病均有發生,平均發病率為28.14%,平均病情指數為17.45;田間癥狀主要為花葉、褪綠皺縮、斑駁、叢簇矮化。調查還發現,紅三葉草平均發病率和平均病情指數均高于白三葉草,不同地區發病情況不同。由于三葉草為多年生植物,發病情況嚴重的地塊每年都保持較為嚴重的發病率。

表1 甘肅省蘭州市三葉草病毒病發病情況Table 1 Prevalence of clover virus disease in Lanzhou City,Gansu Province
2.1.2 田間癥狀類型
調查結果表明,三葉草受到病毒侵染后,在田間的癥狀類型主要有以下幾種(圖1):
(1)黃斑花葉:沿葉脈產生褪綠條點,連接為褪綠黃條斑,形成黃色條紋或不規則花葉(癥狀代號為YM);
(2)斑駁花葉:葉片上出現黃綠相間的斑駁花葉,或葉脈壞死、葉片皺縮,后逐漸形成壞死斑(癥狀代號為MoM);
(3)花斑花葉:葉片呈現弱的、散射的、有時是不規則的淡黃色或白色花斑(癥狀代號為VaM);
(4)叢簇矮化:頂部葉片扭曲不能正常張開,有的葉片沿葉脈皺縮壞死,植株嚴重矮化(癥狀代號為Rstu);
(5)皺縮褪綠:葉片扭曲皺縮,并在皺縮處出現不規則褪綠或由邊緣開始向內褪綠(癥狀代號為Shch);
(6)環斑及環紋:一般出現于田間垂直下部葉片,整個葉片出現圓形或近圓形斑,有4~50個不等,后期逐漸連接造成壞死斑(癥狀代號為RS&RP);
(7)其他癥狀類型:沿葉片主脈,整個葉片由中間向兩邊褐化;葉片邊緣或整個葉片沿著葉脈紅葉;葉片出現褐色短線。
其中,(1)、(5)、(6)、(7)癥狀表現在白三葉草上;(2)、(3)、(4)癥狀表現在紅三葉草上。
2.1.3 三葉草病毒病田間發生流行動態
通過三葉草病毒病田間發生流行動態研究表明,在不同季節三葉草病毒病發生情況不同(圖2),白三葉草和紅三葉草發病癥狀及高峰期有明顯差別。5月均表現出不同程度的病毒病癥狀,4月下旬到5月上旬白三葉草達到發病高峰,發病率和病情指數分別為29.62%、14.04,6月紅三葉草達到發病高峰,發病率和病情指數分別為56.53%、34.34。在發病高峰期,白三葉主要癥狀表現為黃斑花葉,紅三葉主要癥狀表現為花斑花葉、叢簇矮化。

圖1 三葉草病毒病田間癥狀類型Fig.1 Symptom types of clover virus disease in the field

圖2 不同時期三葉草病毒病發生情況Fig.2 Occurrence status of clover virus disease during difference periods
2.2 環境因素對三葉草病毒病發生的影響
2.2.1 溫度對三葉草病毒病發生的影響
通過溫度對三葉草病毒病發生的測定表明,溫度在5~30℃三葉草病毒病均能發生。當溫度為25℃時,發病最重,病情指數為74.81;當溫度為30℃時發病最輕,病情指數為40.00。方差分析表明,當溫度為15、20、25℃時,3個處理之間無顯著性差異,但是與其他處理5、10、30℃間存在顯著性差異(圖3)。
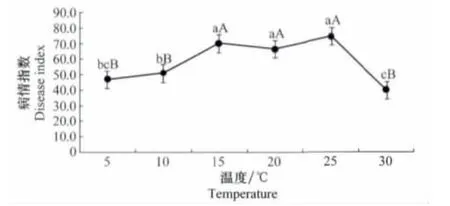
圖3 溫度與三葉草病毒病發生的關系Fig.3 The relationships between different temperatures and occurrence of clover virus disease
2.2.2 濕度對三葉草病毒病發生的影響
不同相對濕度條件下三葉草病毒病均能發生。隨著相對濕度的增大,病情指數先升高后降低。當相對濕度45%時,病害發生最嚴重,病情指數達到最大為74.07;而相對濕度為60%時,病情指數最低,為30.37,其他3個處理發病情況介于兩者之間。方差分析表明,相對濕度為45%時比其他處理發病顯著嚴重,其他處理之間無顯著性差異(圖4)。
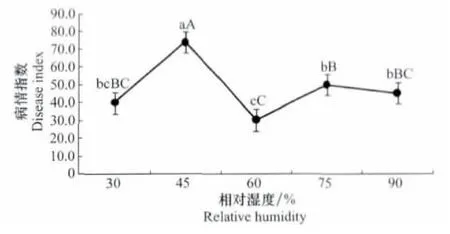
圖4 相對濕度與三葉草病毒病發生的關系Fig.4 The relationships between different humidity conditions and occurrence of clover virus disease
2.3 三葉草病毒病生物學測定
2.3.1 三葉草病毒病病原DAS-ELISA檢測
DAS-ELISA對28份三葉草樣品AMV、WCMV的檢測結果表明:具有典型癥狀的6類樣品均受到AMV的侵染(表2),目測發現其均有不同程度的黃色顯示,酶標儀檢測結果均為陽性帶毒,AMV的檢出率為100%;皺縮褪綠型目測觀察發現其輕微顯色,但酶標儀檢測結果顯示A值小于臨界值為陰性外,其余5類均受到WCMV的侵染(表2),其目測觀察與酶標儀檢測結果相一致,WCMV的檢出率為83.3%;正常葉片兩種病毒均未檢測出。通過ELISA檢測結果發現在6類三葉草樣品中存在AMV和WCMV復合侵染的現象,復合侵染率為83.3%。
2.3.2 AMV寄主范圍測定
通過AMV寄主范圍測定表明,用PB緩沖液(pH7.0)作對照,通過重復處理發現,AMV可以侵染6科16種植物,不同寄主潛育期不同,接種3d后表現癥狀不等,主要癥狀有系統花葉、褪綠、枯斑等。在不同寄主上的癥狀反應如表3所示。
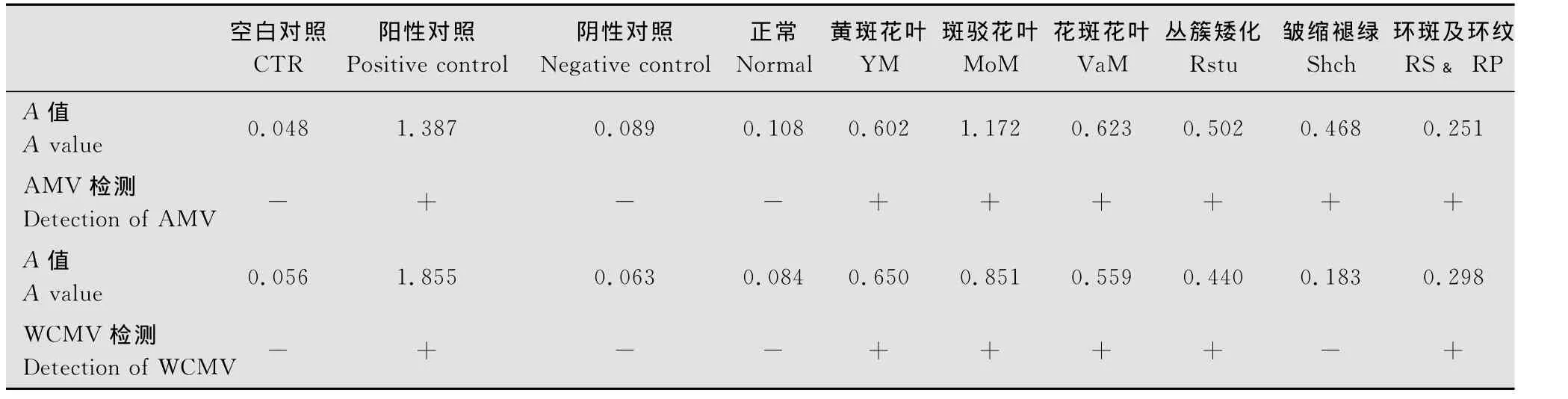
表2 三葉草病毒病原DAS-ELISA檢測結果Table 2 Detection of the clover viral pathogens by DAS-ELISA

表3 AMV在不同測試寄主上的反應1)Table 3 The reaction of AMV against different test hosts

續表3 Table 3(Continued)
2.3.3 WCMV寄主范圍測定
WCMV寄主范圍測定表明,WCMV可侵染豌豆、菜豆、豇豆、苜蓿、昆諾藜,癥狀反應如表4所示,在其他植物上未表現出侵染癥狀。

表4 WCMV在不同測試寄主上的反應Table 4 The reaction of WCMV against different test hosts
3 結論與討論
對蘭州市不同綠化帶及試驗種植區三葉草病毒病癥狀表現和發病情況調查表明,三葉草病毒病在調查區普遍發生,平均發病率為28.14%,病情指數為17.45。三葉草病毒病癥狀類型主要有6種,其中,花葉型和皺縮型比較普遍,并且在紅三葉草和白三葉草上的癥狀類型不同。病原主要以侵染葉片對三葉草生長造成危害。4月下旬到5月上旬白三葉草達到發病高峰,主要癥狀為黃斑花葉;6月份紅三葉草達到發病高峰,主要癥狀為花斑花葉、叢簇矮化。8月份蘭州市溫濕度相對較高,此時黃斑花葉型癥狀基本消失,9月下旬到10月份黃斑花葉和花斑花葉兩種癥狀的發生又達到一個高峰期。三葉草病毒病的發生與溫、濕度均有很大的關系,當溫度為25℃、相對濕度為45%時接種白三葉草幼苗發病較重,這與調查一致。當溫度過高時有些癥狀消失,這可能與存在隱癥現象有關。
引起甘肅省蘭州市三葉草病毒病的主要病原為苜蓿花葉病毒(AMV)和白三葉草花葉病毒(WCMV),通過DAS-ELISA檢測法其檢出率分別為100%、83.3%,田間自然感病三葉草以復合侵染為主,復合侵染率為83.3%。McLaughlin[13]在對美國東南部豆科牧草病毒病檢測中,通過ELISA檢測在白三葉草和紅三葉草上AWV、WCMV的檢出率分別為9.4%、7.3%。據報道三葉草黃葉脈病毒(Clover yellow vein virus,CYVV)、紅三葉草脈花葉病毒(Red clover vein mosaic virus,RCVMV)、大豆矮縮病毒(Soybean dwarf virus,SbDV)、菜豆黃花葉病毒(Bean yellow mosaic virus,BYMV)也是侵染三葉草的主要病原[5-7,14],田間自然感病三葉草是否還受CYVV、RCVMV、SbDV、BYMV感染還有待進一步檢測,并且近年來與RT-PCR和核酸分子雜交相結合的方法可使檢測更為準確[15]。
寄主范圍測定表明,經提純的AMV分離物在豇豆、菜豆、豌豆、苜蓿、黃瓜、昆諾藜、莧色藜、番茄、辣椒、心葉煙、普通煙、大白菜、雞冠花等一些測試寄主上的反應與國內魏寧生[16]及陳集雙等[17]報道的苜蓿花葉病毒分離物Wc及SHy在測試寄主上的癥狀反應相似,但在千日紅不表現系統黃斑與報道存在差異,并發現向日葵也為寄主;WCMV在國內尚未報道,這可能與我國環境、栽培制度以及它經常和其他病毒復合侵染有關系,但本試驗提純的WCMV在豌豆、菜豆、昆諾藜等上的癥狀與Jacqueline[18]、Potter[19]及 Gardiner[20]報道的相似。
本試驗僅對蘭州市三葉草病毒病的發生與溫度、濕度的關系進行了初步探討,對于不同品種、氣象因素、傳毒昆蟲遷飛動態等與病毒病發生的關系尚未涉及;并且測試寄主植物也僅限于試驗中選取的種類,是否還有其他寄主,有關這些問題還有待進一步研究。
[1] 陳學福,史高峰.三葉草屬植物研究進展[J].安徽農業科學,2006,34(13):3087-3089.
[2] 馬進.我國草坪業若干問題探討[J].四川草原,2001(1):32-35.
[3] 邢珊珊,龔束芳.黑龍江省三葉草研究應用現狀及發展建議[J].黑龍江農業科學,2011(1):102-103.
[4] 趙桂琴,慕平.苜蓿花葉病毒外殼蛋白基因對紅三葉的遺傳轉化及轉基因植株的抗病性分析[J].西北植物學報,2004,24(10):1850-1855.
[5] Hanson E W,Hagedorn D J.Viruses of red clover in Wisconsin[J].Agronomy,1961,33:63-67.
[6] Michael J P.Clover viruses in eastern Canada in 1967[J].Plant Disease,1968,48(3):87-92.
[7] Pratt M J.Studies on clover yellow mosaic and white clover mosaic viruses[J].Canadian Journal of Botany,1961,39:655-665.
[8] 王信.青海蠶豆、豌豆病毒病調查和菜豆花葉病毒(BYMV)全系列分析[D].楊凌:西北農林科技大學,2007.
[9] 方中達.植病研究方法[M].北京:中國農業出版社,1998.
[10]古麗君,徐秉良,梁巧蘭,等.蘭州市草坪禾草根腐病的發生及病原菌鑒定[J].草業學報,2009,18(4):175-180.
[11]金磊磊.一株苜蓿花葉病毒的全基因組序列及其寄主生物學研究[D].杭州:浙江理工大學,2011.
[12]Wetter C.Partial purification of some elongated plant viruses and their use as antigens in immunization by means of Freund’s adjuvant[J].Archiv für Mikrobiologie,1960,37:278.
[13]McLaughlin M R,Boykin D L.Virus diseases of seven species of forage legumes in the southeastern United States[J].Plant Disease,1988,72:539-542.
[14]Ragland C K,Campbell C L,Moyer J W.The effects of clover yellow vein virus and peanut stunt virus on yield of two clones of ladino white clover[J].Phytopathology,1986,76(5):557-561.
[15]袁小環,李青.血清學方法和分子生物學方法檢測植物病毒研究進展[J].熱帶農業科學,2001(6):63-68.
[16]魏寧生,李毅.苜蓿花葉病毒(AMV)白三葉草分離物-Wc的研究[J].病毒學雜志,1987(4):54-60.
[17]陳集雙,洪健.從白車根草(Trifolium repens)上分離的一株苜蓿花葉病毒[J].浙江農業大學學報,1994,20(1):24-28.
[18]Jacqueline D B,Brunt A A.The natural occurrence of white clover mosaic virus in sweet pea(Lathyrus odoratus)in southeast England[J].Plant Pathology,1988,37(3):445 -446.
[19]Potter L R.The effects of white clover mosaic virus on vegetative growth and yield of clones of S.100white clover[J].Plant Pathology,1993,42(5):797-805.
[20]Gardiner T J,Pearson M N,Hopcroft D H,et al.Characterization of a labile RNA virus-like agent from white clover[J].The Annals of Applied Biology,1995,126(1):91-104.

