不同倍性菘藍幼苗對鹽漬脅迫的耐受能力及保護性酶的響應機制
王麗艷,荊瑞勇,郭永霞,殷奎德
(黑龍江八一農墾大學,黑龍江 大慶163319)
菘藍(Isatis indigotica Fort.)為十字花科菘藍屬兩年生草本植物,以干燥根及葉入藥,分別稱板藍根和大青葉,為常用中藥材[1]。有關菘藍二倍體和四倍體的比較研究中,有從生藥學角度研究根中靛藍、靛玉紅、總氨基酸含量的,結果表明,四倍體較二倍體均有明顯提高[2],菘藍根中四倍體游離氨基酸和水解氨基酸的含量均高于二倍體[3];遺傳特性方面的比較研究表明,菘藍二倍體與其同源四倍體具有中等偏高的遺傳差異性[4];在生理方面對菘藍體內超氧化物歧化酶的活性研究結果表明,四倍體的酶活性比二倍體的高[5]。有關二倍體和四倍體在耐鹽性方面的比較研究目前還未見報道。
黑龍江大慶市大同區是板藍根的主產區之一,也是最大的產區,大慶板藍根種植面積約為全國的2/3,平常年份板藍根的年產量約在2.5萬t左右。所產板藍根品質上乘,目前種植的菘藍主要為二倍體品種。大慶地區有大面積的鹽堿地區,如能推廣種植菘藍也是一個不錯的選擇。另外板藍根的主要藥效成分為次生代謝產物,逆境條件下可能會增加其藥效成分,根據前人在生藥學方面的研究,四倍體較二倍體優越很多[2-3],因此本試驗對二倍體和四倍體在耐鹽性方面進行比較分析,為不同倍性菘藍種植區域的選擇,同時也為四倍體菘藍能否在大慶鹽堿地區推廣種植提供理論支持。
1 材料與方法
1.1 試驗材料
供試材料為二倍體和四倍體菘藍,購于毫州市春秋藥材種業有限責任公司。
1.2 鹽脅迫處理方法
采用在MS培養基中加入不同濃度的Na Cl模擬鹽脅迫。MS培養基中附加30 g/L蔗糖、8 g/L植物瓊脂,p H 值5.7,分別附加濃度為0,50,100,150,200,250,300 mmol/L的 NaCl進行鹽脅迫處理,以Na Cl濃度為0的作為對照。
將二倍體和四倍體菘藍種子去除種皮后用75%的乙醇處理5 min,再用0.1%的升汞處理10 min,用無菌水沖洗4~5遍,然后接種于上述不同處理的培養基中,本試驗共設7(鹽濃度)×2(倍性)=14個處理,每處理重復3次,每個重復5瓶,每瓶20粒。置于溫度為(25±2)℃的組織培養室中進行培養,前三天進行暗培養,然后于光強1 500~2 000 l x,每日光照時數14 h的光照下培養7 d,每天統計發芽率。培養到第10天時進行相關指標的測定。
1.3 測定項目
1.3.1 發芽率、發芽勢、發芽指數的測定
種子發芽率=種子正常發芽粒數/供試種子數×100%;
種子發芽勢=種子第4天正常發芽粒數/供試種子粒數×100%;
種子發芽指數=∑Gt/Dt
式中:Gt——Dt相對應的每天發芽種子數;Dt——發芽時間。
1.3.2 株高、根長、幼苗鮮重、根冠比的測定 當種
子接入培養基10 d后進行芽長、根長、根重、芽重和根冠比測定。
1.3.3 丙二醛和脯氨酸含量的測定 將種子接種到培養基中10 d后,采樣測定植株莖葉中的丙二醛和脯氨酸的含量:丙二醛含量測定采用硫代巴比妥酸(TBA)比色法[6];脯氨酸含量的測定采用磺基水楊酸比色法[6]。
1.3.4 保護性酶SOD、POD、CAT活性測定 超氧化物歧化酶(SOD)采用氮藍四唑(NBT)法進行測定[6];過氧化物酶(POD)采用愈創木酚法進行測定,以每分鐘內A470變化0.01為1個酶活性單位(U)[6];過氧化氫酶(CAT)的活性測定采用紫外吸收法進行測定,以每分鐘內A240下降0.1的酶量為1個酶活單位(U)[7]。
1.4 統計分析
利用統計軟件Excel和SPSS 13.0進行數據的統計分析。
2 結果與分析
2.1 鹽脅迫處理對不同倍性菘藍發芽率、發芽勢、發芽指數的影響
2.1.1 鹽脅迫處理對不同倍性菘藍發芽率的影響
將菘藍種子接種于不同處理的培養基中后,每天統計發芽率,采用多重比較中的最小顯著差法(LSD)進行方差分析,結果見圖1。從圖1中可以看出,隨著
NaCl濃度的增加,二倍體和四倍體菘藍發芽率均呈下降的趨勢。當NaCl濃度為0~150 mmol/L時,到第5天時發芽率基本達到最大值,而Na Cl濃度>
150 mmol/L時,到第6天時發芽率達到最大值;從二倍體和四倍體的差異來看,二倍體對照和Na Cl濃度為50 mmol/L時第7天的發芽率達96%,而當
NaCl濃度為100 mmol/L和150 mmol/L時,其發芽率分別為77%和73%,從方差分析來看其與對照和
NaCl濃度為50 mmol/L的發芽率差異達到顯著性水平,而四倍體對照第7天的發芽率達99%,當Na Cl
濃度為50、100 mmol/L和150 mmol/L時,第7天的發芽率均達到90%以上分別為92%,90%和90%。
通過顯著性分析可知,兩個倍性菘藍品種第7天發芽率的差異表現為:在Na Cl濃度為100、150 mmol/L
和200 mmol/L時,四倍體的發芽率顯著高于二倍體,其他濃度下差異不顯著。因此,從發芽率來看,四倍體菘藍較二倍體菘藍耐鹽脅迫能力強。
2.1.2 鹽脅迫處理對不同倍性菘藍發芽勢和發芽指數的影響 種子在失去發芽力之前,已發生了劣變,
可從發芽勢或發芽指數反映出來,故二者比發芽率更能靈敏地表現種子活力。

圖1 不同濃度NaCl處理下菘藍的發芽率
總體來看,二倍體和四倍體菘藍的發芽勢均隨NaCl濃度的增加呈逐漸下降的趨勢,從方差分析可以看出,二倍體菘藍的發芽勢在各Na Cl濃度之間的差異均達到顯著水平,而四倍體在NaCl濃度為100 mmol/L和150 mmol/L時發芽勢之間無顯著性差異,并且在此濃度下四倍體較二倍體的發芽勢要高;二倍體和四倍體菘藍的發芽指數均隨著Na Cl濃度的增加而呈逐漸下降的趨勢,

圖2 不同濃度NaCl處理下菘藍的發芽勢和發芽指數
從方差分析可以看出,二倍體和四倍體菘藍的發芽指數在各Na Cl濃度之間的差異均達到顯著水平。但四倍體較二倍體下降的趨勢要緩和,Na Cl濃度為50 mmol/L時,二倍體的發芽指數要高于四倍體,隨著NaCl濃度的增加,當濃度為100~250 mmol/L時,四倍體要高于二倍體,尤其是NaCl濃度為150 mmol/L時,四倍體較二倍體要高得多。從兩個倍性菘藍品種發芽勢和發芽指數的差異顯著性分析可知,當Na Cl濃度為50 mmol/L時,二倍體菘藍的發芽勢和發芽指數顯著高于四倍體菘藍,而當Na Cl濃度為150 mmol/L時四倍體菘藍又顯著高于二倍體菘藍,其他濃度下二倍體和四倍體間的差異不顯著(圖2)。因此發芽勢和發芽指數均可以說明,四倍體菘藍較二倍體菘藍的耐鹽脅迫能力強。
2.2 鹽脅迫處理對不同倍性菘藍芽長、根長、根重、芽重和根冠比的影響
當種子接入培養基10 d后,將組培苗取出,進行根長、芽長、根重、芽重的測定,進一步計算出根冠比,統計結果如圖3所示。由于當Na Cl濃度大于200 mmol/L時,在種子接種10 d后,僅有芽發出而未能形成植株,因此此部分未對其進行統計分析。
從圖3中可以看出,總體來看,二倍體菘藍的根長、芽長、根重、芽重均隨著NaCl濃度的增加呈逐漸下降的趨勢,且根長和根重的降低幅度明顯大于芽長和芽重;而四倍體菘藍的根長、芽長、根重、芽重均隨著Na Cl濃度的增加呈先增加后下降的趨勢。二倍體對照的根長、芽長、根重、芽重均高于四倍體對照,而隨著Na Cl的加入,四倍體又均高于二倍體。說明鹽脅迫對二倍體的影響較四倍體大,四倍體較二倍體耐鹽脅迫能力強。二倍體菘藍根冠比呈逐漸下降的趨勢,四倍體菘藍呈逐漸增加的趨勢。從方差分析可以看出,二倍體菘藍在Na Cl濃度>100 mmol/L時根冠比無差異,四倍體菘藍在>150 mmol/L時根冠比無差異。當 Na Cl濃度為50,100,150,200 mmol/L時,四倍體的根冠比分別為二倍體的1.67,2.46,3.24,3.29倍。對二倍體和四倍體菘藍上述指標的方差分析可知,對照組的根長和芽長二倍體菘藍顯著高于四倍體菘藍,根重、芽重和根冠比差異不顯著;當有NaCl加入時,四倍體菘藍的根長、芽長、根重、芽重和根冠比顯著高于二倍體菘藍。
2.3 鹽脅迫處理對不同倍性菘藍丙二醛和脯氨酸含量的影響
丙二醛是膜脂過氧化的最終產物,是膜系統受傷害的重要標志之一,其含量可以表示膜脂過氧化作用的程度[8]。不同濃度NaCl處理下不同倍性菘藍中丙二醛含量的測定結果如圖4所示。從圖4中可以看出,二倍體和四倍體菘藍隨著Na Cl濃度的增加,丙二醛含量呈現先稍降低后增加的趨勢,在濃度為50 mmol/L時最低。從方差分析可以看出,NaCl濃度為0與50 mmol/L之間時,二者丙二醛含量的差異不顯著,但與其它濃度之間差異均達顯著性水平,說明Na Cl濃度為50 mmol/L時,膜系統基本沒有受到損傷,但隨著NaCl濃度的增加,膜系統受損程度逐漸加重。從圖4中還可以看出,各濃度下二倍體菘藍丙二醛含量均高于四倍體菘藍。當NaCl濃度為200 mmol/L時,丙二醛含量較對照二倍體增加了2.64倍,四倍體增加了2.3倍。從二倍體菘藍和四倍體菘藍丙二醛含量的差異性分析可知,對照組和Na Cl濃度為50 mmol/L時,二倍體與四倍體之間的差異不顯著,當Na Cl濃度>50 mmol/L時,二倍體的丙二醛含量顯著高于四倍體。這在一定程度上說明隨著Na Cl濃度的增加,四倍體菘藍的膜系統受損傷程度低于二倍體菘藍。這在一定程度上說明四倍體菘藍較二倍體菘藍的耐鹽脅迫能力強。
脯氨酸是植物細胞質中重要的滲透調節物質[9]。植物體內脯氨酸含量在一定程度上反映了植物的抗逆性,抗性強的品種往往積累較多的脯氨酸[6],在逆境條件下,植物體內脯氨酸的含量顯著增加。不同濃度NaCl處理下不同倍性菘藍中脯氨酸含量的測定結果如圖4所示。從圖4中可以看出,隨著Na Cl濃度的增加,二倍體和四倍體菘藍脯氨酸含量呈逐漸增加的趨勢。從方差分析可以看出,各Na Cl濃度之間脯氨酸含量差異均達到顯著性水平。在NaCl濃度較低(0~100 mmol/L)時二倍體脯氨酸增加量較四倍體明顯,在 NaCl濃度較高(150~200 mmol/L)時四倍體脯氨酸增加量較二倍體明顯。從二倍體菘藍和四倍體菘藍脯氨酸含量的差異性分析可知,NaCl濃度為50 mmol/L時,二倍體顯著高于四倍體,當Na Cl濃度為200 mmol/L時,四倍體顯著高于二倍體,其他濃度下二倍體和四倍體脯氨酸含量差異不顯著。這也在一定程度上說明四倍體菘藍較二倍體菘藍耐鹽脅迫能力強。
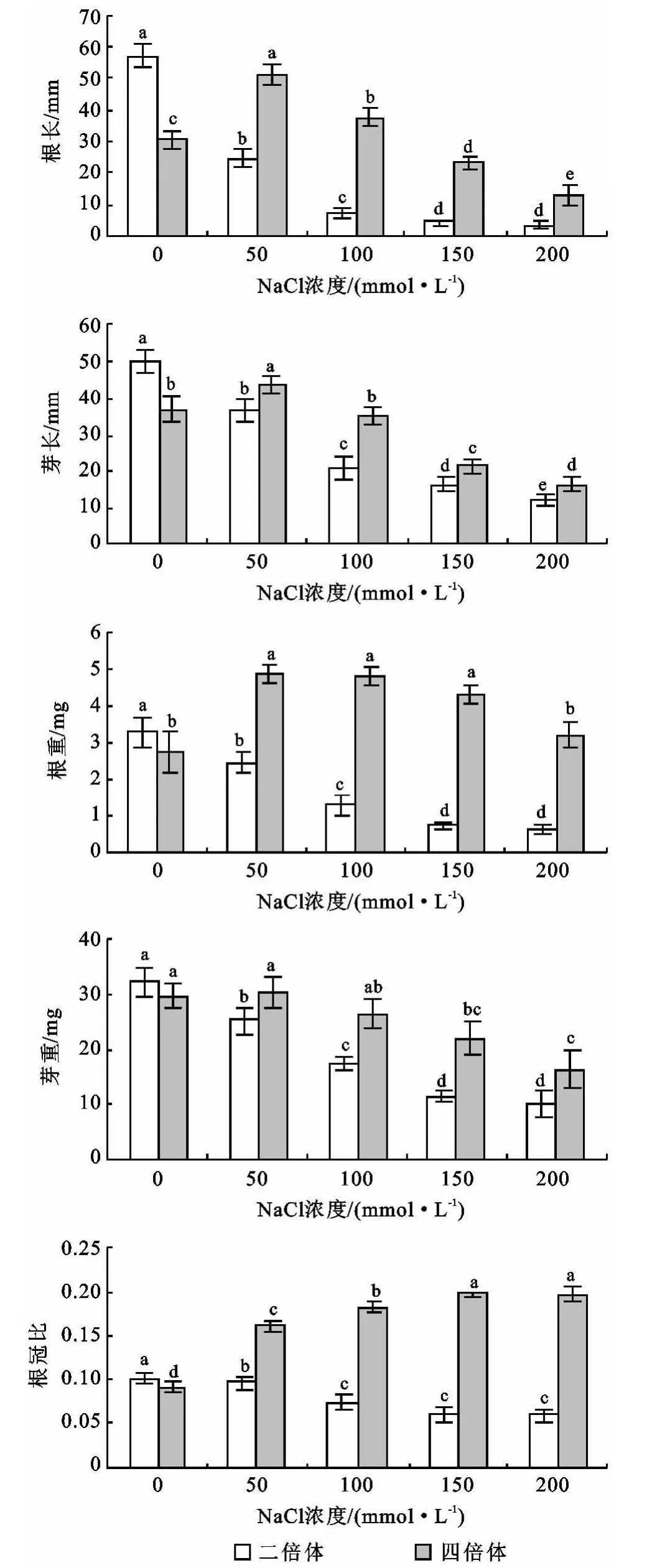
圖3 不同濃度NaCl處理下菘藍的根長、芽長、根重、芽重和根冠比變化
2.4 鹽脅迫處理對不同倍性菘藍保護性酶SOD、POD、CAT活性的影響
在鹽脅迫下,菘藍體內活性氧代謝失調,此時由SOD、POD、CAT等內源活性氧清除劑構成的酶保護系統被激活,其活性增加以清除活性氧,以此來緩解鹽脅迫對菘藍造成的傷害。由圖5可見,隨著Na Cl濃度的增加,二倍體和四倍體菘藍中SOD、POD和CAT三種保護性酶均呈現先增加后降低的趨勢。酶活性之所以降低是因為當鹽濃度增大后,植物體內活性氧的產生能力大于清除能力時,過量的活性氧就破壞或降低了保護性酶的結構或活性[10]。其中SOD和CAT的增加趨勢一致,當Na Cl濃度為50 mmol/L時菘藍體內酶活性最大。而POD當Na Cl濃度為100 mmol/L時的酶活性最大,這說明在不同NaCl濃度下,起主要保護作用的酶是不同的。從不同倍性菘藍來看,當Na Cl濃度從0增加到200 mmol/L時,四倍體的SOD、POD和CAT三種保護性酶活性均高于二倍體。方差分析可知,POD活性在對照組和Na Cl濃度為200 mmol/L時,二倍體菘藍與四倍體菘藍間的差異不顯著,當NaCl濃度為50,100和200 mmol/L時,四倍體菘藍POD活性顯著高于二倍體;SOD活性在Na Cl濃度為100 mmol/L和150 mmol/L時,四倍體顯著高于二倍體,其他濃度下二者差異不顯著;CAT活性在對照組二倍體與四倍體間的差異不顯著,有Na Cl加入時,四倍體CAT活性均顯著高于二倍體。這說明在鹽脅迫下四倍體菘藍對活性氧的清除能力要高于二倍體菘藍。
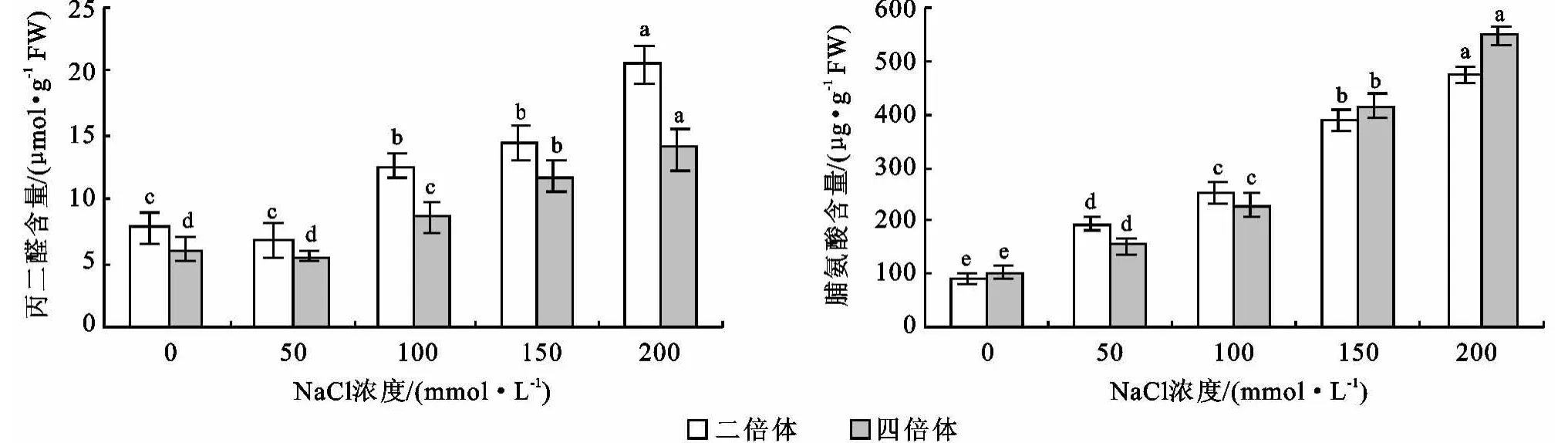
圖4 不同濃度NaCl處理下菘藍的丙二醛和脯氨酸含量

圖5 不同濃度NaCl處理下菘藍的SOD、POD、CAT活性
3 結論與討論
種子萌發是植物體生活史中重要的階段,直接影響到植物體后期的生長發育和形態建成,從而會間接影響產量的形成,因此種子能夠迅速整齊的萌發,是獲得高產、穩產的基礎[11]。鹽脅迫與干旱脅迫不同,鹽脅迫在植物的整個生活史中都會起作用,而干旱與灌溉量或降雨量有關,屬于階段性脅迫,因此對鹽脅迫來說,種子萌發階段顯得更加重要。本試驗結果無論從發芽率、發芽勢還是發芽指數方面的結果均說明四倍體較二倍體均具有更好的耐鹽脅迫能力。
鹽脅迫對植物最普遍、最顯著的影響就是抑制生長。生長特性是植物對鹽脅迫的綜合反應,也是植物耐鹽性的最優評價指標[12]。種子植物苗期是生活史中最為脆弱的階段,本試驗對菘藍苗期生長情況進行統計分析,結果表明,當Na Cl濃度為0時,二倍體的根長、芽長、根重、芽重均高于四倍體,而隨著Na Cl的加入,四倍體又均高于二倍體。根冠比表現為二倍體隨著NaCl濃度的增加而降低,而四倍體正好相反,隨著Na Cl濃度的增加而增加,說明四倍體較二倍體耐鹽脅迫能力強。
植物在逆境條件下,往往發生膜脂過氧化作用,丙二醛是其產物之一,因此其可以表示植物對逆境條件反應的強弱以及膜系統受損傷的程度,植物體內脯氨酸含量在一定程度上反映了植物的抗逆性,抗逆性強的品種往往會積累較多的脯氨酸。本研究發現,隨著NaCl濃度的增加,二倍體和四倍體中丙二醛含量均呈現先降低后增加的趨勢,膜系統受損程度越發加重,但四倍體中丙二醛含量始終低于二倍體,由此說明隨著Na Cl濃度的增加,四倍體菘藍的膜系統受損傷程度低于二倍體菘藍,四倍體菘藍較二倍體菘藍的耐鹽脅迫能力強;在Na Cl濃度較低時,二倍體脯氨酸增加量較四倍體明顯,在NaCl濃度較高時,四倍體脯氨酸增加量較二倍體明顯。這也在一定程度上說明四倍體菘藍較二倍體菘藍的耐鹽脅迫能力強。
植物體內始終存在著活性氧產生與清除兩個過程,正常情況下兩個過程處于平衡狀態,而當植物遭受逆境時,植物體內活性氧代謝的動態平衡被破壞,產生大量的活性氧自由基破壞植物細胞膜[13]。SOD是一切需氧有機體中普遍存在的一種起保護作用的酶,在植物抵抗鹽害的過程中起防止、中斷膜脂過氧化、保護細胞膜系統不受損傷的作用,其酶活力與植物抗逆性關系密切[14]。POD在植物體內具有廣泛的作用[15],其主要作用之一是是分解由SOD產生的H2O2,進一步形成H2O和O2[16-17]。CAT 可 以 直 接將H2O2分解為H2O和O2,不需要還原力而具有較高的反應速率[18]。本試驗結果表明,在不同NaCl濃度下,起主要保護作用的酶是不同的,無論有無鹽脅迫、Na Cl濃度高低,四倍體中的SOD、POD和CAT三種保護性酶活性均高于二倍體。這說明在鹽脅迫下四倍體菘藍對活性氧的清除能力要高于二倍體菘藍,因此部分解釋了四倍體菘藍的耐鹽脅迫能力要高于二倍體。
[1] 中華人民共和國藥典委員會.中華人民共和國藥典:一部[M].北京:中國醫藥科技出版社,2010:191.
[2] 喬傳卓,戴富寶,崔熙,等.兩種倍性水平鞍藍的生藥學研究[J].中草藥,1995,26(8):423-428.
[3] 陳桂平,客紹英.二倍體及四倍體菘藍氨基酸含量的測定分析[J].中藥材,2011,34(4):506-508.
[4] 段英姿.菘藍二倍體及其同源四倍體遺傳差異的ISSR分析[J].西北植物學報,2012,32(8):1534-4538.
[5] 陳玉芹,聶姬鋒,客紹英,等.不同倍性菘藍超氧化物歧化酶的活性變化[J].唐山師范學院學報,2008,30(2):44-47.
[6] 李合生.植物生理生化實驗原理和技術[M].北京:高等教育出版社,2000:258.
[7] 高俊鳳.植物生理學實驗技術[M].西安:世界圖書出版公司,2000:194.
[8] 梁新華,史大剛.干旱脅迫對光果甘草幼苗根系丙二醛含量及保護酶POD、CAT活性的影響[J].干旱地區農業研究,2006,24(3):108-110.
[9] 譚勇,梁宗鎖,安玉艷.冬季干旱脅迫下黃土高原三種常綠樹種葉片滲透調節物質變化研究[J].水土保持研究,2007,14(3):70-73.
[10] 付艷,高樹仁,楊克軍,等.鹽脅迫對玉米耐鹽系與鹽敏感系苗期幾個生理生化指標的影響[J].植物生理學報,2011,47(5):459-462.
[11] 張春平,何平,袁鳳剛,等.外源5-氨基乙酰丙酸對干旱脅迫下甘草種子萌發及幼苗生理特性的影響[J].西北植物學報,2011,31(8):1603-1610.
[12] Levitt J.Response of Plants to Environ mental Stress[M].New Yor k:Academic Press,1980.
[13] 趙黎芳,張金政,張啟翔,等.水分脅迫下扶芳藤幼苗保護酶活性和滲透調節物質的變化[J].植物研究,2003,23(4):437-441.
[14] 王建華,劉鴻先,徐同.超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J].植物生理學通訊,1989(1):1-7.
[15] 段慧榮,李毅,馬彥軍.PEG脅迫對沙冬青種子萌發過程的影響[J].水土保持研究,2011,18(3):221-225.
[16] 崔大練,馬玉心,石戈,等.紫穗槐幼苗葉片對不同干旱梯度脅迫的生理生態響應[J].水土保持研究,2010,17(2):178-182.
[17] 曹兵,宋麗華,唐春慧.臭椿幼苗對滲透脅迫的生理響應[J].水土保持研究,2008,15(4):168-170.
[18] Willekens H,Chamnongpol S,Davey M,et al.Catalase is a sink for H2O2and is indispensable for stress defence in C3plants[J].The EMBO J ournal,1997,16(16):4806-4816.

