人卵巢組織程序化冷凍及體外培養(yǎng)對(duì)卵泡活性和雌二醇分泌的影響
田玄玄 阮祥燕* Montag Markus Liebenthron Jana Alfred O.Mueck
(1.首都醫(yī)科大學(xué)附屬北京婦產(chǎn)醫(yī)院內(nèi)分泌科,北京100026;2.海德堡大學(xué)婦產(chǎn)醫(yī)院生殖醫(yī)學(xué)研究中心,海德堡69115;3.波恩大學(xué)婦產(chǎn)醫(yī)院卵巢組織凍存中心,波恩53012;4.德國(guó)圖賓根大學(xué)婦產(chǎn)醫(yī)院內(nèi)分泌與絕經(jīng)研究中心,圖賓根D-72076)
隨著癌癥治療學(xué)的進(jìn)步,年輕女性放化療后卵巢功能減退及喪失成為婦產(chǎn)學(xué)界面臨的重大問(wèn)題。卵巢組織冷凍保存是繼胚胎冷凍和卵母細(xì)胞凍存之后的又一極具潛力的保存女性生殖功能的新技術(shù)[1],然而,目前對(duì)于卵巢組織凍存方法及其質(zhì)量評(píng)估尚不確定。卵泡活性和卵巢組織內(nèi)分泌功能的保存是凍存技術(shù)應(yīng)用于臨床的前提和基礎(chǔ)。本研究使用程序冷凍法凍存人卵巢組織,并在解凍后行組織體外培養(yǎng),通過(guò)比較冷凍前后卵泡的活性,及培養(yǎng)上清液中的雌二醇(estradiol,E2)水平,探討程序冷凍法對(duì)卵泡活性和卵巢內(nèi)分泌功能的影響。
1 材料與方法
1.1 標(biāo)本
人卵巢組織來(lái)自于德國(guó)波恩大學(xué)卵巢組織凍存中心用于研究的人卵巢組織,所有組織來(lái)源者已簽署知情同意書(shū)。乳腺癌1例,宮頸癌2例,系統(tǒng)性紅斑狼瘡1例,腎母細(xì)胞瘤1例,患者年齡8~39歲,平均年齡(27.2 ±19.2)歲。
1.2 試劑
二甲基亞砜(dimethyl sulfoxide,DMSO)(純度 >99.9%),德國(guó)WAK-Chemie公司生產(chǎn);L-15基礎(chǔ)培養(yǎng)液,德國(guó)Gibco公司生產(chǎn);血清替代液(serum substitute supplement,SSS),美國(guó)Irvine Scientific 公司生產(chǎn);慶大霉素,美國(guó)Sigma公司生產(chǎn);AIM-V無(wú)血清培養(yǎng)液,德國(guó)Gibco公司生產(chǎn);熒光染色劑Calcein AM,美國(guó)Sigma公司生產(chǎn);膠原酶IA,美國(guó)Sigma公司;蔗糖,美國(guó)Sigma公司生產(chǎn);Gamete Buffer,COOK?公司生產(chǎn);杜氏磷酸緩沖液(dulbecco's phosphate buffered saline,DPBS),德國(guó)PAA公司生產(chǎn)。(1)組織準(zhǔn)備液:L-15基礎(chǔ)培養(yǎng)液+10%SSS+1%慶大霉素;(2)冷凍液:L-15基礎(chǔ)培養(yǎng)液+10%SSS+1%慶大霉素+10%DMSO;(3)消化染色液:DPBS+0.2%Calcein AM+6 mg/mL膠原酶IA;(4)梯度解凍溶液(100 mL):DPBS+10%SSS+1%慶大霉素 +0.75 mol/L/0.625 mol/L/0.5 mol/L/0.375 mol/L/0.25 mol/L/0.125 mol/L蔗糖;(5)體外培養(yǎng)液:AIM-V培養(yǎng)液+10%SSS+1%慶大霉素+100mIU/mL rFSH。
1.3 方法
1.3.1 卵巢組織收集及處理
卵巢組織離體后置于4℃組織準(zhǔn)備液中,快速轉(zhuǎn)移至實(shí)驗(yàn)室。組織準(zhǔn)備液沖洗2次,22號(hào)刀片去除肉眼所見(jiàn)的壞死組織、血管和髓質(zhì)組織[2],使卵巢皮質(zhì)厚度約1 mm,取邊角組織用于研究。在體視顯微鏡下用眼科剪和眼科鑷將卵巢組織剪成1 mm×1 mm×1 mm的組織塊。操作過(guò)程中組織必須浸在組織準(zhǔn)備液中,以上操作在4℃條件下40 min內(nèi)完成。將處理好的組織塊采用抽簽法隨機(jī)分為新鮮組、程序冷凍組、新鮮培養(yǎng)組、凍融后培養(yǎng)組4組,每組10塊。(1)新鮮組:直接進(jìn)行消化染色卵泡計(jì)數(shù);(2)程序冷凍組:程序冷凍14 d后解凍,染色卵泡計(jì)數(shù);(3)新鮮培養(yǎng)組:新鮮組織塊體外培養(yǎng),檢測(cè)上清液中E2濃度,14 d后組織塊染色卵泡計(jì)數(shù);(4)凍融后培養(yǎng)組:程序冷凍14 d后解凍,組織體外培養(yǎng),檢測(cè)上清液中E2濃度,14 d后組織塊染色卵泡計(jì)數(shù)。
1.3.2 組織消化、熒光染色、卵泡計(jì)數(shù)
組織置于平衡過(guò)夜的AIM-V培養(yǎng)液中(4孔板,200 μL/孔),37 ℃、5%CO2條件下培養(yǎng) 2 ~3 h 后轉(zhuǎn)移至37℃預(yù)溫的消化染色液中(DPBS/CalceinAM/膠原酶 IA),37 ℃、5%CO2條件下培養(yǎng)1.5 ~2 h,待組織消化呈絮狀,吹打混勻,熒光顯微鏡下各級(jí)卵泡計(jì)數(shù)。Calcein AM是一種只對(duì)活細(xì)胞進(jìn)行熒光標(biāo)記的細(xì)胞染色劑,能夠輕易穿透活細(xì)胞膜,有活性的卵泡被染色以后發(fā)出強(qiáng)綠色熒光。卵泡分級(jí)參照Gougeon分級(jí)[3]標(biāo)準(zhǔn):始基卵泡—卵母細(xì)胞周?chē)@一層扁平的前顆粒細(xì)胞;初級(jí)卵泡—卵母細(xì)胞周?chē)@一層立方形的顆粒細(xì)胞;次級(jí)卵泡—卵母細(xì)胞周?chē)@兩層或兩層以上立方形的顆粒細(xì)胞。竇狀卵泡—兩層以上的顆粒細(xì)胞,卵泡內(nèi)有竇腔形成。
1.3.3 程序冷凍[4-5]
處理好的組織塊置于預(yù)冷的冷凍液中,4℃(冰面上)搖勻20 min,200 r/min,后轉(zhuǎn)移置凍存管內(nèi),凍存液500 μL/管,計(jì)時(shí)25 min。程序降溫:4℃開(kāi)始,以1℃/min的速度降至-2℃,以0.5℃/min的速度降至-4℃,以0.3℃/min的速度降至-7.5℃,平衡11 min,人工植冰,平衡10 min,以0.3 ℃/min的速度降至-42℃,以10℃/min的速度降至-140℃,投入液氮保存。
1.3.4 快速解凍[5]
將凍存管從液氮中取出,室溫靜置30 s后置于37℃水浴1~1.5 min,觀察待凍存管內(nèi)冰呈2~3 mm長(zhǎng)時(shí)將凍存管取出,室溫下?lián)u勻,轉(zhuǎn)移組織塊置梯度解凍溶液:0.75 mol/L-0.625 mol/L-0.5 mol/L-0.375 mol/L-0.25 mol/L-0.125 mol/L,各搖勻 8 min,室溫,200 r/min;37℃預(yù)溫的Gamete Buffer液沖洗2次×15 s,將組織轉(zhuǎn)移置AIM-V液中培養(yǎng)過(guò)夜,消化染色、卵泡計(jì)數(shù)。
1.3.5 卵巢組織體外培養(yǎng)
將新鮮和解凍復(fù)蘇后的卵巢組織置入4孔板(美國(guó)Falcon公司)中進(jìn)行體外培養(yǎng),每孔置1塊卵巢組織,置300 mL體外培養(yǎng)液,37℃、體積分?jǐn)?shù)6%CO2培養(yǎng)箱中培養(yǎng)14 d,隔日半量換液,將收集的培養(yǎng)液分別保存于-20℃冰箱中待測(cè)E2。
1.3.6 雌二醇測(cè)定
采用電化學(xué)發(fā)光免疫分析法測(cè)定培養(yǎng)液中的E2水平。E2試劑盒購(gòu)自德國(guó)Roche公司,操作按試劑盒說(shuō)明書(shū)進(jìn)行。
1.4 統(tǒng)計(jì)學(xué)方法
采用SPSS 17.0統(tǒng)計(jì)學(xué)軟件對(duì)實(shí)驗(yàn)數(shù)據(jù)進(jìn)行分析。計(jì)量資料以均數(shù)±標(biāo)準(zhǔn)差(ˉ±s)表示,數(shù)據(jù)分析采用方差分析和t檢驗(yàn)。以P<0.05為差異有統(tǒng)計(jì)學(xué)意義。
2 結(jié)果
2.1 程序冷凍法對(duì)卵泡活性的影響
采用膠原酶對(duì)人卵巢組織進(jìn)行消化,Calcein AM熒光染色評(píng)估各級(jí)卵泡的活性。圖1顯示了熒光顯微鏡下熒光染色的竇前卵泡的形態(tài)。人卵巢組織冷凍前后各級(jí)卵泡的數(shù)量和構(gòu)成比。冷凍前后的卵泡總數(shù)和始基卵泡數(shù)比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。與新鮮組相比較,程序冷凍組內(nèi)初級(jí)卵泡和次級(jí)卵泡的數(shù)量及其構(gòu)成比下降,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),冷凍前后均未觀察到竇狀卵泡,詳見(jiàn)表1。
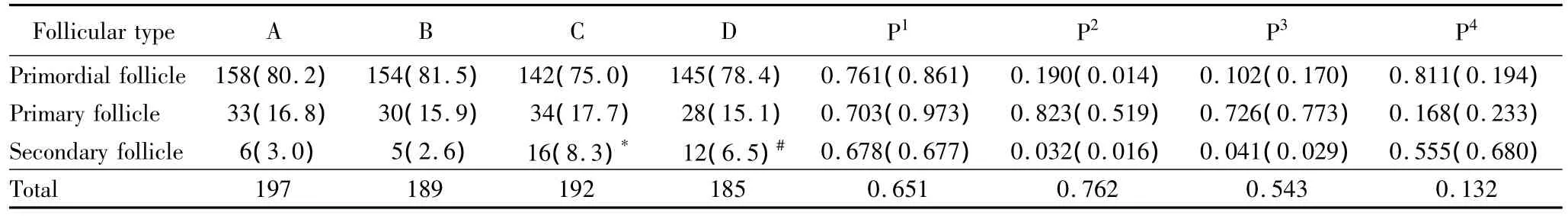
表1 人卵巢組織中各級(jí)卵泡數(shù)量及其構(gòu)成比Tab.1 The number of follicles and their proportions of human ovarian tissues n(%)
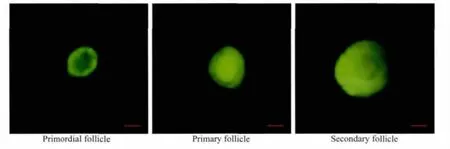
圖1 熒光顯微鏡下Calcein AM染色的竇前卵泡Fig.1 Preantral follicles stained with calcein AM under fluorescence microscopy(Bar:50 μm)
2.2 體外培養(yǎng)的人卵巢組織的生長(zhǎng)發(fā)育和E2分泌
卵巢組織在體外培養(yǎng)至第4~6天開(kāi)始出現(xiàn)貼壁生長(zhǎng)現(xiàn)象,組織逐漸黏附于培養(yǎng)板底面,新鮮培養(yǎng)組貼壁時(shí)間(4.5 ±1.0)d,凍融后培養(yǎng)組(4.8 ±0.9)d,2組組織的貼壁時(shí)間比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。
體外培養(yǎng)的新鮮卵巢組織和程序凍融后卵巢組織的E2分泌水平詳見(jiàn)表2。結(jié)果顯示,新鮮培養(yǎng)組和程序凍融后培養(yǎng)組的組織都具有分泌E2的功能。圖2顯示了2組的E2水平增長(zhǎng)趨勢(shì),2組E2水平增長(zhǎng)趨勢(shì)一致,隨培養(yǎng)時(shí)間延長(zhǎng),E2水平增加,培養(yǎng)開(kāi)始的6 d內(nèi)E2水平增加緩慢,從第6天至第8天,E2水平增加較迅速,從第8天開(kāi)始,E2水平增加緩慢,有上下波動(dòng)。培養(yǎng)第2天,與新鮮培養(yǎng)組相比,凍融后培養(yǎng)組的E2水平較低,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。培養(yǎng)第4~6天,凍融后培養(yǎng)組的E2水平偏低,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。培養(yǎng)第8~14天,2組的E2水平差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。
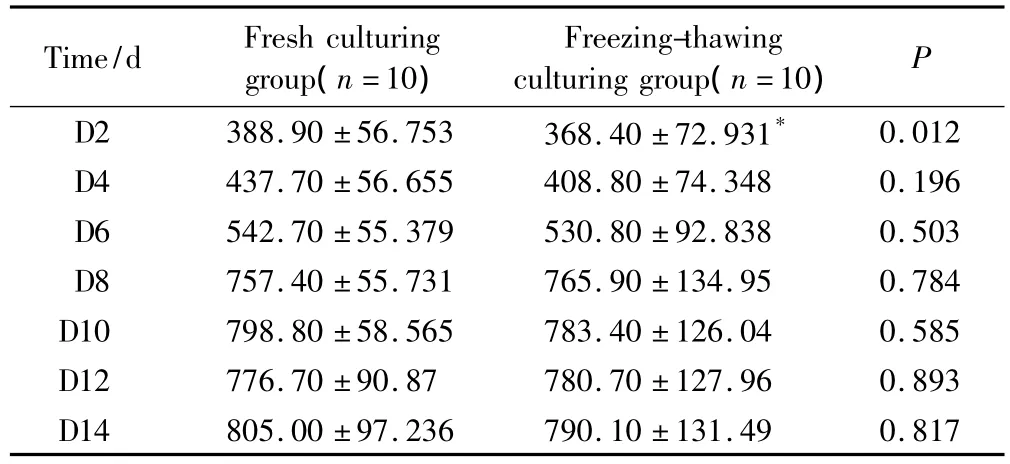
表2 體外培養(yǎng)的卵巢組織培養(yǎng)液中的雌二醇濃度Tab.2 The level of estradiol in the medium of ovarian tissue cultured in vitro (pg/mL)
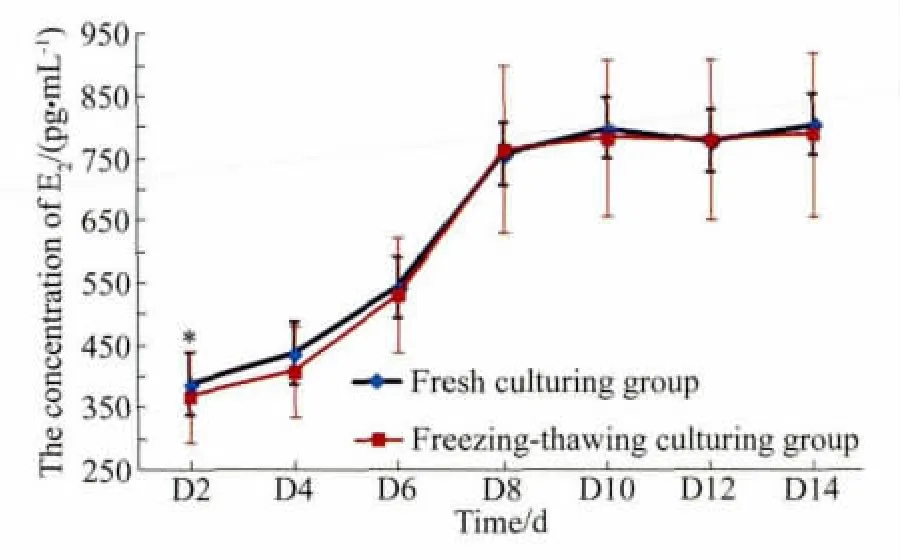
圖2 體外培養(yǎng)的卵巢組織培養(yǎng)液中的雌二醇濃度Fig.2 The level of estradiol in the medium of ovarian tissue cultured in vitro
2.3 卵巢組織體外培養(yǎng)對(duì)卵泡活性的影響
新鮮卵巢組織和程序凍融后卵巢組織體外培養(yǎng)14 d后,消化染色,各級(jí)卵泡的數(shù)量和構(gòu)成比見(jiàn)表1。結(jié)果顯示,與培養(yǎng)前相對(duì)應(yīng)組(新鮮組-新鮮培養(yǎng)組,程序冷凍組-凍融后培養(yǎng)組)比較,體外培養(yǎng)后卵泡總數(shù)、始基卵泡和初級(jí)卵泡構(gòu)成比差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。體外培養(yǎng)后次級(jí)卵泡數(shù)量及構(gòu)成比增加,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。新鮮培養(yǎng)組與凍融后培養(yǎng)組組間卵泡總數(shù)和各級(jí)卵泡構(gòu)成比,差異無(wú)統(tǒng)計(jì)學(xué)意義(P >0.05)。
3 討論
卵巢組織凍存可以同時(shí)保存大量卵泡,組織凍存和移植是一種保存女性生殖和內(nèi)分泌功能的新技術(shù)。國(guó)外已有卵巢組織冷凍后移植卵巢功能成功恢復(fù)的報(bào)道[5-6],但是,目前對(duì)于卵巢組織凍存方法尚有眾多的不確定性因素,這都可能會(huì)影響到卵巢組織的活性。國(guó)內(nèi)學(xué)者也在此領(lǐng)域做了大量研究[7-8],然而,國(guó)內(nèi)目前尚無(wú)成功病例報(bào)道,關(guān)鍵問(wèn)題是凍存技術(shù)不成熟。冷凍前后準(zhǔn)確的卵巢組織質(zhì)量評(píng)估也是評(píng)價(jià)凍存技術(shù)成敗的關(guān)鍵,之前國(guó)內(nèi)研究多數(shù)是對(duì)卵巢進(jìn)行組織學(xué)檢測(cè),評(píng)估冷凍對(duì)卵泡的影響,然而組織學(xué)檢測(cè)對(duì)于卵泡的活性評(píng)估有一定限制。本研究使用活細(xì)胞染色劑Calcein AM,直接對(duì)有活性的卵泡進(jìn)行熒光染色,分析卵巢組織冷凍對(duì)卵泡活性的影響。另外,激素分泌是卵巢組織活性評(píng)估的另一方面,并且與卵泡活性相對(duì)應(yīng),兩者相互印證。本研究從卵泡活性和E2分泌兩個(gè)方面評(píng)估卵巢組織的活性,探討程序化冷凍和體外培養(yǎng)對(duì)卵巢組織活性的影響。
冷凍前后卵泡總數(shù)和始基卵泡數(shù)無(wú)明顯變化,初級(jí)卵泡和次級(jí)卵泡的構(gòu)成比差別不顯著,但程序冷凍組的初級(jí)卵泡和次級(jí)卵泡的構(gòu)成比有下降趨勢(shì)。這表明,不同類(lèi)型的卵泡對(duì)程序化冷凍的耐受性可能存在差異。有研究[9-10]發(fā)現(xiàn),程序化冷凍法對(duì)顆粒細(xì)胞影響較大,體積小、代謝率低、缺乏細(xì)胞器的始基卵泡程序冷凍的效果比較好。Choi等[11]研究發(fā)現(xiàn),與新鮮組相比,凍融卵巢組織中的顆粒細(xì)胞的分化較低,分離出顆粒細(xì)胞進(jìn)行體外培養(yǎng)發(fā)現(xiàn),凍融后的顆粒細(xì)胞的細(xì)胞周期調(diào)節(jié)蛋白D、E,細(xì)胞周期蛋白依賴(lài)激酶4等的表達(dá)也有所降低。這說(shuō)明冷凍過(guò)程中,顆粒細(xì)胞受到了損傷。不同細(xì)胞對(duì)冷凍保護(hù)劑的滲透性不一致,在冷凍過(guò)程中遭受的損傷也不同。這可能與顆粒細(xì)胞位于卵泡的外層,最早接觸冷凍保護(hù)劑以及感受外界環(huán)境的變化有關(guān)。
初級(jí)卵泡和次級(jí)卵泡的體積較始基卵泡增大、代謝增強(qiáng),顆粒細(xì)胞的數(shù)量增多,所以在冷凍過(guò)程中,初級(jí)卵泡和次級(jí)卵泡更易發(fā)生損傷。但是由于用于研究的卵巢組織有限,卵巢組織中次級(jí)卵泡的數(shù)量比較少,本研究未發(fā)現(xiàn)冷凍后次級(jí)卵泡數(shù)量和構(gòu)成比有顯著下降,尚不能給出次級(jí)卵泡比初級(jí)卵泡更易發(fā)生損傷的結(jié)論。以上研究結(jié)果表明,始基卵泡對(duì)程序冷凍法的耐受性較好,冷凍以后存活率較高且數(shù)量多,對(duì)始基卵泡的生長(zhǎng)發(fā)育進(jìn)行研究具有廣闊的前景。
E2是卵巢組織分泌的最主要的性激素,其水平可以反映卵巢組織的內(nèi)分泌功能和卵泡的活性。本研究收集體外培養(yǎng)卵巢組織的培養(yǎng)液檢測(cè)E2水平,判斷程序化冷凍對(duì)卵巢組織內(nèi)分泌功能的影響。研究結(jié)果顯示,新鮮培養(yǎng)組和凍融后培養(yǎng)組均有E2分泌,并且隨著培養(yǎng)時(shí)間的延長(zhǎng),E2水平逐漸增加,這提示卵巢組織在體外培養(yǎng)環(huán)境中能繼續(xù)生長(zhǎng),并保持一定的內(nèi)分泌功能,這為體外培養(yǎng)卵巢組織的臨床應(yīng)用提供了實(shí)驗(yàn)基礎(chǔ)。在體外培養(yǎng)的第4~6天開(kāi)始觀察到卵巢組織的貼壁生長(zhǎng)現(xiàn)象,這與Li等[12]的研究觀察到的貼壁現(xiàn)象相似。凍融卵巢組織需要相對(duì)較長(zhǎng)的時(shí)間貼壁,但是組間貼壁時(shí)間比較,差異無(wú)統(tǒng)計(jì)學(xué)意義,提示程序冷凍對(duì)卵巢組織體外生長(zhǎng)的影響不大。
從折線(xiàn)圖可以觀察到,2組的E2水平增長(zhǎng)趨勢(shì)一致,隨培養(yǎng)時(shí)間延長(zhǎng),E2水平增加,提示卵巢組織在體外培養(yǎng)條件下生長(zhǎng)發(fā)育良好。培養(yǎng)的開(kāi)始階段,凍融組織分泌的E2水平較低,之后逐漸與新鮮培養(yǎng)組接近,培養(yǎng)第8~14天,2組間的E2水平比較,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05)。這提示,程序化冷凍對(duì)體外培養(yǎng)的卵巢組織的E2分泌無(wú)明顯影響,卵巢組織在體外培養(yǎng)初期可能存在一個(gè)適應(yīng)階段,特別是對(duì)于凍融卵巢組織,可能需要逐漸復(fù)蘇其活性。這也進(jìn)一步說(shuō)明,程序化冷凍可以較好的保存卵泡的活性,因?yàn)槭锹殉步M織內(nèi)的活性卵泡分泌了E2。
體外培養(yǎng)第6天以后大部分組織已經(jīng)貼壁生長(zhǎng),E2水平增加較迅速。之后在穩(wěn)定的FSH作用下,E2水平增加緩慢,有上下波動(dòng),這可能是由于卵巢組織內(nèi)各期卵泡的發(fā)育和閉鎖同時(shí)存在,環(huán)境和激素刺激導(dǎo)致了一批卵泡同時(shí)閉鎖或凋亡的原因。
本研究中,卵巢組織體外培養(yǎng)14 d以后,卵泡總數(shù)及始基卵泡和初級(jí)卵泡構(gòu)成比,差異無(wú)統(tǒng)計(jì)學(xué)意義(P>0.05),次級(jí)卵泡數(shù)量及構(gòu)成比增加,差異有統(tǒng)計(jì)學(xué)意義(P<0.05)。這提示,程序冷凍對(duì)卵泡的體外生長(zhǎng)發(fā)育能力無(wú)顯著影響。卵巢組織體外培養(yǎng)情況下,次級(jí)卵泡的生長(zhǎng)優(yōu)于始基卵泡和初級(jí)卵泡的生長(zhǎng)。這與之前Bishonga等[13]的卵泡體外培養(yǎng)研究結(jié)果一致,即大卵泡的發(fā)育潛能優(yōu)于小卵泡。在卵泡生長(zhǎng)過(guò)程中存在卵泡選擇和優(yōu)勢(shì)化現(xiàn)象,即大卵泡抑制其他小卵泡生長(zhǎng)發(fā)育而使自己優(yōu)先發(fā)充育成熟的現(xiàn)象,機(jī)制可能是正在成熟的大卵泡分泌E2和抑制素等非激素因子,抑制了較小卵泡的生長(zhǎng)。另外,直徑較小的卵泡周?chē)挥袉螌宇w粒細(xì)胞,而直徑較大的卵泡卵母細(xì)胞周?chē)鷩@2~4層顆粒細(xì)胞,可較快的實(shí)現(xiàn)細(xì)胞貼壁生長(zhǎng),卵泡膜細(xì)胞就可以更早開(kāi)始增生。
研究[14-15]發(fā)現(xiàn),體外培養(yǎng)體系中卵泡刺激素(follicle-stimulating hormone,F(xiàn)SH)對(duì)竇前卵泡的生長(zhǎng)發(fā)育至關(guān)重要,F(xiàn)SH促進(jìn)顆粒細(xì)胞DNA合成。本研究體外培養(yǎng)基中添加了rFSH,次級(jí)卵泡卵泡膜細(xì)胞上已經(jīng)有FSH受體,可以接受FSH的刺激作用繼續(xù)發(fā)育,而始基卵泡和初級(jí)卵泡缺乏FSH受體,尚不能接受FSH的作用,從而導(dǎo)致不同類(lèi)型的卵泡在同一生長(zhǎng)條件下的生長(zhǎng)發(fā)育出現(xiàn)差異。培養(yǎng)至第14天時(shí)仍未觀察到有竇狀卵泡,可能由于本研究培養(yǎng)條件和培養(yǎng)時(shí)間的限制,本研究培養(yǎng)基中僅有外源性FSH的支持,竇前卵泡的發(fā)育尚受多種其他激素和細(xì)胞因子的影響[16-17],因此以后對(duì)卵泡發(fā)育的影響因素還需繼續(xù)進(jìn)行深入研究。
綜上所述,程序冷凍法可以較好的保存人卵巢皮質(zhì)組織內(nèi)的竇前卵泡,不影響體外培養(yǎng)的卵巢組織的雌二醇分泌。不同類(lèi)型的卵泡對(duì)程序化冷凍的耐受性不同。卵巢組織體外培養(yǎng)情況下,次級(jí)卵泡的生長(zhǎng)優(yōu)于始基卵泡和初級(jí)卵泡的生長(zhǎng)。因此,卵巢組織程序化冷凍和體外培養(yǎng),對(duì)女性生殖力保存具有重要意義。
[1]Smitz J,Dolmans M M,Donnez,J,et al.Current achievements and future culture,in vitro follicle development and transplantation:implications for fertility preservation[J].Human Reproduction Update,2010,16(4):395-414.
[2]Bedaiwy M A,F(xiàn)alcone T.Harvesting and autotransplantation of vascularized ovarian grafts:approaches and techniques[J].Reprod Biomed Online,2007,14(3):360-371.
[3]Gougeon A.Dynamics of follicular growth in the human:a model from preliminary results[J].Hum Reprod,1986,1(2):81-87.
[4]Gosden R G,Baird D T,Wade J C,et al.Restoration of fertility to oophorectomized sheep by ovarian autografts stored at-96 degrees C[J].Hum Reprod,1994,9(4):597-603.
[5]Michael V W,Jacques D,Outi H,et al.Cryopreservation and autotransplantation of human ovarian tissue prior to cytotoxic therapy-A technique in its infancy but already successful in fertility preservation[J].European Journal of Cancer,2009,45(9):1547-1553.
[6]Silber S J.Ovary cryopreservation and transplantation for fertility preservation[J].Molecular Human Reproduction,2012,18(2):59-67.
[7]曹金燕,史小林,諸定壽.大鼠胚胎卵巢異體異位移植的探討[J].首都醫(yī)科大學(xué)學(xué)報(bào),2000,21(1):9-11.
[8]李云秀,馬艷萍,李永剛,等.不同冷凍方案對(duì)人類(lèi)卵巢組織形態(tài)學(xué)的影響[J].中國(guó)優(yōu)生與遺傳雜志,2011,19(6):101-103.
[9]Dahl S L,Chen Z,Solan A K,et al.Feasibility of vitrification as a storage method for tissue-engineered blood vessels[J].Tissue Eng,2006,12(2):291-300.
[10]Fabbri R,Pasquinelli G,Bracone G.Cryopreservation of human ovarian tissue[J].Cell Tissue Bank,2006,7(2):123-133.
[11]Choi J,Lee B,Lee E,et al.Cryopreservation of ovarian tissues temporarily suppresses the proliferation of granulosa cells in mouse preantral follicles[J].Cryobiology,2008,56(1):36-42.
[12]Li Y B,Zhou C Q,Yang G F,et al.Modified vitrification method for cryopreservation of human ovarian tissues[J].Chin Med,2007,120(2):110-114.
[13]Bishonga C,Takahashi Y,Katagiri S,et al.In vitro growth of mouse ovarian preantral follicles and the capacity of their oocytes to develop to the blastocyst stage[J].J Vet Med Sci,2001,63(6):619-624.
[14]Yu Y,Li W,Han Z,et al.The effect of follicle-stimulating hotmone on follicular development granulosa cell apoptosis and stemidogenesis and its mediation by insulin-like growth factor-I in the goat ovary[J].Theriogenology,2003,60(9):1691-1704.
[15]Yang P,Roy S K.A novel mechanism of FSH regulation of DNA synthesis in the granulesa cell of hamster preantral follicles:involvement of a protein kinase C-mediated MAP kinase 3/1 selfactivation loop[J].Biol Reprod,2006,75(1):149-157.
[16]Brito A B,Santos R R,R.van den Hurk,et al.Shortterm culture of ovarian cortical strips from capuchin monkeys:a morphological,viability,and molecular study of preantral follicular development in vitro[J].Reproductive Sciences Published Online,11 January 2013.
[17]Seema P,Deepa B,Dhananjay D M,et al.Stimulation of ovarian stem cells by follicle timulating hormone and basic fibroblast growth factor during cortical tissue culture[J].J Ovarian Res,2013,6:20.

