腦絡欣通及其拆方對腦缺血再灌注大鼠NGF、PI3K、Akt以及Bad蛋白表達的影響
郜 巒,王 鍵*,厙 宇,胡建鵬,何 玲,唐 巍
(1.安徽中醫藥大學,安徽合肥 230038;2.中華中醫藥學會,北京 100029)
中風病以其高發病率、高復發率、高致殘率、高死亡率的四高特點,成為世界上第二位最常見的死亡原因,也是主要的致殘原因[1]。而缺血性卒中最為多見,約占卒中的80%,因此一直得到臨床和科研工作者的關注。目前越來越多的研究表明,中醫藥防治本病正在得到國內外醫學界的重視[2]。已有的研究證實,PI3K-Akt信號轉導途徑,是一條重要的細胞存活信號通路。因此,本研究以PI3K-Akt通路為切入點,在既往工作基礎上,繼續使用線栓法制備局灶性腦缺血再灌注動物模型,動態觀察新安醫家王樂匋教授針對缺血性腦血管病的臨床驗方腦絡欣通及其拆方,對局灶性腦缺血再灌注損傷大鼠NGF、PI3K、Akt以及Bad蛋白的影響,探討其神經保護機制。
1 材料
1.1 實驗動物 健康 SD雄性大鼠120只(安徽醫科大學實驗動物中心提供),體質量280~320 g,實驗前適應性飼養觀察3 d。
1.2 藥物與試劑 藥物:(1)腦絡欣通組為黃芪30 g、川芎10 g、三七10 g、蜈蚣兩條等;(2)拆方益氣組為黃芪30 g;(3)拆方活血組為川芎10 g、三七10 g、蜈蚣兩條等。
試劑:NGF、PI3K、Akt、Bad試劑盒、DAB顯色劑等均購自武漢博士德生物科技有限公司。
1.3 主要儀器和設備 日本LKB超薄切片機(日本太陽株式會社產品),OlympasPM—20型顯微照相設備(日本奧林巴斯光學株式會社產品),日本Olympas BX—51光學顯微鏡(日本奧林巴斯光學株式會社產品),電熱恒溫箱HH.BII.600(上海躍進醫療器械廠),CHR—Ⅲ雙極電凝器(上海Fisher實驗器材有限公司),TB—718自動包埋機(泰維電子設備有限公司),TK—218I恒溫攤片烤片機(泰維電子設備有限公司),美國Image-proplus專業圖像分析軟件系統(美國Media Cybernetics公司)。
2 方法
2.1 分組方法 實驗動物隨機分為模型組、拆方益氣組、拆方活血組以及腦絡欣通組共4組,每組30只,3、7、14 d 3個不同時間點各10只。
2.2 模型制備方法 參考Longa法制作局灶性腦缺血再灌注動物模型[3-4]。簡要模型制作步驟如下:大鼠仰臥固定,10%水合氯醛腹腔注射麻醉后,脫毛、消毒,暴露手術視野,分離頸總、頸外、頸內動脈,電凝頸外動脈的分支(枕動脈、甲狀腺上動脈),結扎頸內動脈的分支翼腭動脈。結扎頸外動脈遠心端,用微型動脈夾夾閉頸總動脈和頸內動脈,眼科剪在頸外動脈殘端作一“V”形切口,插入線栓感覺少許阻力為止(約18~20 mm),縫合切口。缺血2 h后再灌注時,將線栓輕輕拔出約10 mm。
2.3 給藥方法 所有中藥藥物均購自安徽中醫學院第一附屬醫院,由安徽中醫學院中藥制劑室制備成湯劑,根據既往藥效學給藥經驗[5],腦絡欣通方、益氣方、活血方分別按 8.54、3.5、5.04 g/(kg·d),早晚各1次灌胃。模型組予以等量生理鹽水灌胃。給藥時間分別為3、7 d和14 d。
2.4 取材方法 (1)在缺血2 h再灌注3、7、14 d的相應時間位點,10%水合氯醛腹腔注射麻醉(按0.36 mL/100 g體質量)大鼠。(2)動物打開胸腔,從右心耳部剪口,導管自左心室插至主動脈,注入37℃肝素化生理鹽水至右心房流出液變清亮為止,約200 mL左右。(3)注入4%多聚甲醛溶液250 mL進行內固定,灌流30 min。(4)斷頭取腦,除去小腦和腦干,留存大腦,放入相同的固定液中固定1周。(5)脫水、透明、浸蠟,在視交叉前后連續制作腦部冠狀切片。
2.5 指標檢測方法 由專業人員按試劑盒說明書,使用免疫組化染色SABC法分別測定NGF、PI3K、Akt以及Bad指標。
2.6 統計學方法 選擇大腦中動脈阻塞的同側額頂葉皮質觀察,利用美國Image-proplus專業圖像分析軟件系統進行圖像分析,取平均吸收光密度的平均值。數據結果用()表示,用 SPSS 17.0 for Windows軟件分析處理。
3 結果
3.1 不同時間點腦絡欣通對PI3K、Akt的影響見表1。
實驗結果顯示,和模型組比較,腦缺血再灌注損傷發生后,腦絡欣通組在腦缺血再灌注3、7、14 d后,能夠明顯增加PI3K、Akt的表達(P<0.01或P<0.001)。在腦缺血再灌注14 d時,活血組PI3K、Akt的表達亦明顯增加(P<0.01或P<0.001)。組間比較顯示,腦缺血再灌注14 d時,腦絡欣通組PI3K、Akt的表達顯著高于益氣組和活血組(P<0.01)。
3.2 不同時間點腦絡欣通對NGF及Bad表達的影響 見表2。
實驗結果表明,與模型組比較,3個中藥治療組在再灌注7 d時,NGF表達均有顯著升高(P<0.05或P<0.01)。而腦絡欣通組在再灌注14 d,NGF表達顯著增加(P<0.01)。缺血再灌注14 d,與模型組相比,拆方活血組和腦絡欣通組的Bad蛋白表達均顯著降低(P<0.05)。
表1 不同時間點腦絡欣通對PI3K、Akt的影響(,n=10)Tab.1 Influence on expression of PI3K and Akt at different time with Naoluo Xintong Decoction(,n=10)
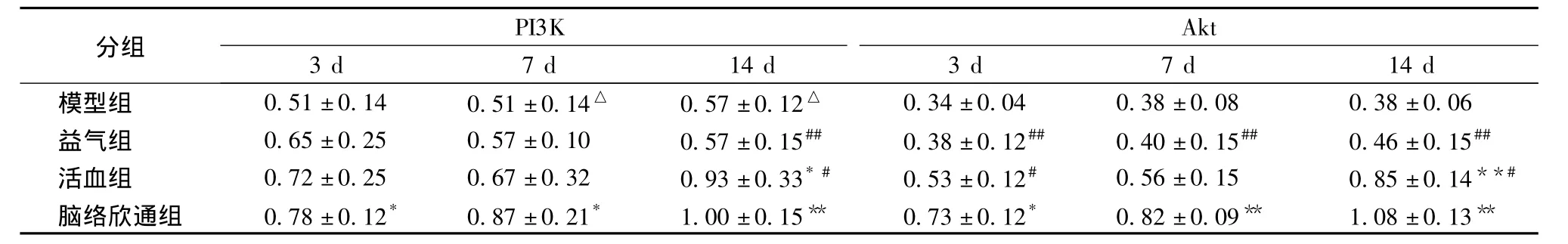
表1 不同時間點腦絡欣通對PI3K、Akt的影響(,n=10)Tab.1 Influence on expression of PI3K and Akt at different time with Naoluo Xintong Decoction(,n=10)
注:與模型組比較,*P<0.01,**P<0.001;和腦絡欣通組組間比較,#P<0.01;##P<0.001
PI3K Akt分組3 d 7 d 14 d 3 d 7 d 14 d模型組 0.51±0.14 0.51±0.14△ 0.57±0.12△0.34±0.04 0.38±0.08 0.38±0.06益氣組 0.65±0.25 0.57±0.10 0.57±0.15## 0.38±0.12## 0.40±0.15## 0.46±0.15##活血組 0.72±0.25 0.67±0.32 0.93±0.33*# 0.53±0.12# 0.56±0.15 0.85±0.14**#腦絡欣通組 0.78±0.12* 0.87±0.21* 1.00±0.15** 0.73±0.12* 0.82±0.09** 1.08±0.13**
表2 不同時間點腦絡欣通對NGF及Bad表達的影響(,n=10)Tab.2 Influence on expression of NGF and Bad at different time with Naoluo Xintong Decoction(,n=10)
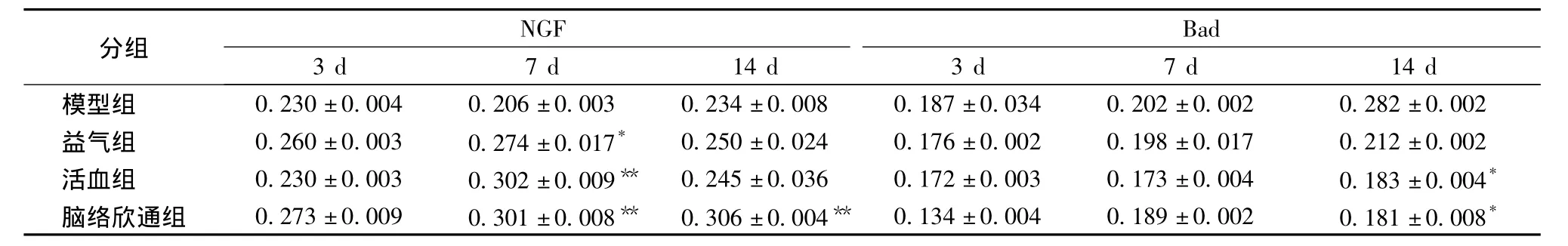
表2 不同時間點腦絡欣通對NGF及Bad表達的影響(,n=10)Tab.2 Influence on expression of NGF and Bad at different time with Naoluo Xintong Decoction(,n=10)
注:和模型組比較,*P <0.05,**P <0.01
NGF Bad分組3 d 7 d 14 d 3 d 7 d 14 d模型組 0.230±0.004 0.206±0.003 0.234±0.008 0.187±0.034 0.202±0.002 0.282±0.002益氣組 0.260±0.003 0.274±0.017* 0.250±0.024 0.176±0.002 0.198±0.017 0.212±0.002活血組 0.230±0.003 0.302±0.009** 0.245±0.036 0.172±0.003 0.173±0.004 0.183±0.004*腦絡欣通組 0.273±0.009 0.301±0.008** 0.306±0.004** 0.134±0.004 0.189±0.002 0.181±0.008*
4 討論
神經生長因子(nerve growth factor,NGF)作為最初被發現的神經營養因子,是神經系統最重要的生物活性分子之一,能夠促進神經元的發育和生存、促進軸突的生長以及突觸的重構。現有的研究從臨床、實驗角度,都表明局灶性腦缺血后NGF的表達增加,有利于受損神經元的修復,在腦缺血損傷過程中發揮作用。中醫工作者在研究中也發現,益氣活血中藥以及針刺的腦保護作用機制也與調節大鼠腦組織NGF表達和保護梗死區神經細胞結構有關[6-7]。其作用機制,近年研究認為,NGF可能通過激活PI3K-Akt信號通路抑制細胞凋亡,發揮腦保護作用。如補陽還五湯可促進腦缺血后腦組織的NGF表達并上調其PI3K/Akt信號轉導的表達,調控神經細胞的凋亡,對腦缺血模型大鼠腦組織發揮積極保護作用[8]。
PI3K/Akt信號轉導途徑是重要的細胞存活信號通路[9]。磷脂酰肌醇3激酶(phosphatidy1inosito1-3 kinase,PI3K),主要由催化亞基P110和調節亞基P85組成,是一種細胞內蛋白激酶,可被生長因子、細胞因子、激素等細胞外信號刺激激活。Akt是一種絲氨酸/蘇氨酸蛋白激酶,也叫蛋白激酶B(protein kinase B,PKB),是PI3K的主要下游信號分子。活化的Akt通過磷酸化進一步激活或抑制其下游的靶蛋白,進而發揮其調節細胞增殖、分化、遷移及能量代謝等作用[10]。越來越多的研究均證實,中醫藥通過PI3K/Akt信號通路的激活發揮其神經保護作用[11],近年來更有學者日漸重視其對神經干細胞增殖、分化的作用[12]。
PI3K/Akt信號途徑激活后,可以經由多種途徑促進細胞存活,而減少神經細胞凋亡是公認的一個重要環節[13-14]。新近就有實驗觀察了葛根素的效應機制,認為激活PI3K/Akt信號通路可能是葛根素減少神經細胞凋亡、起到神經保護作用的機制之一[15]。凋亡是一種受相關基因調控的自主性、程序性死亡過程。其中,B細胞淋巴瘤/白血病-2(B-cell lymphoma/leukemia-2,Bcl-2)是研究較多的與凋亡有關的基因。Bad蛋白也是Bcl-2家族中一員,因為可與Bcl-2和Bcl-xL結合形成異源二聚體,具有促進細胞凋亡作用,故名Bad(Bcl-xL/Bcl-2 associated death promoter)[16]。Bad 蛋白在多種細胞中表達,參與細胞凋亡的全過程,其在腦缺血損傷方面的研究日益受到重視[17-18]。研究認為PI3K/Akt通路的保護途徑之一就是通過磷酸化Bad,從而減少神經元的凋亡,Bad蛋白有三個磷酸化的部位[19-20]。
“氣虛血瘀”是中風病的主要病機特點,氣虛為本,血瘀為標。氣虛則無力行血而為瘀,瘀血阻滯腦之脈絡,上氣不足,腦脈氣血運行不暢,氣血無以濡養,溫煦元神,使腦髓失養,神明失用,而致“氣虛血瘀”之證。針對這一病機特點,治療理應益氣活血,使氣盛而脈絡通利。研究中選用的藥物腦絡欣通,是新安王氏內科代表醫家王樂匋教授針對缺血性腦血管病的臨床驗方,主要由黃芪、川芎、三七、蜈蚣等組成,益氣活血、熄風通絡,臨床療效顯著。在既往的研究中,本課題組已探索建立起穩定、可靠的大鼠腦缺血損傷動物模型制備方法,并從多角度探討了其多靶點多環節的作用機制。
本次研究在既往研究的基礎上,進一步闡明了腦絡欣通的神經保護作用機制。研究提示,腦絡欣通能夠保護腦缺血再灌注損傷大鼠腦組織,其作用機制可能與促進NGF表達,激活PI3K/Akt通路并降低Bad蛋白表達有關。研究結果表明,腦缺血再灌注損傷發生后,在腦缺血再灌注中晚期,益氣活血方藥腦絡欣通能夠明顯誘導NGF的表達,進而激活PI3K/Akt細胞存活信號通路,降低下游Bad蛋白的表達,抑制凋亡,從而起到神經保護作用,在部分時段和指標上要優于單純的益氣和活血方,體現了其組方的完備,揭示了其調控PI3K/Akt通路的作用機制,為腦絡欣通的臨床應用和開發提供了理論依據。
[1]Saeed A,Maryam R,Michael F,et al.Recanalization therapy for acute ischemic stroke,part 1:surgical embolectomy and chemical thrombolysis[J].Neurosurg Rev,2011,34(1):1-9.
[2]Gupta Y K,Briyal S,Gulati A.Therapeutic potential of herbal drugs in cerebral ischemia[J].Indian J Physiol Pharmacol,2010,54(2):99-122.
[3]Longa E Z,Weinstein P R,Carison S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[4]王 鍵,譚 輝,胡建鵬,等.腦絡欣通對局灶性腦缺血大鼠凝血與纖溶系統的影響[J].中醫雜志,2012,53(22):1954-1956.
[5]胡建鵬,王 鍵,程 紅,等.腦絡欣通及其拆方對腦缺血再灌注大鼠腦組織GFAP、bFGF和GDNF蛋白表達的影響[J].中國中醫急癥,2008,17(3):349-351.
[6]梁 暉,張益偉.針刺對急性腦梗死患者血漿腦源性神經營養因子及神經生長因子水平的影響[J].中醫雜志,2010,51(10):912-914.
[7]朱慧淵.益氣活血法對腦缺血再灌注損傷大鼠行為學及腦組織內NGF水平改變的影響[J].中國醫藥導刊,2012,14(3):458-459.
[8]尹天雷,蔡光先,李勇敏,等.補陽還五湯對腦缺血模型大鼠腦組織NGF及PI3K/Akt信號轉導途徑的影響[J].中國中醫藥科技,2008,15(1):24-25.
[9]陳 淼.腦梗死后信號轉導通路的激活及其作用[J].醫學綜述,2013,19(1):32-34.
[10]Waite K,Eickholt B J.The neurodevelopmental implications of PI3K signaling[J].Curr Top Microbiol Immunol,2010,346:245-265.
[11]張 涓,張恩戶,楊秀清.養陰通絡方對腦缺血大鼠海p-Akt、Akt及PI3K蛋白表達的影響[J].中藥藥理與臨床2012,28(5):147-148.
[12]趙 宇,謝 鵬,朱曉峰,等.大鼠神經干細胞中PI3-K/Akt信號轉導通路的研究[J].上海交通大學學報:醫學版,2009,29(10):1191-1195.
[13]Yoon K,Jung E J,Lee S Y.TRAF-6 mediated regulation of the PI3kinase(PI3K)-Akt-GSK3beta cascade is required for TNF-induced cell survival[J].Biochem Biophys Res Commun,2008,371(1):118-121.
[14]Zhu J,Blenis J,Yuan J.Activation of PI3K/Akt and MAPK pathways regulates Myc-mediated transcription by phosphorylating and promoting the degradation of Mad1[J].Proc Natl Acad Sci USA,2008,105(18):6584-6589.
[15]韓江全,于奎營,何 敏,等.葛根素對大鼠腦缺血再灌注側皮質區細胞凋亡及p-Akt(Ser473)表達的影響[J].中國中西醫結合雜志,2012,32(8):1069-172.
[16]何家璇,薛榮亮.Bad蛋白對細胞凋亡的調控作用[J].醫學綜述,2007,13(3):161-163.
[17]韓彩萍.PI3K/Akt信號通路與腦缺血神經細胞凋亡[J].國際神經病學神經外科學雜志,2006,33(1):88-90.
[18]柳華東,劉 爽,李卉麗,等.腦缺氧缺血后激活的信號轉導通路[J].中國生物化學與分子生物學報,2007,23(1):33-37.
[19]Bonni A,Brunet A,West A E,et al.Cell survival promoted by the Ras-MAPK signaling pathway by transcription-dependent and independentmechanisms [J]. Science, 1999, 286(5443):1358-1362.
[20]Datta S R,Dudek H,Tao X,et al.Akt phosphorylation of bad couples survival signals to the cell-intrinsic death machinery[J].Cell,1997,91(2):231-241.

