JNK通路參與曲古抑菌素A誘導的胰腺癌PANC-1細胞凋亡
王本泉,張 玲,黃 雪,陳宗靜,白永恒,吳存造,周蒙滔,陳必成,
(溫州醫科大學附屬第一醫院1.外科實驗室,2.移植中心,浙江 溫州 325000)
近年來研究顯示,胰腺癌的發生和發展涉及多種基因突變和表觀遺傳學的變化[1-2]。組蛋白修飾是基因表達的一種表觀遺傳學調控方式,組蛋白的乙酰化狀態在基因的表達調控中發揮非常重要的作用。組蛋白乙酰化狀態受組蛋白乙酰轉移酶(histone acetyltransferase,HAT)和組蛋白去乙酰化酶(histone deacetylase,HDAC)共同調節[3],組蛋白乙酰化狀態的失衡可能導致腫瘤的發生,而HDAC抑制劑可明顯抑制腫瘤的生長[4]。目前,已發現多種HDAC抑制劑,曲古抑菌素A(trichostatin A,TSA)是其中具代表性的藥物之一。TSA不僅具有抑制腫瘤細胞增殖、誘導分化及化療增敏作用,而且還可誘導細胞凋亡[5]。線粒體凋亡途徑是TSA作用的機制之一[6],還可能涉及細胞周期調控、血管生成和死亡受體等多種途徑[7-8]。
c-Jun氨基端激酶(c-Jun N-ter minal kinase,JNK)又稱應激活化蛋白激酶(stress-activated pr otein kinase,SAPK),作為絲裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族中的重要成員,JNK信號通路在細胞分化、細胞凋亡、應激反應以及多種人類疾病的發生發展中發揮調節作用,是細胞內重要的信號轉導通路之一[9-14]。JNK活化可誘導細胞發生凋亡,多數研究認為JNK通路活化為化療藥物、紫外線照射等誘導細胞凋亡所必需[15-17]。JNK通路活化是否參與 TSA誘導的胰腺癌細胞凋亡過程尚不清楚。本研究通過觀察JNK通路在TSA誘導PANC-1細胞凋亡中的作用,探討TSA誘導胰腺癌細胞凋亡的可能機制。
1 材料與方法
1.1 主要試劑及儀器
TSA和Hoechst33258購自美國Sig ma公司,用二甲亞砜(DMSO,Sig ma)溶解至10μmol·L-1,使用前用無血清培養基稀釋至工作濃度。JNK抑制劑(SP600125)購自上海碧云天生物技術有限公司。DMEM 培養基、胎牛血清、Trizol購自美國Gibco BRL公司。CCK-8試劑盒購自日本同仁化學研究所。逆轉錄試劑盒和SYBRGreenⅠ熒光定量試劑盒購自東洋紡(上海)生物科技有限公司,實時熒光定量PCR所用引物由英駿生物技術有限公司合成(表1)。兔抗人Bax,bcl-2和p-JNK一抗以及辣根過氧化物酶標記山羊抗兔Ig G二抗購于英國Abcam生物公司,胱天蛋白酶3、活性胱天蛋白酶8及p-c-Jun抗體購自美國Cell Signaling公司。Varioskan酶標儀,美國Ther mo公司;ABI7500熒光PCR儀,美國應用生物系統公司;DM4000 M熒光顯微鏡,德國徠卡公司。

Tab.1 Primers used with real-time PCR
1.2 細胞培養及分組處理
胰腺癌PANC-1細胞用含10%胎牛血清、鏈霉素100 g·L-1、青霉素100 g·L-1的DMEM 培養基,置于37℃、5%CO2、飽和濕度的培養箱內培養。取對數生長期的細胞,TSA 0.25,0.5,1和2μmol·L-1處理24 h后,檢測細胞存活率,取1μmol·L-1濃度進行后續指標檢測實驗。對數生長期的細胞分3組,正常對照組,加入等量培養液共培養,TSA 1.0和TSA 1.0μmol·L-1+SP600125 20μmol·L-1組,處理24 h,Hoechst33258染色觀察凋亡細胞,實時定量PCR方法檢測凋亡相關及JNK通路相關基因的表達,Wester n印跡法檢測凋亡相關及JNK通路相關蛋白的表達。
1.3 CCK-8法檢測細胞存活率
收集對數生長期的PANC-1細胞制成單細胞懸液,以每孔1×104個細胞接種到96孔板(每孔100μl),待細胞貼壁生長融合至80%時,TSA單獨處理,細胞分4組,每組設4個復孔:TSA 0.25,0.5,1和2μmol·L-1。TSA+SP600125聯合處理細胞分3組,每組設4個復孔:TSA 1.0μmol·L-1,TSA 1.0μmol·L-1+SP600125 20和40μmol·L-1組。以不含TSA和SP600125的培養基處理細胞作為細胞對照組。藥物作用24 h后,各孔加入10μl CCK-8,繼續培養2 h,酶標儀測定吸光度(A450nm)值,計算細胞存活率。實驗重復3次。細胞存活率(%)=A實驗組/A對照組×100%。
1.4 Hoechst33258熒光染色法觀察細胞凋亡
按照1.2分組處理的細胞作用24 h后,吸干培養基,用PBS洗2次,4%甲醛液固定10 min,雙蒸水沖洗2次,吸干雙蒸水后,Hoechst33258(5 mg·L-1)室溫下振蕩避光染色5 min,然后用雙蒸水沖洗2次,室溫下涼干后于熒光顯微鏡(激發波長360 n m,發射波長450 n m)下觀察,并隨機選取位置進行拍照。每組隨機選取100倍鏡下3個視野,分別計算每個視野細胞凋亡率(%)=有凋亡小體的細胞數/細胞總數×100%。
1.5 實時定量PCR檢測凋亡相關基因及JNK通路相關基因的表達
按照1.2分組處理的細胞作用24 h后,用Trizol試劑盒提取各組細胞的總RNA,每組吸取2μg RNA樣本在10μl體系中進行逆轉錄反應,參照逆轉錄試劑盒說明書進行。取逆轉錄產物1μl進行PCR擴增,PCR擴增體系:5μl 2×SYBR Green熒光定量試劑、2μl引物(上、下游各1μl,終濃度200 n mol·L-1)、2μl反應緩沖液、1μl c DNA。擴增程序為:95℃10 min,95℃15 s,62℃10 s,40個循環。得到的Ct值用2-△△Ct法計算mRNA表達。檢測靶基因包括腫瘤凋亡相關基因bcl-2和bax,JNK通路相關基因c-f os,c-Jun以及El k1。
1.6 Western蛋白質印跡法檢測凋亡相關蛋白及JNK通路相關蛋白的表達
按照1.2分組處理的細胞作用24 h后,每5×106個細胞加100μl細胞裂解液作用20 min后用細胞刮收集細胞,7500×g離心10 min,收集上清液測蛋白濃度;制備12%聚丙烯酰胺分離膠和4%積層膠,樣品5×SDS上樣緩沖液,設置恒壓200 V,電泳60 min;設置恒壓100 V,濕法電轉移60 min;轉膜后的PVDF膜經5%脫脂奶粉TBST溶液室溫封閉1 h;然后加一抗(稀釋在5%脫脂奶粉TBST溶液中)4℃孵育過夜,加入相應種屬二抗,室溫孵育1 h,加入ECL發光液孵育膜5 min,暗室壓片曝光,顯影定影后膠片保存。運用Quantity one軟件分析各個條帶的積分吸光度(integrated absor bance,IA)值,目的蛋白的IA值與相應內參蛋白的IA值的比值表示待測蛋白的相對表達水平。分別檢測凋亡相關蛋白Bax,活性胱天蛋白酶8,bcl-2和胱天蛋白酶3蛋白的表達。
同樣按照上述方法,檢測TSA 1.0μmol·L-1處理0,1,2,4和6 h,p-JNK和p-c-Jun蛋白的表達。
1.7 統計學分析
2 結果
2.1 TSA對PANC-1細胞存活率的影響
CCK-8法分析結果顯示,TSA 0.25~2μmol·L-1單獨處理,PANC-1細胞的存活率隨著TSA濃度的增加而降低,顯示TSA對細胞存活的抑制作用具有一定的量效關系(r=0.9564,P<0.05)(圖1)。若加入SP600125 20 和 40μmol·L-1,PANC-1細胞的存活率較TSA單獨處理明顯增加(P<0.05),并且SP600125 40μmol·L-1組明顯高于20μmol·L-1組(P<0.05)(表2)。

Fig.1 Effect of trichostatin A (TSA)on PANC-1 cell viability by CCK-8 method.Cells were treated wit h TSA for 24 h.±s,n=3.*P<0.05,compared with 0.5μmol·L-1 group;#P<0.05,compared with TSA 1μmol·L-1 group.

Tab.2 Effect of SP600125 on TSA induced cell viability
2.2 TSA對PANC-1細胞凋亡的影響
Hoechst33258染色發現,正常對照組細胞,凋亡率為(1.8±0.4)%(圖2 A),TSA 1μmol·L-1組可見細胞核形態明顯異常,可見多個凋亡小體樣結構(圖 2B),凋亡率為(6.2±4.1)%;TSA+SP600125組仍可見凋亡細胞,但凋亡率明顯下降,為(3.9±0.9)%(圖2C)(n=3,P<0.05)。
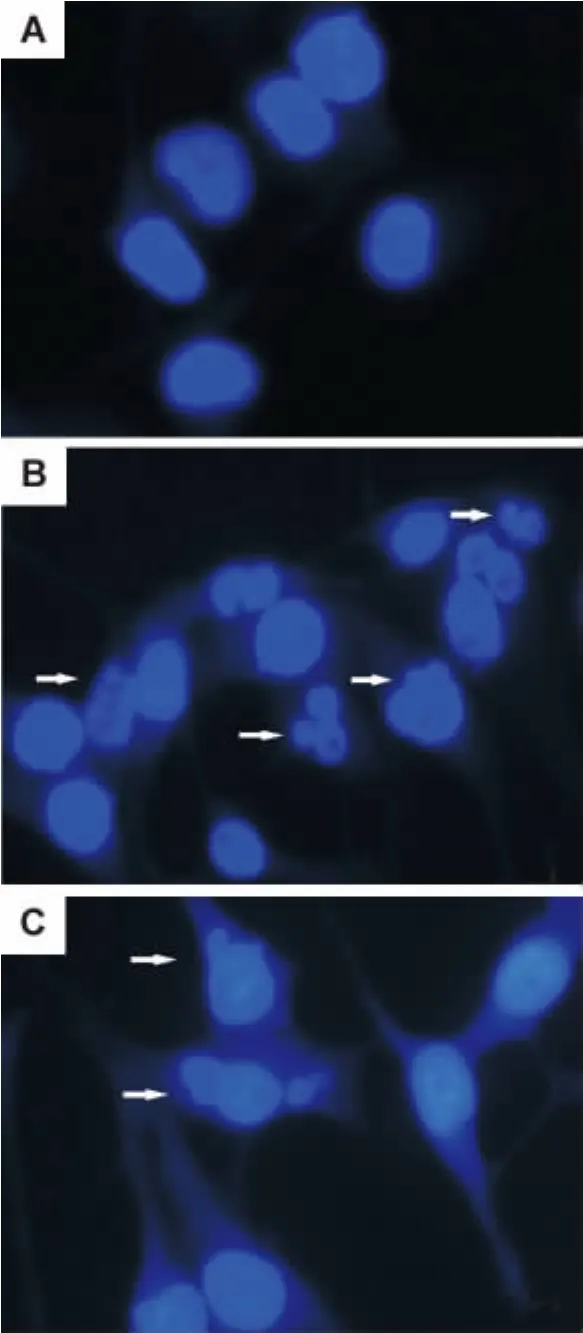
Fig.2 Effect of TSA on PANC-1 cell apoptosis(Hoechst33258 staining×400).See Fig.1 f or t he legend.A:nor mal control group;B:TSA 1μmol·L-1 gr oup;C:TSA+SP600125 20μmol·L-1 gr oup.Arro ws sho w t he apoptotic body-like str uct ures.
2.3 TSA對PANC-1細胞凋亡相關基因及JNK通路相關基因表達的影響
實時定量RT-PCR分析結果顯示,與正常對照組相比,TSA 1.0μmol·L-1作用PANC-1細胞24 h后,凋亡相關基因bax mRNA表達明顯升高(P<0.01),bcl-2 mRNA明顯降低(P<0.01),JNK通路相關基因c-Jun,c-f os和El k1 mRNA明顯升高(P<0.01)。與 TSA 組相比,TSA+SP600125組bax mRNA表達明顯降低(P<0.01),bcl-2 mRNA明顯升高(P<0.01),c-Jun和c-fos表達明顯降低(P<0.01),而El k1 mRNA表達亦降低,但無統計學意義(表3)。

Tab.3 Effect of TSA on mRNA expression of bax,bcl-2,c-Jun,c-fos and Elk1 by real ti me RT-PCR
2.4 TSA對PANC-1細胞蛋白表達的影響
TSA 1.0μmol·L-1作用PANC-1細胞1 h后,p-c-Jun和 p-JNK 明顯激活,2 h達峰值(圖 3 A1,A2)。與正常對照組比較,TSA組促凋亡蛋白Bax和活性胱天蛋白酶8的表達明顯升高(P<0.05)(圖3B1,B2),抗凋亡蛋白bcl-2和胱天蛋白酶3(全長片段)(圖3C1,C2)的表達明顯降低(P<0.05)。與TSA組比較,TSA+SP600125組的Bax和活性胱天蛋白酶8(圖3B1,B2)的表達明顯降低(P<0.05),bcl-2和胱天蛋白酶3的表達明顯升高(P<0.05)。說明SP600125對TSA誘導的凋亡相關蛋白有一定的影響。

Fig.3 Effect of TSA on p-JNK and p-c-Jun protein(A),Bax and activated caspase 8(B),and bcl-2 and caspase 3 proteins(C)by Wester n blotting.A2,B2 and C3 were t he se miquantitative results of A1,B1 and C1,respectively.A.Lanes 1-5:TSA for 0,1,2,4,and 6 h,respectively.B and C.Lane 1:nor mal control gr oup;lane 2:TSA 1.0μmol·L-1 for 24 h gr oup;lane 3:TSA 1.0μmol·L-1+SP600125 20μmol·L-1 f or 24 h,respectively.±s,n=3.*P<0.05,co mpared wit h 0 h group;#P<0.05,co mpared wit h nor mal contr ol gr oup;△P<0.05,co mpared wit h TSA group.
3 討論
胰腺癌對化療藥物不敏感,發展新型化療藥物和化療增敏藥物是改善胰腺癌治療效果的方法之一。HDAC抑制劑可明顯抑制腫瘤細胞增殖,誘導腫瘤細胞分化和凋亡[4]。由于大多數腫瘤細胞呈高度乙酰化狀態[8],因此具有抑制HDAC活性的藥物已成為抗癌治療的新策略。本研究通過體外實驗證明,TSA可抑制胰腺癌細胞增殖,誘導胰腺癌細胞凋亡,JNK通路參與了TSA誘導細胞凋亡的過程。
TSA因高效、低毒而在腫瘤治療中受到關注[18-20]。目前已有文獻報道,TSA 可通過誘導P53依賴的途徑[21]和死亡受體途徑[8]誘發胱天蛋白酶級聯反應[22],抑制腫瘤細胞生長和誘導細胞凋亡。劉維民等[23]研究結果顯示,TSA作用于人肝癌細胞SMMC-7721后,可增加抑癌基因p53、促凋亡基因bax的表達;汪理等[24]的研究提示,TSA誘導胰腺癌細胞的凋亡可能與其下調抗凋亡基因bcl-2表達有關。我們前期的研究亦證實,TSA可明顯抑制PANC-1細胞生長,誘導細胞發生凋亡,且此效應與TSA作用的濃度和時間成正相關[6]。此外,我們還證實在細胞凋亡的過程中,線粒體通路激活,即bax蛋白表達升高,bcl-2蛋白表達降低,進而可能引發胱天蛋白酶級聯反應,導致細胞發生凋亡。
JNK通路參與凋亡過程,已有報道認為JNK通路激活可促進細胞凋亡,但是JNK通路激活卻抑制細胞凋亡亦有報道。目前,研究認為JNK介導細胞凋亡的機制主要包括:① 轉錄因子途徑,即通過調控相關轉錄因子的轉錄,促進p53,Bax,Fasl和TNF等促凋亡蛋白的表達而介導死亡受體途徑和線粒體途徑的細胞凋亡[25]。JNK一旦被激活,磷酸化的JNK即發生核轉位,激活轉錄因子c-Jun和Elk-1等,還可誘導BH3-only蛋白(Bid,Bad和Egl1)的表達,隨后活化Bax等促凋亡蛋白,后者作用于線粒體,促使細胞色素c釋放入胞漿,細胞色素c和胱天蛋白酶9結合,最終作用于胱天蛋白酶3,激活的胱天蛋白酶3與凋亡底物結合引起細胞凋亡[15,26-29]。② 非轉錄因子途徑,在JNK活化過程中,部分活化的JNK滯留于細胞質,它們可直接作用于Bcl-2家族,調控該家族蛋白的活性,從而介導線粒體途徑的細胞凋亡,此過程沒有新基因的表達。
為了驗證JNK通路在TSA誘導細胞凋亡中的作用,本研究通過加入JNK抑制劑SP600125阻斷JNK通路。實驗結果表明,TSA+SP600125聯合組的細胞存活率明顯高于TSA單獨處理組,JNK通路抑制劑明顯降低TSA誘導PANC-1細胞的凋亡效應。TSA作用PANC-1細胞1 h后,JNK信號通路明顯激活,2 h達峰值,表明JNK信號通路可能參與TSA抗腫瘤的機制。高濃度TSA作用24 h后,JNK通路相關基因的表達均較對照組增高。PANC-1細胞bax mRNA,bax蛋白、活性胱天蛋白酶8的表達明顯升高,bcl-2 mRNA和bcl-2蛋白的表達明顯降低,推測TSA可能激活了線粒體凋亡程序,Bax/bcl-2失平衡而導致細胞死亡。阻斷JNK信號通路后,JNK通路相關基因的表達則降低,線粒體凋亡途徑受到抑制,bax mRNA和Bax及活性胱天蛋白酶8蛋白的表達均降低,bcl-2 mRNA和bcl-2蛋白表達升高。亦有研究發現,在不同類型的細胞中,受不同類型的刺激,JNK通路活化不導致凋亡,而可能促進細胞增殖分化。其可能的解釋為,人體內可能存在多種JNK的同工酶,在不同的細胞中,或處于細胞發育的不同階段,它們的表達水平不同,對刺激的反應方式亦存在差異。TSA在其他類型的腫瘤細胞中是否依賴JNK通路發揮促凋亡作用尚需要進一步深入研究。
總之,本研究結果表明,TSA可抑制PANC-1細胞增殖,誘導其凋亡,JNK通路可能參與此過程。
[1]Hr uban RH,Iacobuzio-Donahue C,Wilentz RE,Goggins M,Ker n SE.Molecular pat hology of pancreatic cancer[J].Cancer J,2001,7(4):251-258.
[2]Ueki T, Toyota M, Sohn T, Yeo CJ,Issa JP,Hr uban RH,et al.Hyper met hylation of multiple genes in pancreatic adenocarcino ma[J].Cancer Res,2000,60(7):1835-1839.
[3]Kouzarides T.Histone acetylases and deacetylases in cell pr oliferation[J].Curr Opin Genet Dev,1999,9(1):40-48.
[4]Monneret C.Histone deacetylase inhibitors[J].Eur J Med Chem,2005,40(1):1-13.
[5]Piacentini P,Donadelli M,Costanzo C,Moore PS,Pal mieri M,Scarpa A.Trichostatin A enhances the response of chemot herapeutic agents in inhibiting pancreatic cancer cell proliferation[J].Virchows Arch,2006,448(6):797-804.
[6]Yang YX,Hu SK,Ye XZ,Bai YH,Wang SL,Liu B,et al.Effect of trichostatin A on expression of apoptitosis-related genes and metastasis-related genes in hu man pancreatic cancer PANC-1 cells[J].Chin J Phar macol Toxicol(中國藥理學與毒理學雜志),2012,26(5):624-629.
[7]Tian R,Qin RY,Du ZY,Xia W.Antitumor effect of tu mor necr osis fact or-related apoptosis-inducing ligand gene transfection mediated by adenovir us in hu man pancreatic carcino-ma cell[J].Chin J Gen Sur g(中國普通外科雜志),2006,15(11):821-825.
[8]Ki m HR,Ki m EJ,Yang SH,Jeong ET,Par k C,Lee JH,et al.Trichostatin A induces apoptosis in l ung cancer cells via si multaneous activation of t he deat h receptor-mediated and mit ochondrial pat h way?[J].Exp Mol Med,2006,38(6):616-624.
[9]Huang Y,Huang X,Cai J,Ye F,Qin Q.Involvement of t he mit ogen-activated pr otein kinase pat h way in soft-shelled turtle iridovir us-induced apoptosis[J].Apoptosis,2011,16(6):581-593.
[10]Thévenin AF,Zony CL,Bahnson BJ,Col man RF.Activation by phosphor ylation and purification of hu man c-Jun N-ter minal kinase(JNK)isof or ms in milligram a mounts[J].Protein Expr Purif,2011,75(2):138-146.
[11]Nix P,Hisa mot o N,Matsu mot o K,Bastiani M.Axon regeneration requires coor dinate activation of p38 and JNK MAPK pat h ways[J].Pr oc Natl Acad Sci USA,2011,108(26):10738-10743.
[12]Kovac A,Zilka N,Kaz merova Z,Cente M,Zil kova M,Novak M.Misfolded tr uncated pr oteinτinduces innate i mmune response via MAPK pat h way[J].J Immunol,2011,187(5):2732-2739.
[13]Shaulian E,Karin M.AP-1 as a regulator of cell life and deat h[J].Nat Cell Biol,2002,4(5):E131-E136.
[14]Hong JY,Lebofsky M,Far hood A,Jaeschke H.Oxidant stressinduced liver injury in vivo:role of apoptosis,oncotic necrosis,and c-Jun NH2-ter minal kinase activation[J].Am J Physiol Gastrointest Liver Physiol,2009,296(3):G572-G581.
[15]Brnjic S,Olofsson MH,Havelka AM,Linder S.Chemical biology suggests a role for calciu m signaling in mediating sustained JNK activation during apoptosis[J].Mol Biosyst,2010,6(5):767-774.
[16]Ber mudez O, Pagès G, Gi mond C. The dual-specificity MAP kinase phosphatases:critical roles in develop ment and cancer[J].Am J Physiol Cell Physiol,2010,299(2):C189-C202.
[17]Igaki T.Correcting develop mental errors by apoptosis:lessons from Drosophila JNK signaling[J].Apoptosis,2009,14(8):1021-1028.
[18]Marks PA,Richon VM,Rif kind RA.Histone deacetylase inhibitors:inducers of differentiation or apoptosis of transfor med cells[J].J Natl Cancer Inst,2000,92(15):1210-1216.
[19]Suzuki T,Yokozaki H,Kuniyasu H,Hayashi K,Naka K,Ono S,et al.Effect of trichostatin A on cell growth and expression of cell cycle-and apoptosis-related molecules in human gastric and oral carcinoma cell lines[J].Int J Cancer,2000,88(6):992-997.
[20]Park WH,Jung CW,Park JO,Ki m K,Kim WS,Im YH,et al.Trichostatin inhibits the growth of ACHN renal cell carcino ma cells via cell cycle arrest in association with p27,or apoptosis[J].Int J Oncol,2003,22(5):1129-1134.
[21]Nakajima S,Niizeki H,Tada M,Nakagawa K,Kondo S,Okada F,et al.Trichostatin A with adenovirus-mediated p53 gene transfer synergistically induces apoptosis in breast cancer cell line MDA-MB-231[J].Oncol Rep,2009,22(1):143-148.
[22]Reddy RM,Yeow WS,Chua A,Nguyen DM,Baras A,Ziauddin MF,et al.Rapid and profound potentiation of Apo2 L/TRAIL-mediated cytotoxicity and apoptosis in thoracic cancer cells by the histone deacetylase inhibitor trichostatin A:the essential role of the mitochondria-mediated caspase activation cascade[J].Apoptosis,2007,12(1):55-71.
[23]Liu WM,Yan KL,Wu ZQ.The inhibition of TSA to hepatoma cell SMMC-7721 and its mechanism[J].J Mod Oncol(現代腫瘤醫學),2007,15(10):1373-1375.
[24]Wang L,Zhou W,Zhang JH,Liu T,Wang CY.Trichostatin A(TSA)suppresses the growth of pancreatic adenocarcinoma cells[J].Chin J Gen Surg(中國普通外科雜志),2010,19(3):234-238.
[25]Guan QH,Pei DS,Xu TL,Zhang GY.Brain ischemia/reperfusion-induced expression of DP5 and its interaction with Bcl-2,thus freeing Bax from Bcl-2/Bax dimmers are mediated by c-Jun N-ter minal kinase(JNK)pathway[J].Neurosci Lett,2006,393(2-3):226-230.
[26]Bogoyevitch MA,Ngoei KR,Zhao TT,Yeap YY,Ng DC.c-Jun N-ter minal kinase(JNK)signaling:recent advances and challenges[J].Biochi m Biophys Acta,2010,1804(3):463-475.
[27]Séverin S,Ghevaert C,Mazharian A.The mitogen-activated protein kinase signaling pathways:role in megakaryocyte differentiation[J].J Thromb Haemost,2010,8(1):17-26.
[28]Geest CR,Coffer PJ.MAPK signaling pathways in the regulation of hematopoiesis[J].J Leukoc Biol,2009,86(2):237-250.
[29]Yu MK,Lee YH,Yoon MR,Bhattarai G,Lee NH,Ki m TG,et al.Attenuation of AH26-induced apoptosis by inhibition of SAPK/JNK pathway in MC-3T3 E1 cells[J].J Endod,2010,36(12):1967-1971.

