姜黃素對氣道重塑哮喘大鼠尾加壓素Ⅱ的影響
楊能力,梁亞峰,呂 雅,李前君,王均爐
(溫州醫科大學1.附屬第一醫院麻醉科,2.附屬第二醫院 育英兒童醫院兒童重癥監護室,浙江 溫州 325000)
哮喘是嚴重危害人類健康最常見的疾病之一,其患病率一直呈逐年遞增的趨勢[1]。氣道重塑在哮喘發病過程中發揮重要作用,但迄今為止,尚未找到一種有效抑制哮喘氣道重塑的藥物。姜黃素(curcu min)在減輕氣道炎癥和抗纖維化方面具有顯著的作用[2-3],但其在抑制哮喘大鼠氣道重塑的作用及其機制尚未完全闡明。尾加壓素Ⅱ(urotensinⅡ,UⅡ)是一類重要的內源性血管活性物質,還具有收縮氣管平滑肌和促進氣道平滑肌細胞增殖作用,在哮喘的病理生理過程中發揮重要作用[4]。我們的前期研究表明,UⅡ在哮喘發病中呈現時間依賴性高表達[5]。本研究通過觀察姜黃素對哮喘大鼠的支氣管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)、血清中UⅡ 及肺組織UⅡmRNA表達的影響,探討姜黃素抑制哮喘大鼠氣道重塑的作用及其機制。
1 材料與方法
1.1 主要試劑及儀器
姜黃素,卵清蛋白(ovalbu min,OVA),美國Sigma公司,生產批號:076 K7045。大鼠UⅡ酶聯免疫檢測試劑盒,美國R&D公司。引物合成由上海生物工程技術有限公司提供。N038型PARI BOY超聲霧化器,德國百瑞有限責任公司;Oly mpus光學顯微鏡,日本光學儀器有限公司;Leica圖像采集系統及Leica石蠟切片機,德國徠卡儀器有限公司;Syner gy2酶聯檢測儀,美國Bio Tek公司。
1.2 大鼠哮喘模型的制備和分組處理[6]
清潔級雄性SD大鼠40只,體質量100~120 g,購于上海斯萊克實驗動物有限責任公司〔許可證編號SCXK(滬)2008-003〕。將大鼠按照隨機數字表法隨機分成5組,每組8只:正常對照組、哮喘模型組和姜黃素50,100和200 mg·kg-1治療組。以進行處理的當天為第1天,除正常對照組外,哮喘模型組及姜黃素組在第1天和第8天ip給予1.5 ml OVA/Al(OH)3混合液〔內 含 OVA 1 mg 和Al(OH)3100 mg〕,第15天開始霧化吸入1%OVA激發,隔天1次,每次30 min,正常對照組對應ip給予生理鹽水和霧化吸入。使用0.5%羧甲基纖維素鈉液配制姜黃素混懸液。姜黃素各組從第15天開始,每次激發前30 min分別ig給予姜黃素50,100和200 mg·kg-1,持續6周,正常對照組和哮喘模型組ig對應給予0.5%羧甲纖維素鈉液。
1.3 動物標本的收集
末次霧化吸入12 h內,腹腔給予10%水合氯醛(400 mg·kg-1)麻醉,股動脈取血,全血離心(4℃,1000×g,離 心 15 min),吸取血清分裝,置于-70℃保存備用。開胸,迅速分離肺組織,結扎右主支氣管,經氣管行左肺灌洗。10 ml生理鹽水分3次灌洗,約30 s后回收BALF,回收率高于80%,灌洗液處理方法同血清。切取右肺肺門上段肺組織,浸入4%多聚甲醛固定,常規石蠟包埋及切片(厚約5μm),HE染色觀察。
1.4 支氣管管壁厚度和平滑肌厚度測量
每只大鼠選擇3支直徑1000~1500μm支氣管,用彩色醫學圖像分析技術測定支氣管基底膜周徑、支氣管總面積、管腔面積、平滑肌外緣內氣管面積和平滑肌內緣內氣管面積。支氣管壁厚度=(支氣管總面積-管腔面積)/支氣管基底膜周徑;平滑肌厚度=(平滑肌外緣內氣管面積-平滑肌內緣內氣管面積)/支氣管基底膜周徑。
1.5 BALF、血清中UⅡ含量及肺組織UⅡmRNA的檢測
采用酶聯免疫法檢測大鼠BALF及血清中UⅡ含量,所有標本按照試劑盒說明書操作步驟進行。使用酶標儀在450 n m處測量吸光度(absor bance,A)。采用逆轉錄聚合酶鏈反應(reverse transcription-poly merase chain reaction,RT-PCR)半定量檢測肺組織UⅡmRNA的表達。剪去凍存肺組織100 mg,按照 RNAiso Pl us試劑說明書操作,提取RNA,逆轉錄成c DNA,然后進行擴增,以GAPDH作為內參。UⅡ上游引物:5′-TGCTGAGTACGTGGAGAT-3′;下游引物:5′-GTCTTCTGAGTGGCAGTG-3′,產物長度288 bp;GAPDH 上游引物:5′-ACGGACACTGGTGAAATG-3′;下游引物:5′-GAGTCTCGGCACTGGGAT-3′,產物長度136 bp。取2μl擴增產物經2%的瓊脂糖凝膠電泳后,用凝膠成像分析系統對擴增產物進行掃描,分析測定每一個目的基因及GAPDH的A450nm值,以其A450nm比值表示基因相對表達量。
1.6 統計學處理
2 結果
2.1 姜黃素對哮喘大鼠支氣管壁厚度及平滑肌厚度的影響
圖1 HE染色結果及定量結果(表1)顯示,與正常對照組相比(圖1 A),哮喘模型組支氣管壁厚度及平滑肌厚度均明顯升高(圖1 B)(P<0.01);經姜黃素干預后,支氣管壁厚度及平滑肌厚度均明顯低于哮喘模型組(圖1C,D,E)(P<0.01),但與正常對照組相比仍有升高,差異存在統計學意義(P<0.01)。說明姜黃素干預后,可以減緩支氣管壁的增加及平滑肌厚度的增加,但不能完全逆轉其發生。
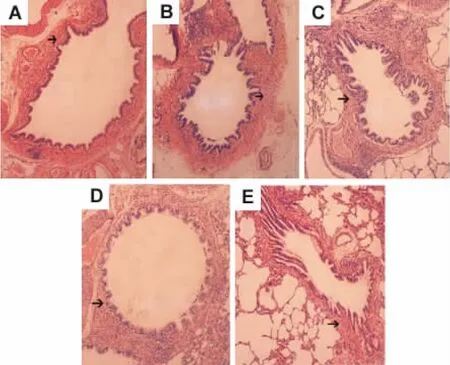
Fig.1 Effect of curcu min on bronchial wall thickness and smooth muscle thickness in lung tissue of asthmatic rats(HE×200).The rats in ast h ma model gr oup and curcu min gr oup were sensitized with intraperitoneal injection of 1 mg OVA with 100 mg alu minu m hydr oxide dissolved in 1.5 ml saline on day 1 and day 8.They were then challenged with 1%OVA aerosol every other day f or 30 min fr o m day 15 for 6 weeks.Curcu min 50,100 and 200 mg·kg-1 was ig given 30 min bef ore challenge fr o m day 15 f or 6 weeks,respectively.A:nor mal contr ol group;B:ast h ma model gr oup;C,D,E:model+curcu min 50,100 and 200 mg·kg-1 gr oups,respectively.Arrows show t hickened br onchial s moot h muscle and bronchial wall.
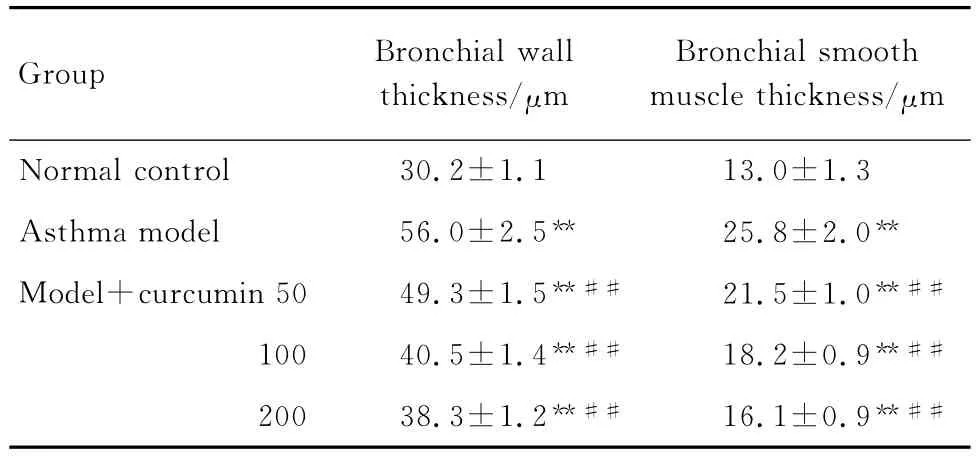
Tab.1 Effect of curcumin on bronchial wall thickness and smooth muscle thickness in lung tissue of asthmatic rats
2.2 姜黃素對哮喘大鼠BALF及血清中UⅡ蛋白含量的影響
表2結果顯示,與正常對照組相比,哮喘模型組BALF和血清中UⅡ含量均明顯升高(P<0.01);不同劑量姜黃素組UⅡ含量與哮喘模型組相比均明顯降低(P<0.01),而與正常對照組相比仍有升高,差異存在統計學意義(P<0.01)。
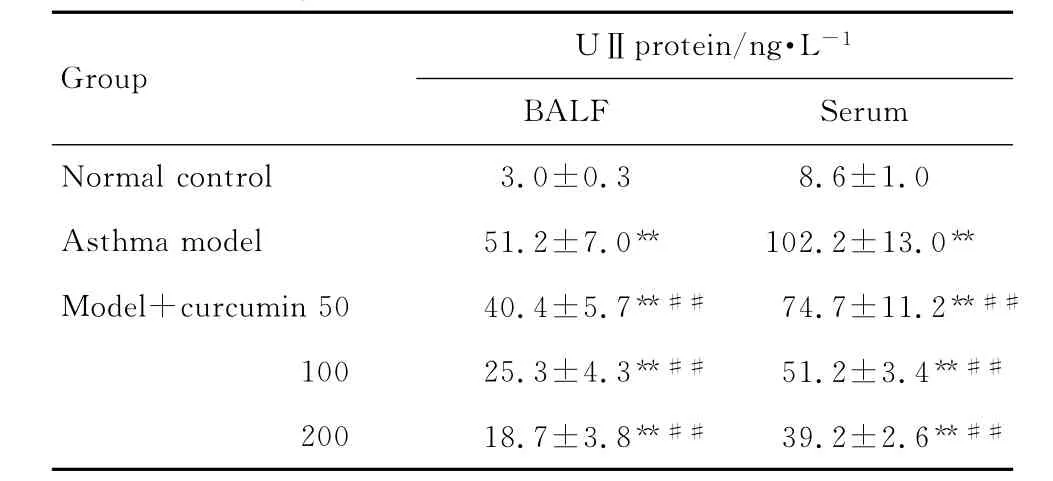
Tab.2 Effect of curcumin on UⅡprotein expression in bronchoalveolar lavage fluid(BALF)and ser um
2.3 姜黃素對哮喘大鼠肺組織中UⅡmRNA的影響
表3與圖2結果顯示,與正常對照組比較,哮喘模型組UⅡmRNA含量明顯增加(P<0.01);姜黃素干預后,UⅡmRNA含量較哮喘模型組明顯減少(P<0.01)。各組大鼠肺組織中UⅡmRNA的含量與姜黃素劑量存在負相關(r=-0.817,P<0.01)。
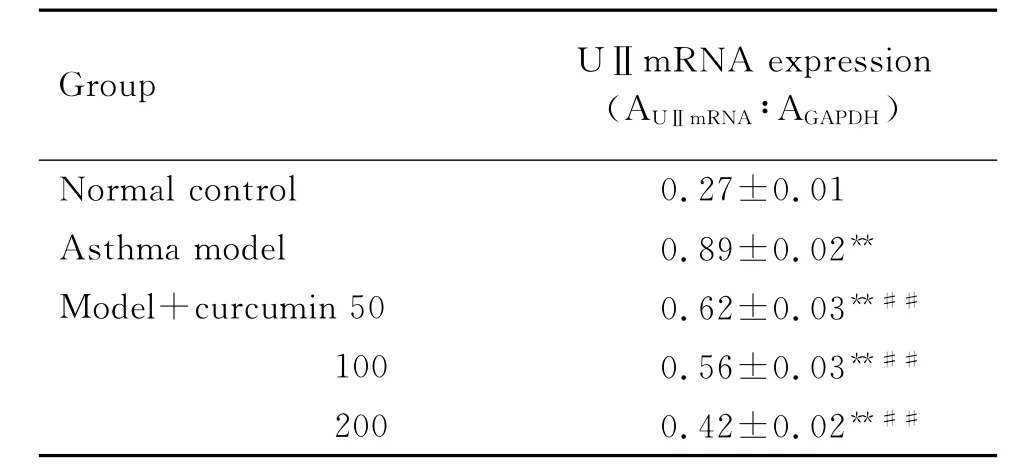
Tab.3 Effect of curcumin on UⅡmRNA expression in lung tissue of asth matic rats
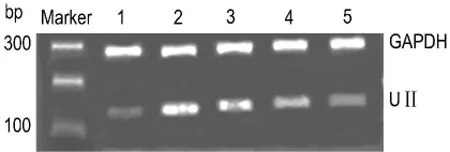
Fig.2 Effect of curcumin on UⅡmRNA expression in lung tissue of rats by RT-PCR.See Fig.1 f or the legend.Lane 1:normal contr ol group;lane 2:ast h ma model group;lanes 3-5:model+curcu min 50,100 and 200 mg·kg-1 groups,respectively.
3 討論
研究發現,哮喘患者肺組織中UⅡ表達明顯高于對照組,UⅡ可能通過促進支氣管平滑肌收縮作用參與哮喘的發病[7]。人UⅡ在氣道中具有收縮活性[8],同時UⅡ作為氣道平滑肌細胞的強絲裂原[9],呈濃度依賴性地誘導氣道平滑肌細胞增殖,其在哮喘患者血漿濃度長時間維持在較高的水平,與哮喘患者氣道重塑密切相關。
本研究結果顯示,姜黃素不同劑量組大鼠的BALF和血清中UⅡ含量及肺組織UⅡmRNA的表達均明顯低于哮喘組,且其降低UⅡ含量及表達的程度具有一定的量效關系。組織病理觀察顯示,哮喘組大鼠支氣管壁厚度及平滑肌厚度增加明顯,低劑量姜黃素即引起哮喘大鼠支氣管壁厚度及平滑肌厚度降低,且其降低程度與姜黃素濃度呈現一定的量效關系,與大鼠BALF和血清中UⅡ含量及肺組織UⅡmRNA各劑量組變化基本一致。說明姜黃素抑制哮喘大鼠氣道重塑的作用與調控UⅡ的表達變化有關。因此,對姜黃素的進一步研究有助于了解其在哮喘大鼠氣道重塑方面的作用及機制。
還有研究顯示,姜黃素對哮喘的防治作用尚與其抗炎效應有關。姜黃素能抑制大鼠多形核中性粒細胞白三烯的形成,減輕炎性細胞前炎癥因子等作用[10]。當然,姜黃素對哮喘氣道重塑的的抑制作用及機制復雜,還有待進一步研究。
[1]Masoli M.The Global Bur den of Ast h ma:Developed f or t he Global Initiative f or Ast h ma[R/OL].Beasley R.2010.USA:Ti mClar k,2010:2[2012.10].http//www.ginast hma.co m.
[2]Smit h MR,Gangireddy SR,Narala VR,Hogaboam CM,Standif or d TJ,Christensen PJ,etal.Curcu min inhibits fibrosis-related effects in IPF fibroblasts and in mice f ollowing bleo mycin-induced l ung injur y[J].Am J Physiol Lung CellMol Physiol,2010,298(5):L616-L625.
[3]Venkatesan N,Punit havat hi D,Babu M.Protection fro m acute and chr onic l ung diseases by curcu min[J].Adv Exp Med Biol,2007,595:379-405.
[4]Wu R,Chen YH,Yao WZ,Wang PP,Geng B,Tang CS.Changes of ur otensinⅡlevel in induced sput u m of patients wit h ast h ma[J].Chin J Respir Crit Care Med(中國呼吸與危重監護雜志),2008,7(2):128-131.
[5]Liang YF,Zhang WX,Li CC,Wang X M,Ge LS.Changes in urotensin-Ⅱexpression in air way remodelling in ast h matic rats[J].Chin J Contemp Pediatr(中國當代兒科雜志),2010,12(4):287-289.
[6]Guan XJ,Zhang WX,Li CC,Zheng Y M,Lin L,Ye LP,et al.The role of exter nal signal regulated kinase and transf orming gro wt h factorβ1in ast h ma air way remodeling and regulation of gl ucocorticoids[J].Natl Med J China(中華醫學雜志),2007,87(25):1767-1772.
[7]Cheng DY,Fan LL,Yi XF.The role of urotensinⅡin airway re modeling of ast h ma[J].Chin J Tuberc Respir Dis(中華結核和呼吸雜志),2006,29(6):381-384.
[8]Hay DW,Lutt mann MA,Douglas SA.Hu man ur otensin-Ⅱis a potent spasmogen of pri mate air way s moot h muscle[J].Br J Phar macol,2000,131(1):10-12.
[9]Chen YH,Zhao MW,Yao WZ,Pang YZ,Tang CS.The signal transduction pat h way in t he pr oliferation of air way s moot h muscle cells induced by ur otensinⅡ[J].Chin Med J(Engl),2004,117(1):37-41.
[10]Cho JW,Lee KS,Ki m CW.Curcu min attenuates t he expression of IL-1beta,IL-6,and TNF-alpha as well as cyclin E in TNF-alpha-treated Ha Ca T cells;NF-kappa B and MAPKs as potential upstrea m tar gets[J].Int J Mol Med,2007,19(3):469-474.

