β-連環素對人羊膜間充質干細胞增殖的影響*
張一折,蘆俊萍,張東麗,梁 碩,遲連凱,趙永輝,王滿倉,何 濤,喬露華,田 毅,楊 波,馬 軒,關方霞#
1)鄭州大學生物工程系 鄭州 450001 2)鄭州大學第一附屬醫院神經外科 鄭州 450052
羊膜間充質干細胞(amniotic membrane derived mesenchymal stem cells,AMSC)是近年來備受關注的一種新型干細胞。它具有分離培養容易、增殖快、不受倫理學限制等優越性,同時呈現出低免疫原性與免疫抑制作用,體外誘導可以多向分化,是非常理想的干細胞來源。Wnt/β-連環素(β-catenin)信號是調控神經前體細胞譜系分化、神經發育及成體腦中再生神經元成熟的重要通路[1-2],其中β-catenin的表達水平直接決定神經前體細胞(neural precursor cell,NPC)的增殖與分化[3]。Wnt屬分泌型糖蛋白,與細胞表面受體結合后,抑制細胞內糖原合成酶激酶-3β (GSK-3β) 活性,引起β-catenin在胞質內積累并進入細胞核,與淋巴樣增強因子/T細胞因子(LEF/TCF)結合,激活轉錄因子,誘導相應的靶基因c-myc、neurogenins、Neuro D等表達,從而對細胞增殖分化進行調節。近來研究[4-5]發現:β-catenin活化的骨髓間充質干細胞能刺激造血干細胞的增殖,改善干細胞微環境,穩定的β-catenin表達是長期維持造血干細胞更新的基礎。AMSC具有神經細胞生物學特性,能向神經元定向誘導。然而,β-catenin對AMSC增殖和分化的體內外調控作用尚不清楚。該實驗旨在構建介導AMSC β-catenin高表達的重組腺病毒載體,研究其對AMSC增殖的影響。
1 材料與方法
1.1材料正常足月剖宮產胎兒的胎盤(鄭州大學第一附屬醫院婦產科提供),HEK293細胞(鄭州大學基礎醫學院韓圣娜副教授惠贈),pAd-β-catenin-GFP重組腺病毒(由鄭州大學生物工程系細胞生物學研究室構建并保存),DMEM/F12培養基(購自賽默飛世爾生物化學制品有限公司),胎牛血清(購自杭州四季青生物工程材料有限公司);胰蛋白酶(購自Solarbio 公司),鼠抗β-catenin 單克隆抗體、鼠抗GSK-3β單克隆抗體(均購自Santa Cruz公司),鼠抗β-actin 單克隆抗體、HRP 標記山羊抗小鼠二抗、蛋白質Marker(購自北京鼎國昌盛生物公司)。
1.2人AMSC的分離與培養無菌條件下取正常足月剖宮產胎兒的胎盤,鈍性分離胎盤臍帶面的羊膜約10 cm×10 cm,用PBS緩沖液充分沖洗,然后將羊膜盡可能剪碎,加入2.5 g/L的胰蛋白酶,37 ℃消化30 min,終止消化后將液體倒掉,再以終質量濃度為1.0 g/L 膠原酶37 ℃消化90 min。過200目不銹鋼網將消化下來的細胞制成單細胞懸液,1 300 r/min離心8 min收集細胞,接種于75 mL培養瓶內,置37 ℃培養箱中培養48~72 h后,更換培養液,棄去未貼壁的細胞,根據細胞生長情況,每3~4 d全量換液1次。待細胞達到80%~90%融合時,用2.5 g/L的胰蛋白酶消化。用倒置顯微鏡觀察細胞消化情況,待細胞大部分胞體回縮、變圓,即終止消化,然后分為2~3份進行傳代接種培養,并記為P1代。傳代培養過程中每2~3 d全量換液,直至貼壁細胞彼此融合,鋪滿瓶底,再重復上述操作,傳代培養記為P2代,其余類推。取P3代以后細胞用于實驗操作。
1.3重組pAd-β-catenin-GFP腺病毒的擴增、純化
HEK293細胞于75 mL培養瓶生長至豐度為70%左右時,以構建好的腺病毒原液5 μL進行感染,以未加腺病毒的正常培養細胞為對照。培養24 h后,于倒置相差顯微鏡下觀察細胞形態變化,并于熒光顯微鏡下觀察GFP的熒光現象。
1.4重組pAd-β-catenin-GFP腺病毒感染AMSC后細胞生長狀態的測定AMSC鋪滿瓶底70%左右時,向75 mL培養瓶中加入100 μL腺病毒懸液,輕輕晃動瓶子,使混勻。以未加腺病毒的正常培養細胞作對照。感染24 h后,接種于96孔培養板,設3個復孔,接種后24 h采用CKK-8法測板,連測5 d。測定前每孔加入10 μL CKK-8溶液于37 ℃細胞培養箱繼續孵育2 h,使用多功能酶標儀在450 nm波長讀取吸光度值(A)并計算重組腺病毒穩定表達的AMSCs的增殖率。增殖率=(腺病毒感染組A值/對照組A值-1)×100%。
2 結果
2.1重組pAd-β-catenin-GFP腺病毒的擴增重組腺病毒感染HEK293細胞24 h后,倒置相差顯微鏡下觀察細胞出現病變現象,主要變化為細胞偽足縮短、變圓、有部分細胞脫落,與對照組細胞形態明顯不同(圖1A和B)。同時熒光顯微鏡下能看到熒光現象(圖1C)。重組腺病毒在HEK293細胞中得以大量擴增。
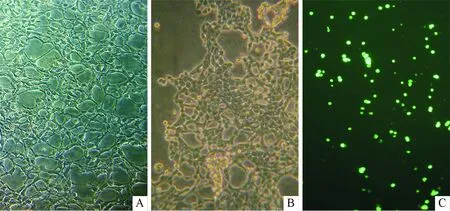
圖1 HEK293細胞形態(×100)
2.2AMSCs中β-catenin表達的熒光檢測結果GFP標記的含β-catenin的重組腺病毒感染AMSC 48 h后,倒置相差顯微鏡下觀察,發現感染組細胞與對照組細胞相比沒有明顯的形態變化,但數量上稍有增加(圖2A和B),在熒光顯微鏡下能看到大量的熒光現象(圖2C)。
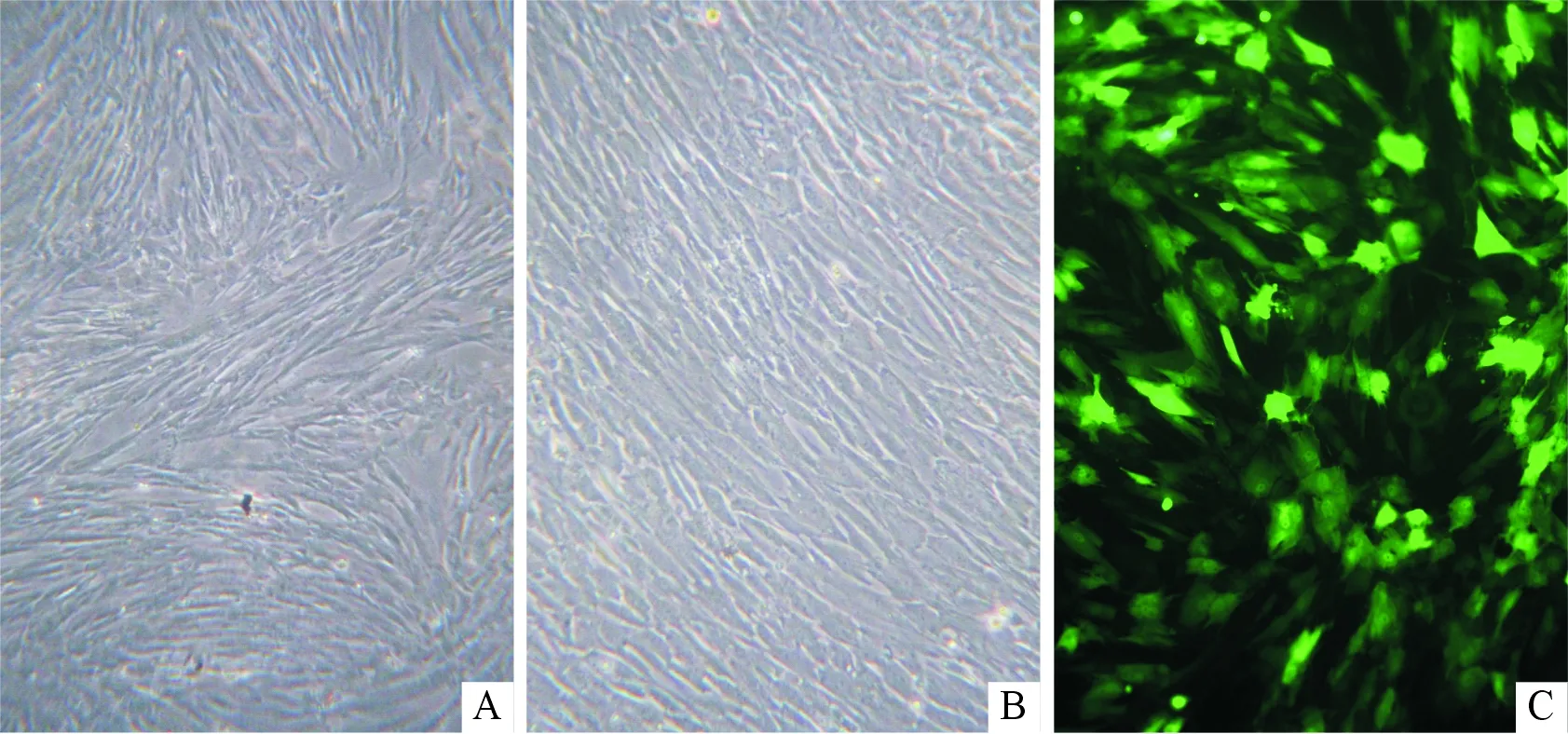
圖2 AMSC形態(×100)
2.3重組pAd-β-catenin-GFP腺病毒感染AMSC后細胞生長狀況的測定結果結果顯示,第1~5天,β-catenin穩定高表達的AMSCs增殖率分別為50.0%、82.5%、92.6%、169.1%和128.2%,明顯高于正常的AMSCs,說明高表達的β-catenin能有效地刺激AMSCs的增殖。
3 討論
β-catenin在胞質中的含量升高積累,促使它可以進一步移位至細胞核內與T細胞因子形成復合物,從而激活Wnt靶基因的轉錄,調控細胞生長;另外,β-catenin在胞質內可與鈣粘素和細胞骨架蛋白結合維持其穩定性,β-catenin的表達水平決定神經系統中NPC和神經干細胞(neural stem cell,NSC)的增殖與分化[6]。
臍血間充質干細胞、經血間充質干細胞、脂肪間充質干細胞、骨髓間充質干細胞、神經干細胞向神經元分化以及胚胎干細胞的早期增殖與Wnt 信號通路有關[7],而關于AMSC增殖、分化調控的明確機制無相關文獻報道。
β-catenin作為Wnt 信號途徑的關鍵成員,通過正、負反饋調節干細胞的數量,在內外因素中都發揮著重要的作用[8-9]。細胞內游離β-catenin在沒有Wnt 信號刺激的情況下很容易被胞內降解系統所降解,極不穩定,細胞中僅有少量的β-catenin以保證正常細胞的生理生化功能,不至于成瘤化[10],所以引入外源的β-catenin或阻礙胞質內β-catenin的磷酸化與降解,都可以進一步促使β-catenin在胞質內的積累,達到一定量后進入細胞核。從某種程度上來說β-catenin的入核意味著Wnt/β-catenin信號通路的激活。β-catenin作為把核外信號傳遞到核內的信號蛋白,在Wnt信號通路中處于關鍵地位,該蛋白的表達水平直接影響Wnt信號通路的生物學效應。
GFP能夠在紫外線的激發下發出明亮的綠色熒光[11],被認為是一種理想的報道基因,是研究細胞基因表達和表達產物分布的最好工具[12]。作者將GFP基因融合在β-catenin基因的5’端,既保留了β-catenin的轉錄激活功能,又能通過GFP直接觀察β-catenin在活細胞內的分布和表達。
腺病毒載體能夠感染多種哺乳動物細胞,宿主范圍廣,包裝容量大,對人致病性低,攜帶的外源基因在靶細胞內以附加體形式存在,并不整合到宿主染色體中,具有極低的插入突變危險性和較低的遺傳毒性;轉移效率高,容量大,無需輔助病毒,可插入外源基因的片段達7~8 kb;對于細胞是否處于分裂期無嚴格要求,能夠在增殖和非增殖細胞中感染和表達基因;同時制備簡單,可以通過超離心得到高滴度的病毒[13]。
該研究通過建立GFP標記、重組腺病毒載體介導β-catenin高表達的AMSC和體外調控β-catenin的表達,研究了經典Wnt信號通路中的β-catenin對AMSC增殖的影響。通過熒光顯微鏡檢測顯示pAd-β-catenin-GFP重組腺病毒感染AMSC后,外源β-catenin于AMSC中成功表達,且外源β-catenin對AMSC的增殖有促進作用,明顯高于對照組。
總之,該研究為了解β-catenin在AMSC細胞增殖和分化中的調節作用提供了實驗支持,并為優化AMSC在中樞神經性疾病中的臨床治療效果奠定了重要的實驗基礎。
[1]Lie DC, Colamarino SA, Song HJ, et al. Wnt signalling regulates adult hippocampal neurogenesis[J]. Nature, 2005, 437(7063):1370
[2]Hirsch C, Campano LM, Wohrle S,et al. Canonical Wnt signaling transiently stimulates proliferation and enhances neurogenesis in neonatal neural progenitor cultures[J]. Exp cell Res, 2007,313(3):572
[3]Zechner D, Fujita Y, Hülsken J, et al. Beta-Catenin signals regulate cell growth and the balance between progenitor cell expansion and differentiation in the nervous system[J]. Dev Biol, 2003, 258 (2):406
[4]Nemeth MJ, Mak KK, Yang Y, et al. Beta-Catenin expression in the bone marrow microenvironment is required for long-term maintenance of primitive hematopoietic cells[J]. Stem Cells, 2009, 27 (5): 1109
[5]Ahn JY, Park G, Shim JS, et al. Intramarrow injection of beta-catenin-activated, but not naive mesenchymal stromal cells stimulates self-renewal of hematopoietic stem cells in bone marrow[J]. Exp Mol Med, 2010, 42(2):122
[6]Li J, Zhou BP. Activation of β-catenin and Akt pathways by Twist are critical for the maintenance of EMT associated cancer stem cell-like characters[J]. BMC Cancer,2011, 11:49
[7]Kahlert UD, Maciaczyk D, Doostkam S, et al. Activation of canonical WNT/β-catenin signaling enhances in vitro motility of glioblastoma cells by activation of ZEB1 and other activators of epithelial-to-mesenchymal transition[J].Cancer Lett,2012,325(1):42
[8]Fraser A. RNA interference: human genes hit the big screen[J]. Nature, 2004, 428(6981):375
[9]Harmer D,Gilbert M,Borman R,et al.Quantitative mRNA expression profiling of ACE2, a novel homologue of angiotensin converting enzyme[J].FEBS Lett,2002,532(1/2):107
[10]King TD,Suto MJ,Li Y.The Wnt/β-catenin signaling pathway:a potential therapeutic target in the treatment of triple negative breast cancer[J].J Cell Biochem,2012,113(1):13
[11]崔柳青,張璐,張磊,等.杜氏鹽藻葡萄糖-6-磷酸異構酶在真核細胞中的表達[J]. 鄭州大學學報:醫學版,2012,47(4):434
[12]王博蔚,高尚,朱振威,等.脂質體法介導pIRES2-EGFP-hVEGF165轉染人胎盤源間充質干細胞[J].吉林大學學報:醫學版,2012,38(2):270
[13]Rodríguez ES, Pose AG, Moltó MP, et al.Biosafety evaluation of recombinant protein production in goat mammary gland using adenoviral vectors: preliminary study[J]. Biotechnol J,2012,7(8):1049

