Glut-1的表達與食管鱗狀細胞癌患者同步放化療預后的關系
樊銳太,宋 銳,王 鑫,吳 競,孫銀銀,劉 云
鄭州大學第一附屬醫院放療科 鄭州450052
有研究[1-2]報道,食管鱗狀細胞癌(食管鱗癌)單純手術切除的患者5 a生存率約為20%;對于絕大多數中晚期患者,同步放化療5 a生存率可達30%。尋找一個可靠的指標來預測同步放化療的療效對提高腫瘤控制率有重要價值。研究[3]表明,葡萄糖轉運蛋白1(glucose transporter-1,Glut-1)在食管鱗癌組織中高表達,且與外科術后腫瘤復發及預后不良密切相關,然而Glut-1對于食管鱗癌患者同步放化療預后影響的相關報道較少。為此,作者分析了Glut-1蛋白在食管鱗癌組織中的表達及其與放化療療效的關系,報道如下。
1 對象與方法
1.1研究對象收集2008年1月至2010年1月鄭州大學第一附屬醫院放療科收治的接受同步放化療的42例食管癌患者,均經纖維食管鏡活檢病理確診為食管鱗癌,全部病例均為初治。其中男30例,女12例,年齡38~82歲,中位年齡63歲。病變部位:食管頸段、胸上段、胸中段、胸下段分別為10例、11例、15例、6例。卡氏評分均≥70分,無明顯的放化療禁忌證及嚴重的心腦血管疾病病史,預計生存時間≥6個月。所有患者放療前行胸部CT、食管鋇餐造影,腹部、淋巴結B超及血常規生化檢查,按照陳建洲等[4]關于非手術治療食管鱗癌臨床分期的標準,42例患者中T1-2期20,T3-4期22例;N0期17例,N1-2期25例;M0期35例,M1期7例。治療前簽署放化療同意書。所有患者均取纖維食管鏡活檢病變組織制作石蠟標本,另取20例正常食管黏膜組織標本作對照。
1.2放射治療采用三維適形放療(3D-CRT)。患者取仰臥位,雙手抱頭,以熱塑體膜固定體位,增強CT下模擬定位,病變區域CT掃描層厚3 mm,將掃描圖像傳輸至Brain Lab治療計劃系統,進行三維重建,根據CT掃描圖像、食管鋇餐及胃鏡顯示的病變長度及縱隔淋巴結大小勾畫大體腫瘤體積(GTV),以GTV四周外放1 cm、上下外放2~3 cm構成臨床靶體積(CTV),計劃靶體積(PTV)為CTV外放0.5 cm,以95%的等劑量曲線包括PTV作為處方劑量,同時勾畫出危及器官(OAR)和鄰近組織,計劃要求[5]脊髓劑量<40 Gy,肺V20[即全肺(扣除靶區PTV)接受20 Gy以上治療的肺體積的百分比]<25%。采用西門子直線加速器6 MV X線,5~8個共面野照射,常規分割1.8~2.0 Gy/次,1次/d,5次/周,總劑量54~70 Gy。
1.3化學治療42例患者中,除2例T1N0M0患者未行同步化療外,其余40例均從放射治療開始前5 d給予順鉑75 mg/m2(第1天或分割為第1~4天)+5-FU 800 mg/m2(第1~5天),21 d為1個周期,至少應用2周期。應用順鉑時給予大量水化、利尿,應用阿扎司瓊、胃復安預防消化道反應,應用粒細胞集落刺激因子改善骨髓抑制造成的白細胞減少,同時給予充分的支持治療。治療期間每周行血常規檢查1次,每2周行肝腎功能及生化檢查1次。所有患者平均化療3.97個周期。
1.4Glut-1蛋白表達的免疫組化檢測全部標本經體積分數10%甲醛固定,石蠟包埋,4 μm厚連續切片, 采用免疫組化SP法染色。兔抗人Glut-1多克隆抗體(即用型)和SP試劑盒均購自福州邁新生物技術公司,按照說明書步驟操作,DAB顯色,用已知陽性片作陽性對照,用PBS代替一抗作陰性對照。Glut-1以胞膜或胞質出現棕黃色顆粒為陽性。判定標準:無色得0分,淺黃色得1分,棕黃色得2分,棕褐色得3分;按照陽性細胞百分比打分(在高倍光學顯微鏡下選擇5個視野,每個視野計數100個腫瘤細胞),<10%得0分,10%~得1分,25%~得2分,>50%得3分。兩項得分相乘為最終得分,≤2分定義為低表達,≥3分為高表達。
1.5療效評價放療結束時及結束后3個月內行胸部CT增強掃描、食管鋇餐造影及頸部淋巴結、腹部彩超檢查評價療效,參照RECIST標準[6]進行療效評價:完全緩解(CR),部分緩解(PR),無效(NR)。局部控制時間:從開始治療至疾病的局部復發的時間。生存時間:從開始治療至死亡的時間。
1.6隨訪患者放療后1 a內每3個月復查1次,1 a以后每6個月復查1次,通過查閱病歷、電話、郵件等方式隨訪至2012年10月,全部患者中28例死亡,其中1例死于突發腦血管意外;14例仍在隨訪中。
1.7統計學處理采用SPSS 17.0進行分析,應用χ2檢驗比較不同臨床病理特征人群Glut-1表達率的差異。應用Kaplan-Meier法繪制生存曲線,用log-rank檢驗比較Glut-1高、低表達組放化療療效的差異,檢驗水準α=0.05。
2 結果
2.1食管鱗癌組織中Glut-1的表達Glut-1的表達產物定位于細胞膜,著色深度不等,呈現連續或顆粒狀的棕黃色。42例食管鱗癌組織中Glut-1蛋白高表達17例(40.5%),20例正常食管黏膜組織中高表達2例(10.0%),差異有統計學意義(χ2=5.921,P=0.015),見圖1。

圖1 食管鱗癌組織(A)和正常食管黏膜組織(B)中Glut-1蛋白的表達(SP,×400)
2.2Glut-1的表達與食管鱗癌各臨床病理特征的關系見表1。Glut-1高表達與臨床T、N、M分期有關(P<0.05),與患者年齡、性別、腫瘤病變部位無關(P>0.05)。

表1 Glut-1表達與食管鱗癌各臨床病理特征的關系 例
*校正χ2檢驗。
2.3Glut-1的表達與食管鱗癌放化療療效的關系
42例患者均順利完成放療。放療結束后3個月評價療效,Glut-1蛋白高表達和低表達組近期CR率分別為52.9%(9/17)和88.0%(22/25),差異有統計學意義(χ2=4.748,P=0.029)。2組1、2、3 a局部控制率分別為58.8%、29.4%、17.6%和80.0%、64.0%、36.0%,差異有統計學意義(χ2=4.736,P=0.028)(圖2);2組中位生存期分別為19個月和35個月,1、2、3 a生存率分別為64.7%、35.3%、17.6%和88.0%、68.0%、44.0%,差異有統計學意義(χ2=4.542,P=0.016)(圖3)。
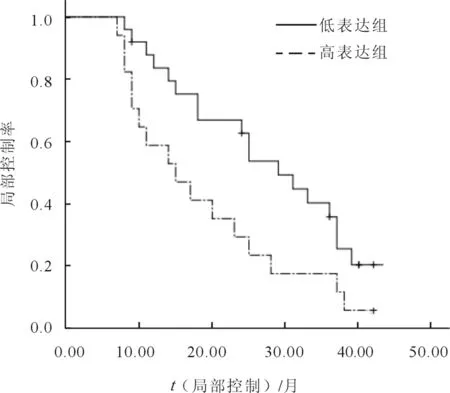
圖2 Glut-1的表達與食管鱗癌放化療的關系(局部控制曲線)
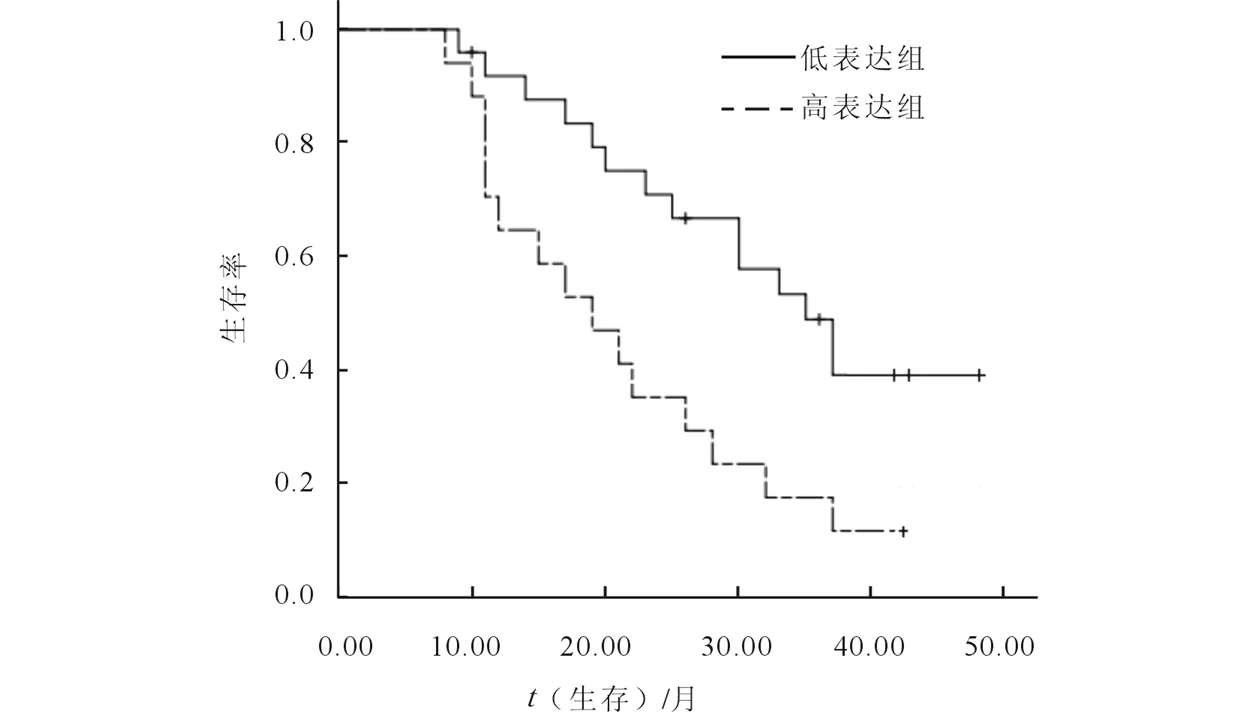
圖3 Glut-1的表達與食管鱗癌放化療的關系(生存曲線)
3 討論
腫瘤細胞的主要特點[7]是持續生長、快速增殖,對葡萄糖的攝取和代謝處于持續增高狀態,這種高代謝狀態使細胞耗氧量不斷增加,造成腫瘤微環境缺氧,為適應缺氧微環境,腫瘤細胞通過無氧酵解來滿足腫瘤生長對能量的高需求。糖代謝增強過程由葡萄糖轉運蛋白家族介導[8],其中以Glut-1分布最廣。Glut-1是哺乳動物葡萄糖跨膜轉運的主要載體,隨著代謝的增加,腫瘤組織中Glut-1蛋白進一步增加,Glut-1的高表達與腫瘤細胞缺氧和葡萄糖代謝的增加密切相關。國內外許多學者研究[9-12]發現,在乳癌、頭頸部腫瘤、胃癌和非小細胞肺癌等許多惡性腫瘤中,Glut-1蛋白表達均明顯增高,并且認為Glut-1過表達是預后不良的標志。
該研究結果顯示食管鱗癌組織中Glut-1蛋白高表達率高于正常食管黏膜組織,與Hiyoshi 等[3]研究結果近似,說明Glut-1蛋白與食管鱗癌的發生密切相關。作者根據免疫組化染色結果將全部患者分為Glut-1蛋白高表達組和低表達組進行分析,發現Glut-1高表達與食管鱗癌臨床T、N、M分期有關,與患者年齡、性別、腫瘤病變部位無關,這與許潔等[13]的研究結果一致。
作者觀察同步放化療后Glut-1蛋白高低表達患者的預后,發現Glut-1蛋白高表達者近期CR率、中位生存期、局部控制率和生存率均低于低表達組,表明Glut-1蛋白對于食管鱗癌患者局部控制和預后均有重要影響。組織乏氧和細胞增殖活性的不斷增加是導致放化療抵抗的主要原因,腫瘤微環境缺氧和葡萄糖攝取量的增加導致Glut-1表達增加,致使同步放化療效果不佳。
總之,該研究初步探討了Glut-1蛋白對食管鱗癌患者同步放化療預后的影響,Glut-1高表達患者的放化療效果不佳,但其具體作用機制以及較為針對性的治療措施還需進一步研究。
[1] 王瑞林.晚期、復發轉移性食管鱗癌姑息性藥物治療進展[J].腫瘤基礎與臨床,2009,22(1):83
[2] 翟醫蕊,馮勤付.食管鱗癌同步放化療研究進展[J].腫瘤學雜志,2010,16(1):14
[3] Hiyoshi Y, Watanabe M, Imamura Y,et al. The relationship between the glucose transporter type 1 expression and F-fluorodeoxyglucose uptake in esophageal squamous cell carcinoma[J]. Oncology,2009,76(4):286
[4] 陳建洲,陳創珍,李德銳,等.非手術治療食管鱗癌臨床分期的驗證[J].中國腫瘤,2012,21(5):374
[5] 石麗婉,傅麗蓉,哈晦明,等. 胸中段食管鱗癌根治性放療三維適形放療與調強放療劑量學比較[J].中國醫學物理學雜志,2012,29(1):3104
[6] 徐皖湘. RECIST標準評價食管鱗癌臨床分期的化療效果[J].腫瘤基礎與臨床,2009,22(4):343
[7] 張紅,李真珍,王志永,等.食管鱗狀細胞癌組織中HIF-1α和AQP1蛋白的表達[J].鄭州大學學報:醫學版,2011,46(3):335
[8] 趙衛,付艷忠,任宏政,等.食管鱗癌組織中葡萄糖轉運蛋白1、血管內皮生長因子和環氧合酶-2蛋白檢測[J]. 鄭州大學學報:醫學版,2007,42(5):861
[9] 沈春燕,穆海玉,佟仲生.葡萄糖轉運蛋白1在乳腺癌組織中的表達及與其預后的關系[J].實用癌癥雜志,2011,26(6):575
[10]Ayala FR, Rocha RM, Carvalho KC,et al.GLUT1 and GLUT3 as potential prognostic markers for Oral Squamous Cell Carcinoma[J]. Molecules,2010, 15(4):2374
[11]Wei B, Chen L, Li J.Expression of glucose transporter 1 in gastric carcinoma and metastatic lymph nodes and its association with prognosis[J]. Zhonghua Wei Chang Wai Ke Za Zhi,2009, 12(3):277
[12]Meijer TW, Schuurbiers OC, Kaanders JH,et al.Differences in metabolism between adeno- and squamous cell non-small cell lung carcinomas: spatial distribution and prognostic value of GLUT1 and MCT4[J]. Lung Cancer,2012,76(3):316
[13]許潔,操寄望.缺氧標記物HIF-1α、GLUT-1在食管鱗癌中的表達及其臨床意義[J].武漢大學學報:醫學版,2008,29(4):451

