自發性高血壓大鼠學習記憶能力和腦組織SK2蛋白的表達*
俞 悅 ,王 震,穆永慧,趙偉達,韓麗娟,張 展,章 茜,楊 春#
1)鄭州大學臨床醫學系 鄭州 450052 2)鄭州大學基礎醫學院生理學教研室 鄭州 450001 3)河南大學生命科學院 開封 475004
高血壓病是危害人類健康的最主要疾病之一,可對人體心、腦等靶器官造成嚴重損害[1]。高血壓作為腦血管病的重要危險因素之一, 對認知功能的影響已經得到關注[2-3]。小電導鈣激活鉀通道(small conductance Ca2+-activated K+channels,SK channels)在腦組織中高表達[4],參與神經元動作電位后電位的形成[5],被認為與突觸可塑性以及學習記憶能力密切相關[6-7]。作者利用自發性高血壓(spontaneously hypertension,SH)大鼠,運用無創實驗方法,探討自發性高血壓對大鼠學習記憶能力及腦組織SK2蛋白表達的影響,為深入研究自發性高血壓對認知功能的影響及其相關分子機制提供依據。
1 材料與方法
1.1實驗動物與分組SH大鼠和對照Wistar-Kyoto(WKY) 大鼠各7只,7~8月齡,體質量200~300 g,均購自北京維通利華公司。
1.2鼠尾動脈壓的測量將大鼠置于固定盒中,將尾套置于鼠尾根部,脈搏傳感器傳感片緊貼鼠尾下方,然后將鼠尾及尾套預熱,同時等待大鼠安靜,待脈搏穩定之后,使用球囊打氣加壓直至脈搏波呈直線,緩慢放氣,待脈搏波動出現時,此時測量的尾套內氣體壓力即鼠尾動脈壓。
1.3心電圖測量大鼠經體積分數10%水合氯醛麻醉(3 mL/kg)后固定于鼠板上,將針形電極刺入四肢皮下,采用Rm6240型多道生理信號采集處理系統(成都儀器廠)連續記錄Ⅱ導聯心電圖1 h,測量P波時長、P-R間期、QRS時長、R-R間期。
1.4大鼠學習記憶能力的測試
1.4.1 Y型迷宮實驗[8]Y型迷宮(張家港生物醫學儀器廠)由3只短臂組成,以大鼠所在短臂為起步區,另兩只短臂中隨機選擇一只為安全區,一只為非安全區。安全區燈泡開亮,銅柵無電流。起步區和非安全區燈泡不亮,銅柵有電流(約40 V)。控制開關打開后,安全區燈光立刻亮起,起步區和非安全區延遲2 s后通電。若大鼠在燈光亮起時能成功逃向安全區,則記為“正確”,否則記為“錯誤”;5 s后進行第2次操作。若連續10次中有9次正確,則視為“學會”,這10次操作之前的操作次數記為“學會次數”;若100次后仍未學會,則“學會次數”記為100。24 h后,重復此操作,若連續10次中有9次正確,則視為“記住”,這10次操作之前的操作次數記為“記憶次數”;若100次后仍未學會,則“記憶次數”記為100。
1.4.2 跳臺實驗 自制30 cm×30 cm×30 cm被動回避反應箱,四周用塑料板分隔,箱底為可通電的銅柵,箱底中間置一7 cm×7 cm×7 cm的絕緣泡沫正方體,作為小鼠回避電擊的安全臺,由一可調變壓器調節電壓,提供交流電。實驗前將大鼠放在銅柵上,適應3 min,然后將大鼠放上平臺,等大鼠跳下后再將其放回平臺上,如此重復5次;然后給予持續電刺激(約40 V),大鼠受刺激后會自動跳上平臺,如此反復訓練,直至大鼠在平臺上一次持續停留時間超過5 min,視為“學會”。記錄此過程中的“上臺次數”和受電擊總時間“Ta”。當20 min內仍未學會時,若上臺次數大于該組中學會者的最高上臺次數,則記為其“上臺次數”,否則以該組學會者的最高上臺次數作為其“上臺次數”。24 h后,將大鼠置于跳臺上,通電,記錄5 min內的“下臺次數”和受電擊總時間“Tb”。
1.5大鼠腦組織SK2蛋白的檢測迷宮和跳臺實驗結束后,大鼠經體積分數10%水合氯醛麻醉(3 mL/kg)后迅速斷頭取腦,-80 ℃冰箱儲存備用。冰下從腦組織中提取蛋白,采用Western blot法檢測SK2蛋白。提取的蛋白樣品加入5×loading buffer,99 ℃煮沸5 min,100 g/L SDS-PAGE分離膠上樣后100 V電泳3 h;取下凝膠,4 ℃恒壓(100 V)電轉2 h。取下PVDF膜(Bio-Rad公司),50 g/L 脫脂牛奶-TBS室溫封閉1 h,隨即加入兔多克隆抗SK2抗體(按1150稀釋,Sigma公司)4 ℃孵育過夜。次日,TBST洗膜,辣根過氧化物酶標記的山羊抗兔IgG(按15 000稀釋,Thermo公司)室溫孵育2 h,TBST漂洗,ECL化學發光曝光顯影。
1.6統計學處理采用SAS 9.0進行統計分析。2組大鼠鼠尾動脈壓、心電圖參數、學習次數和記憶次數、上下臺次數及Ta、Tb的比較均采用兩獨立樣本t檢驗,檢驗水準α=0.05。
2 結果
2.1 2組大鼠血壓和心電圖指標的比較見表1。
2.2 2組大鼠學習記憶能力測試結果Y型迷宮實驗結果見表2,跳臺實驗結果見表3。
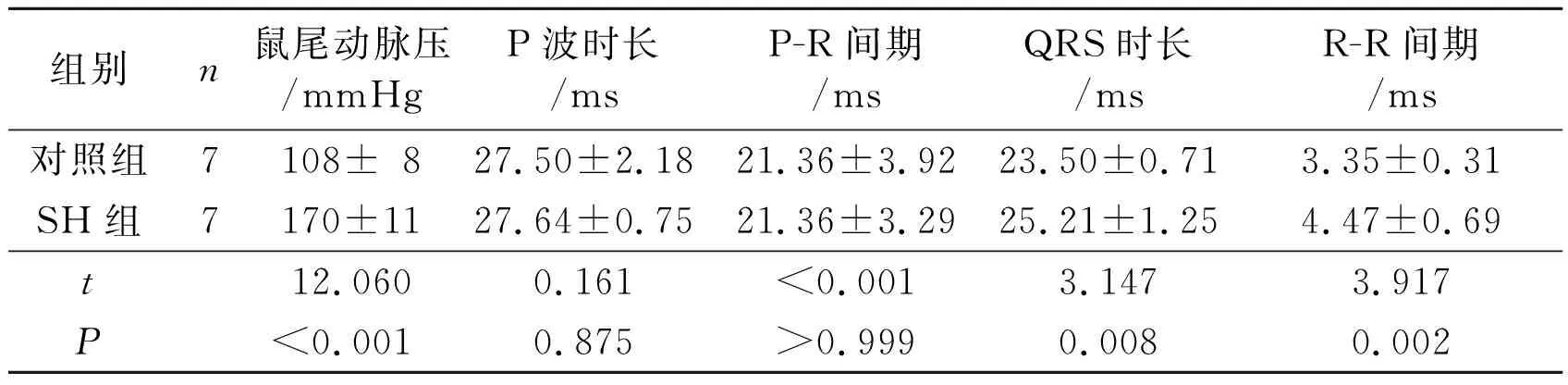
表1 2組大鼠血壓和心電圖指標的比較
1 mmHg=0.133 kPa。
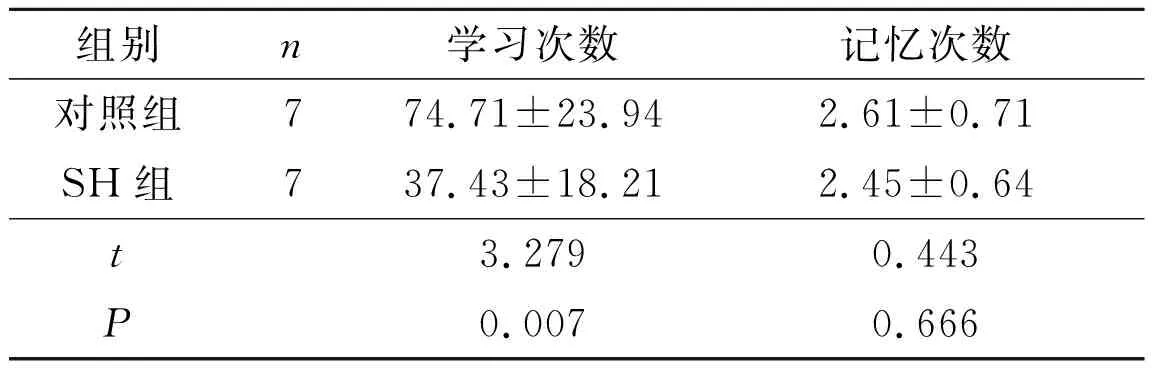
表2 Y型迷宮實驗結果
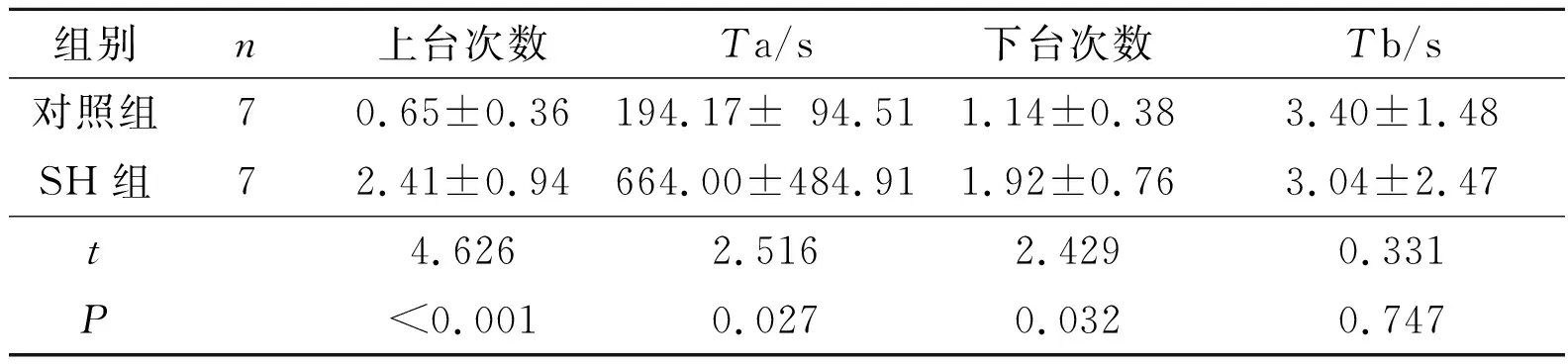
表3 跳臺實驗結果
2.3 2組大鼠腦組織SK2蛋白的表達見圖1。SH組大鼠腦組織SK2蛋白表達高于對照組。
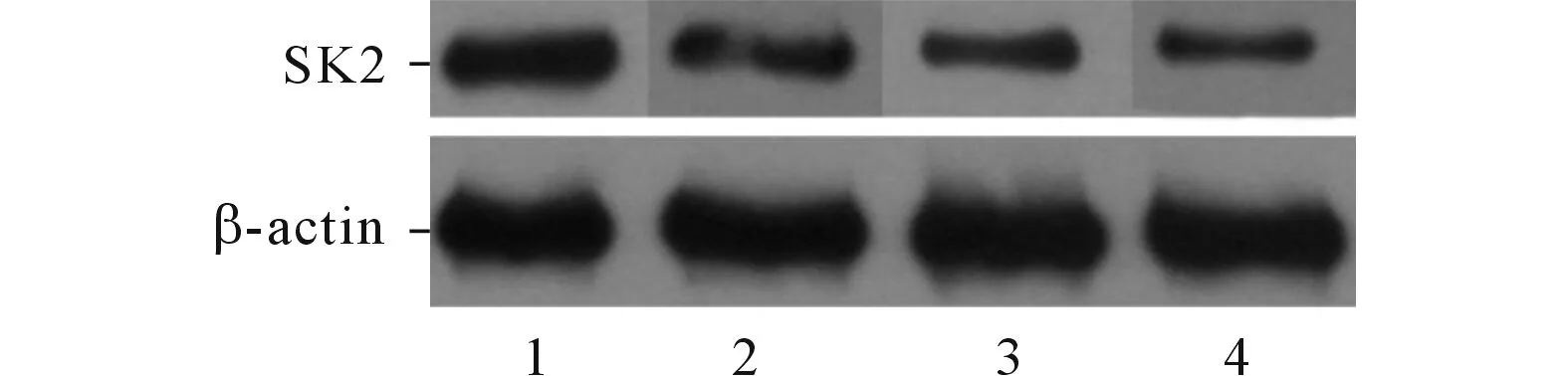
圖1 2組大鼠腦組織SK2蛋白的表達
3 討論
SH大鼠是用Wistar-Kyoto大鼠培育而成,出生后3個月內便能發展成為穩定的高血壓;其發病機制、心血管并發癥、外周血管阻力變化等都與人類高血壓病相似,是目前公認的最接近于人類原發性高血壓的動物模型[9]。該實驗選用的SH大鼠血壓較對照組大鼠明顯升高,說明該模型大鼠符合高血壓模型條件。同時心電圖測量結果顯示SH大鼠QRS時長和R-R間期延長,提示其可能有心室肥厚和緩慢性心律失常,說明高血壓已經對該模型大鼠心臟造成損傷,這與人類高血壓患者的心功能表現相似[10]。
認知指人體對外界事物的認識辨析能力, 是大腦高級中樞的重要功能之一。臨床研究以及流行病學調查顯示,長期高血壓對個體的認知功能有一定程度的損傷。該研究采用Y型迷宮實驗中大鼠正確反應前所需的電擊次數、跳臺實驗中大鼠正確反應前上下臺次數和受電擊時間,表示其空間辨別能力和逃避條件反射能力[7]。結果證實了SH大鼠學習能力較對照組大鼠明顯減退。此結果與Stocker等[5]報道的SH大鼠在諸如條件性回避反射和空間辨別等學習記憶能力降低相一致[11]。
近年來,一些研究表明,SK通道與海馬學習記憶及突觸可塑性有關,SK通道蛋白表達異常可導致動物認知功能障礙。Hammond等[12]研究發現,與野生型小鼠相比,SK2蛋白過表達的小鼠高頻刺激后的長時程增強效應減弱,海馬相關的記憶功能嚴重受損。Vick等[13]發現,SK通道的過表達可影響記憶編碼,損害記憶。另一方面,Ballesteros-Merino等[14]研究發現,SK通道阻滯劑蜜蜂神經毒素能夠選擇性阻斷SK通道,增加在海馬信息加工處理中發揮重要作用的CA1錐體神經元的興奮性突觸后電位數量,從而異化學習記憶能力。Liegeois等[15]的研究顯示,荷包牡丹堿能夠有效地抑制SK通道引起的神經元后超極化,抑制神經元細胞興奮性的減低,從而增強相關學習記憶能力。該研究發現SH大鼠腦組織SK2蛋白表達較對照大鼠增強,提示SK通道可能參與了高血壓大鼠認知損害的過程,但是其作用的分子機制尚待進一步研究。
綜上所述,自發性高血壓可引起心臟功能異常,學習記憶能力減退, 而SK通道在學習記憶能力損害的過程中可能發揮重要作用。該研究為深入探討自發性高血壓對認知功能的影響及相關分子機制提供了實驗依據。
[1]趙雅寧,李建民,劉樂,等.內質網應激相關分子GRP78在高血壓加重全腦缺血大鼠神經損傷中的作用[J]. 南方醫科大學學報,2012,32(11):1675
[2]Vasilopoulos T, Kremen WS, Kim K, et al. Untreated hypertension decreases heritability of cognition in late middle age[J]. Behav Genet,2012,42(1):107
[3]Púzserová A, Kopincová J, Bernátová I. Endothelial (dys) function in the experimental model of primary hypertension[J]. Cesk Fysiol,2010,59(1):4
[4]Kohler M, Hirschberg B, Bond CT, et al. Small conductance, calcium-activated potassium channels from mammalian brain[J]. Science,1996,273(5282):1709
[5]Stocker M. Ca2+-activated K+channels: molecular determinants and function of the SK family[J]. Nat Rev Neurosci, 2004, 5(10):758
[6]Bond CT, Maylie J, Adelman JP. SK channels in excitability, pacemaking and synaptic integration[J]. Curr Opin Neurobiol, 2005,15(3):305
[7]Ohtsuki G, Piochon C, Adelman JP, et al. SK2 channel modulation contributes to compartment-specific dendritic plasticity in cerebellar Purkinje cells[J]. Neuron, 2012,75(1):108
[8]Jiwa NS, Garrard P, Hainsworth AH. Experimental models of vascular dementia and vascular cognitive impairment: a systematic review[J]. J Neurochem, 2010 ,115(4):814
[9]田心,王蓓,王長海,等. 以自發性高血壓大鼠為模型對高血壓發病機制的研究[J]. 華中醫學雜志,2009,33(2):112
[10]孫剛.高血壓左心室肥厚臨床危害及治療對策[J]. 中國實用內科雜志,2011,31(8):598
[11]Sánchez F, Gómez-Villalobos Mde J, Juarez I,et al. Dendritic morphology of neurons in medial prefrontal cortex, hippocampus, and nucleus accumbens in adult SH rats[J]. Synapse,2011,65(3):198
[12]Hammond RS, Bond CT, Strassmaier T, et al. Small-conductance Ca2+-activated K+channel type 2 (SK2) modulates hippocampal learning, memory, and synaptic plasticity[J]. J Neurosci,2006, 26(6):1844
[13]Vick KA 4th, Guidi M, Stackman RW Jr. In vivo pharmacological manipulation of small conductance Ca2+-activated K+channels influences motor behavior, object memory and fear conditioning[J]. Neuropharmacology,2010,58(3):650
[14]Ballesteros-Merino C, Lin M, Wu WW, et al. Developmental profile of SK2 channel expression and function in CA1 neurons[J]. Hippocampus,2012,22(6):1467
[15]Liegeois JF, Mercier F, Graulich A, et al. Modulation of small conductance calcium-activated potassium(SK) channels: a new challenge in medicinal chemistry[J]. Curr Med Chem,2003,10(8):625

