PPARα轉基因小鼠在藥物評價中的應用研究
尉明曉,秦 超,陳 威,高 潔,趙顯莉,高 虹
(中國醫學科學院北京協和醫學院實驗動物研究所,衛生部人類疾病比較醫學重點實驗室,國家中醫藥管理局人類疾病動物模型三級實驗室,北京 100021)
代謝綜合癥(表現為高血壓、內臟肥胖、胰島素抵抗、脂質代謝異常)的治療是目前醫學界面臨的一大難題。過氧化物酶體增殖激活受體 α(peroxisome proliferators-activated receptor α,PPARα),參與調控脂質代謝和免疫反應等生理過程,能夠改善代謝綜合征的狀況。因此,近年來,臨床上的PPARα激動劑藥物常被用來進行降血脂的治療。使用PPARα轉基因小鼠進行PPARα激動劑藥物的臨床前評價,建立一種藥效學敏感的動物模型,用于該類藥物的早期篩選,為藥物研發機構節約時間和經費,為人類的臨床用藥提供理論依據。本課題著重探討利用 PPARα轉基因小鼠進行PPARα激動劑藥物的藥效學評價的可行性。
1 材料和方法
1.1 實驗動物
PPARα轉基因小鼠,由中國醫學科學院醫學實驗動物研究所遺傳中心構建,6月齡的C57BL/6小鼠,購自北京維通利華實驗動物技術有限公司,合格證號 SCXK(京)2012-0001。36只小鼠飼養于SPF級環境中,動物設施許可證號 SYXK(京)2008-0012。飼喂的高脂飼料購自軍事醫學科學院實驗動物中心,飼料配方為:豬油10%,蔗糖15%,膽固醇1%,蛋黃粉10%,膽酸鈉0.1%,基礎鼠料63.9%,飼料合格證:SCXK(軍)-2007-005。
1.2 試劑以及儀器
非諾貝特藥物由北京益民藥業有限公司生產。7100型全自動生化分析儀,日本日立公司產品。
1.3 動物分組以及給藥方法
實驗小鼠總共分為4組。27只PPARα轉基因小鼠隨機分成3組,每組9只,分別為對照組1、高劑量組(非諾貝特60 mg/kg)、低劑量組(非諾貝特30 mg/kg)。人每天用藥物非諾貝特劑量為0.3 g,按照“人和動物間按體表面積折算的等效劑量比值表”,20 g小鼠和70 kg人的交叉匯合處為0.0026,按人的平均體重70 kg計算,小鼠的折合劑量為0.3 g/70 kg×70 kg×0.0026/20 g=39 mg/kg。選取 60 mg/kg作為高劑量,30 mg/kg作為低劑量組,同時設置9只C57BL/6小鼠作為對照組2。每只動物灌胃體積為0.2 mL/10 g體重。各種小鼠在同等的SPF級環境下飼養,自由攝食、飲水。各組動物分別在6周齡時給予高脂飼料喂養一個月,然后連續非諾貝特灌胃一個月。分別于給藥前后檢測動物的肝功能指標、腎功能指標和血脂生化指標(表1)。

表1 實驗小鼠分組及給藥方法Tab.1 The medication method and group of laboratory mouse
1.4 觀察指標與方法
1.4.1 大體觀察
每天觀察一次,觀察指標包括小鼠外觀和行為(包括小鼠的皮膚毛發,眼和黏膜的變化,呼吸,中樞神經系統,四肢活動及其他表現)、分泌物和排泄物等。每周測定小鼠體重。
1.4.2 血生化指標的檢測
4組實驗小鼠在非諾貝特灌胃前、灌胃結束后眼眶靜脈叢取血,留取血清檢測血液生化指標。肝臟功能的指標包括丙氨酸氨基轉移酶(ALT)、天冬門氨酸氨基轉移酶(AST)、堿性磷酸酶(ALP)。腎臟功能的指標包括血尿素氮(BUN)、血清肌酐(SCR)。血脂生化的指標包括膽固醇(CHO)、甘油三酯(TG)、高密度脂蛋白膽固醇(HDL-C)、低密度脂蛋白膽固醇(LDL-C)、游離脂肪酸(NEFA)。
1.5 統計學分析
采用SPSS 12.0統計軟件進行分析,結果以表示,P<0.05為差異具有顯著性,P<0.01為差異非常具有顯著性,P<0.001為差異極其具有顯著性。統計學方法為t檢驗,方差分析,非參數檢驗。
2 結果
2.1 一般體征觀察
整個實驗過程中小鼠的皮膚正常無脫毛現象,眼睛與黏膜無異常分泌物,呼吸平穩,活動正常,無抽搐震顫等異常現象發生。動物給藥后體重變化不大,各組之間的體重沒有明顯差異(P>0.05)(表2)。
2.2 PPARα激動劑對血生化指標的影響
動物開始給藥前,各組之間的10項血生化指標沒有顯著性差異(P>0.05)(表3)。①給藥后各組比較:從圖1可以看出,與對照組1比較,非諾貝特各劑量組均能明顯升高CHO(P<0.05)和HDL-C(P<0.01),明顯降低 TG(P<0.05)。各組之間的體重沒有明顯差異(P>0.05)。與對照組2比較,非諾貝特各劑量組均能顯著升高 HDL-C(P<0.01),顯著降低 TG(P<0.01),提示 PPARα轉基因小鼠對該藥物更敏感。②給藥前后各組比較:從圖1可以看出,與給藥前比較,給藥后高劑量組能明顯降低 ALT、AST、ALP、BUN、TG(P < 0.05);能明顯升高CHO、HDL-C(P<0.01)。而低劑量組能明顯降低ALP(P<0.05);能明顯升高 CHO、HDL-C(P<0.05),但腎功能指標在正常范圍內,沒有臨床意義。結果提示高劑量組的降血脂效果優于低劑量組。給藥前后的血生化指標(表3)。
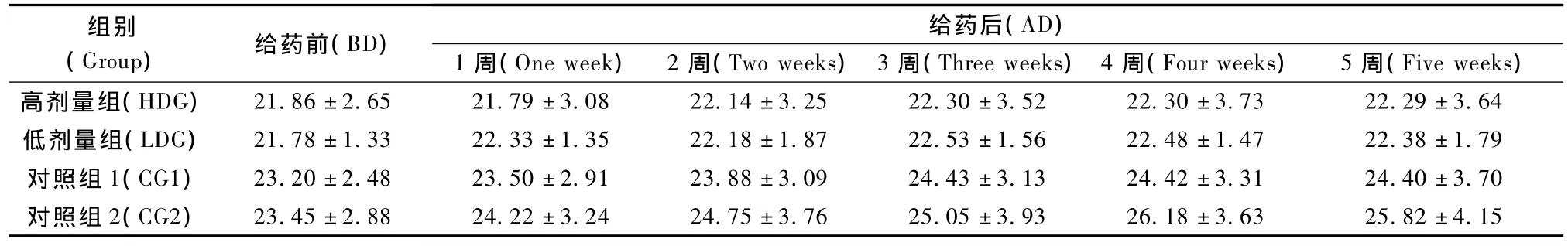
表2 給藥后小鼠體重變化Tab.2 Change of mouse weight with the medication administration
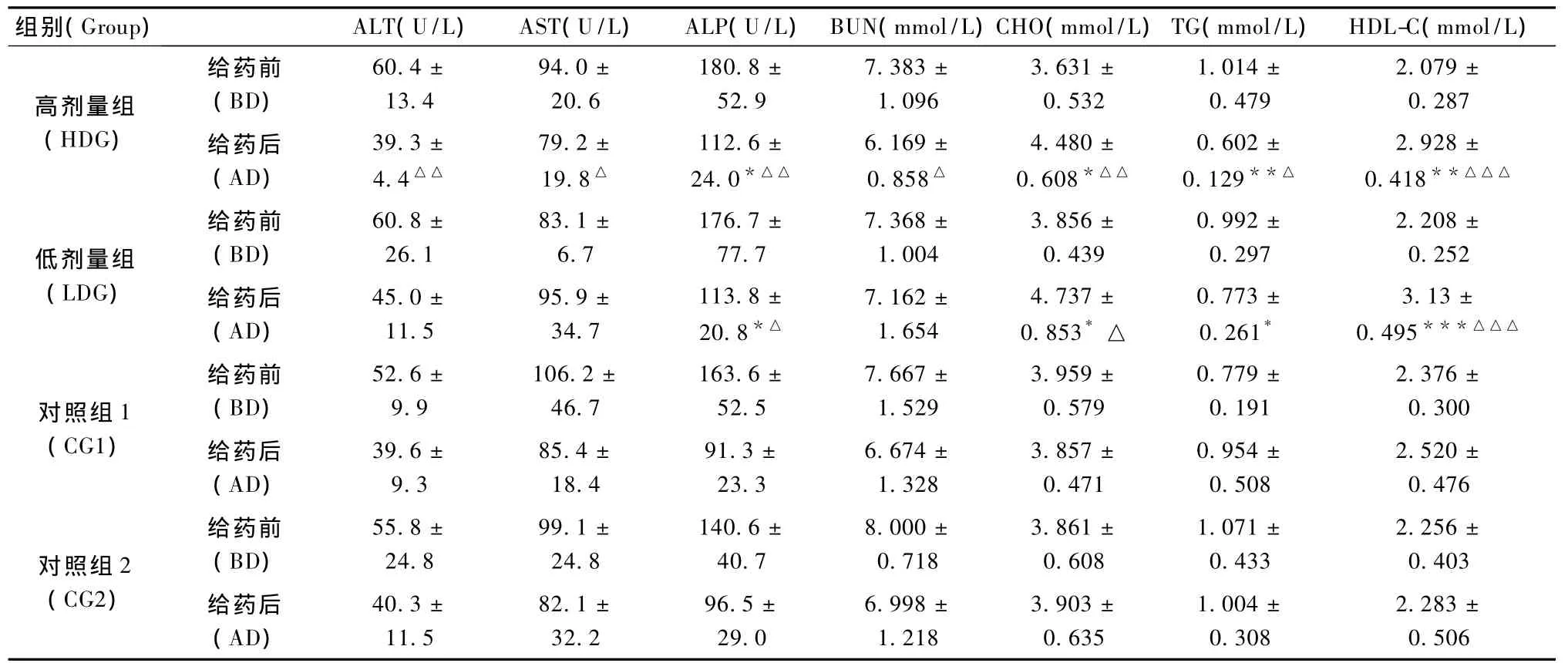
表3 給藥前后的血生化指標變化Tab.3 Change of serum index with the medication administration
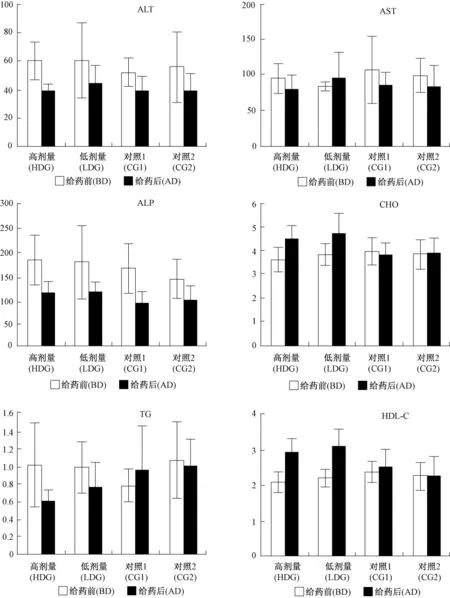
圖1 給藥前后血生化的變化。Fig.1 Change of serum index(ALT、AST、ALP、CHO、TG、HDL-C)with the medication administration.
3 討論
PPARα受體是今年來新發現的一種甾體激素類受體,作為PPARα受體的一個亞型,在脂質代謝、炎癥過程、免疫反應等生理過程中發揮著巨大的作用。PPARα主要分布在代謝活性較高的組織中,如腎、肝、心臟、肌肉組織[1]。PPARα 在肝臟脂質代謝中發揮著巨大的作用。PPARα激動劑圍繞降血脂這一中心功能與臨床上許多疾病有關,比如改善脂質代謝、動脈粥樣硬化、心血管疾病、非酒精性脂肪肝、抗炎、保護血管內皮等作用[2-10]。
代謝綜合癥表現為高血壓、內臟肥胖、胰島素抵抗、脂質代謝異常,它的治療是醫學界面臨的一大難題。PPARα基因參與調控脂質代謝和免疫反應等生理過程,能夠改善代謝綜合癥的癥狀[11]。
轉基因動物具有與人類相似的疾病致病原因、機制的優點,使用其評價的藥物,其結果更加準確。轉基因動物已在抗腫瘤藥物、抗艾滋病藥物、抗肝炎病毒藥物、腎臟疾病藥物的篩選中取得了突破性的進展[12]。本課題著重利用PPARα轉基因小鼠進行PPARα激動劑藥物的藥效學評價。
有文獻報道[13-14],PPARα 激動劑降低甘油三酯的水平,升高高密度脂蛋白膽固醇成分,能夠誘導膽固醇從巨噬細胞和泡沫細胞里移出。在導致低血糖的長時間的禁食下,脂肪酸從脂肪沉積的部位游走到肝臟,在肝臟它們被攝取,氧化和代謝成酮體,PPARα在這代謝過程中能起到中樞性的作用[15]。本文的實驗結果與文獻報道一致,脂肪酸的下降不明顯可能與灌胃時間為一個月有關,延長灌胃時間可能會出現脂肪酸的下降。關于脂肪酸的下降方面的研究值得我們進一步探討。
與給藥前比較,給藥后高劑量組和低劑量組能明顯升高 CHO、HDL-C,能明顯降低肝功能指標。臨床上高血脂常伴有輕到重度的脂肪肝,引起肝功能指標的上升,PPARα激動劑能夠顯著改善脂肪肝的狀況[10],在本實驗中給藥后高劑量組能明顯降低ALT、AST、ALP,與文獻報道結果一致。在 PPARα 轉基因小鼠體內,非諾貝特給藥一個月能改善肝臟功能及降血脂作用。
根據本試驗結果提示,PPARα轉基因小鼠與C57BL/6相比,在評價PPARα激動劑藥效學方面比常規C57BL/6小鼠更敏感,是一個新的、敏感的動物模型。
[1] Braissant O,Foufelle F,Scotto C,et al.Differential expression of peroxisome proliferator-activated receptors:tissuedistribution of PPARa,b and g in the adult rat[J].Endocrinology,1995,137:354-66.
[2] Kersten S,Seydoux J,Peters JM,et al.Peroxisome proliferatoractivated receptor alpha mediates the adaptive response to fasting[J].Clin.Invest,1999,103:1489 - 1498.
[3] Plutzky,J. Emerging concepts in metabolic abnormalities associated with coronary artery disease[J].Curr.Opin.Cardiol,2000,15:416 -421.
[4] Bays,H.and Stein,E.A.Pharmacotherapy for dyslipidaemia currenttherapies and future agents[J]. Expert Opin.Pharmacother,2003,4:1901 -1938.
[5] Shu H,Wong B,Zhou G,et al.Activation of PPAR alpha or gamma reduces secretion of matrix metalloproteinase 9 but not interleukin 8 from human monocytic THP-1 cells[J].Biochem.Biophys.Res.Commun,2000,267:345 - 349.
[6] Neve BP,Corseaux D,Chinetti G,et al.PPAR alpha agonists inhibittissue factor expression in human monocytes and macrophages[J].Circulation ,2001,103:207 - 212.
[7] 張瑞英,莫成利.PPARα對動脈粥樣硬化、急性心肌梗死、糖尿病心肌病的作用及機制研究進展[J].心血管病學進展,2008,29(4):613 -616.
[8] Marx N,Sukhova GK,Collins T,et al.PPAR alpha activators inhibitcytokine-induced vascular cell adhesion molecule-1 expression in human endothelial cells[J].Circulation ,1999 ,99:3125-3131.
[9] Goya K,Sumitani S,Xu X,et al.Peroxisome proliferatoractivated receptor alpha agonists increase nitric oxide synthase expression in vascular endothelial cells[J].Arterioscler Thromb Vasc Biol,2004,24:658 - 663.
[10] 高愛濱,肖謙.PPARα與非酒精性脂肪肝[J].國際消化病雜志,2007,27(1):18-21.
[11] Lefebvre P,Chinetti G,Fruchart JC,et al.Sorting out the roles of PPARalpha in energy metabolism and vascular homeostasis[J].JClin Invest,2006,116(3):571 - 580.
[12] 周勇,陳國平.基因工程技術與藥物篩選[J].中國醫院藥學雜志,2000,20(6):358 -360.
[13] Bays,H.and Stein,EA.Pharmacotherapy for dyslipidaemia currenttherapies and future agents [J]. ExpertOpin.Pharmacother,2003,4:1901 -1938.
[14] Chinetti G,Lestavel S,Bocher V,et al.PPAR-α and PPAR-γ activators induce cholesterol removal from human macrophage foam cells through stimulation of the ABCA1 pathway [J].Nature medicine,2001,7:53 - 58.
[15] Kersten S,Seydoux J,Peters JM,et al.Peroxisome proliferatoractivated receptor alpha mediates the adaptive response to fasting[J].J.Clin.Invest,1999,103:1489 - 1498.

