老年腦白質疏松患者認知功能與心血管危險因素關系的研究
王曉楠,歐風榮,王春雷
(中國醫科大學附屬第一醫院 1.老年病科;2.營養科,沈陽 110001)
腦白質疏松(leukoaraiosis,LA)是由Hachinski等[1]于1987年首先提出的一個影像學術語,用來描述頭顱CT檢查時所見的腦室周圍及半卵圓中心腦白質散在斑片狀低密度灶或在MRI的T2加權相上顯示斑片狀高信號的影像學表現。老年人群中LA患病率約為49.70%,嚴重影響患者的認知功能及生活自理能力。LA可由多種原因引起,但小血管疾病在其發病機制中占有重要地位。研究表明LA與認知障礙相關[2,3]。除年齡外,高血壓、糖尿病、吸煙、脂代謝異常癥等心血管性危險因素均是老年性LA的危險因素[4]。目前已有研究證明心血管疾病的危險因素是輕度認知功能損害(mild cognitive impair?ment,MCI)及阿爾茨海默病(Alzheimer′s disease,AD)的危險因素[5,6],而對某些危險因素的控制能有效地減少認知功能障礙的發生。目前這方面的研究大多著眼于高危人群的單個危險因素,較少關注2個以上的危險因素聚集對認知功能的影響;老年LA患者心血管危險因素和認知功能的關系及相關程度有待更多的臨床研究。因此,本研究利用Framingham危險評分(Framingham risk score,FRS)方程評價老年LA患者心血管危險因素與認知功能的關系,以期為老年LA患者認知功能障礙的臨床防治提供新的思路。
1 材料與方法
1.1 研究對象
選擇2011年8月至2013年6月在中國醫科大學附屬第一醫院老年病科住院的患者189例。其中非LA患者42例[對照組,男16例,女26例,平均年齡(69.91±6.96)歲],LA患者147例[LA組,男60例,女87例,平均年齡(70.84±5.44)歲]。LA的診斷標準:主要依據CT和MRI所見,兩側大腦半球深部白質斑點狀、斑片狀或彌漫性融合的低密度灶,邊緣模糊,CT上呈低密度改變,CT值較正常低5~10 HU,在MRI上表現為T1像等或低信號、T2像和FLAIR像高信號,除外一些特異性腦白質疾病。排除標準:精神性疾病或有精神性疾病家族史;有藥物或酒精依賴史;有腦創傷、腦卒中病史;有昏迷史;合并其他系統疾病明顯影響日常生活、工作或學習。
1.2 方法
患者入院時采集臨床基本信息,如姓名、性別、年齡、體質量、吸煙史、冠心病病史、高血壓病病史、高血脂病史、糖尿病病史等,靜息30 min后測量血壓。禁食12 h后于入院第2日清晨取肘正中靜脈血,測空腹血糖(fasting blood glucose,FPG)(mmol/L)、總膽固醇(total cholesterol,TC)(mmol/L)、高密度脂蛋白膽固醇(high density lipoprotein cholesterol,HDL?C)(mmol/L)等相關生化學指標。對入選的患者選用簡易精神狀態量表(MMSE)、蒙特利爾認知評估中文版(MoCA)和日常生活能力量表(activities of daily living,ADL)進行認知功能的評估。FRS標準及分組:應用1998年發表的Framingham性別特異性危險評分方程評價研究對象的心血管危險因素,分別按9個步驟完成,即根據性別、年齡、TC水平、HDL?C水平、血壓水平、是否糖尿病、是否吸煙來估計10年冠心病的風險,通常按照風險水平分為低危[10年心肌梗死或冠心病(coronary heart disease,CHD)相關死亡的發生率<10%]、中危(10%~20%)及高危(>20%)3個組別[7]。
1.3 統計學分析
2 結果
2.1 2組臨床及實驗室資料比較
如表1所示:LA組與對照組研究對象的年齡、性別構成及受教育時間方面差異無統計學意義(P均>0.05)。而與對照組相比較,LA組的吸煙人數所占比例、高血壓及糖尿病人數所占比例、TC、FRS積分值及ADL評分顯著高,差異有統計學意義(P均<0.05),而HDL?C、MMSE評分及MoCA評分顯著低,差異有統計學意義(P均<0.05)。
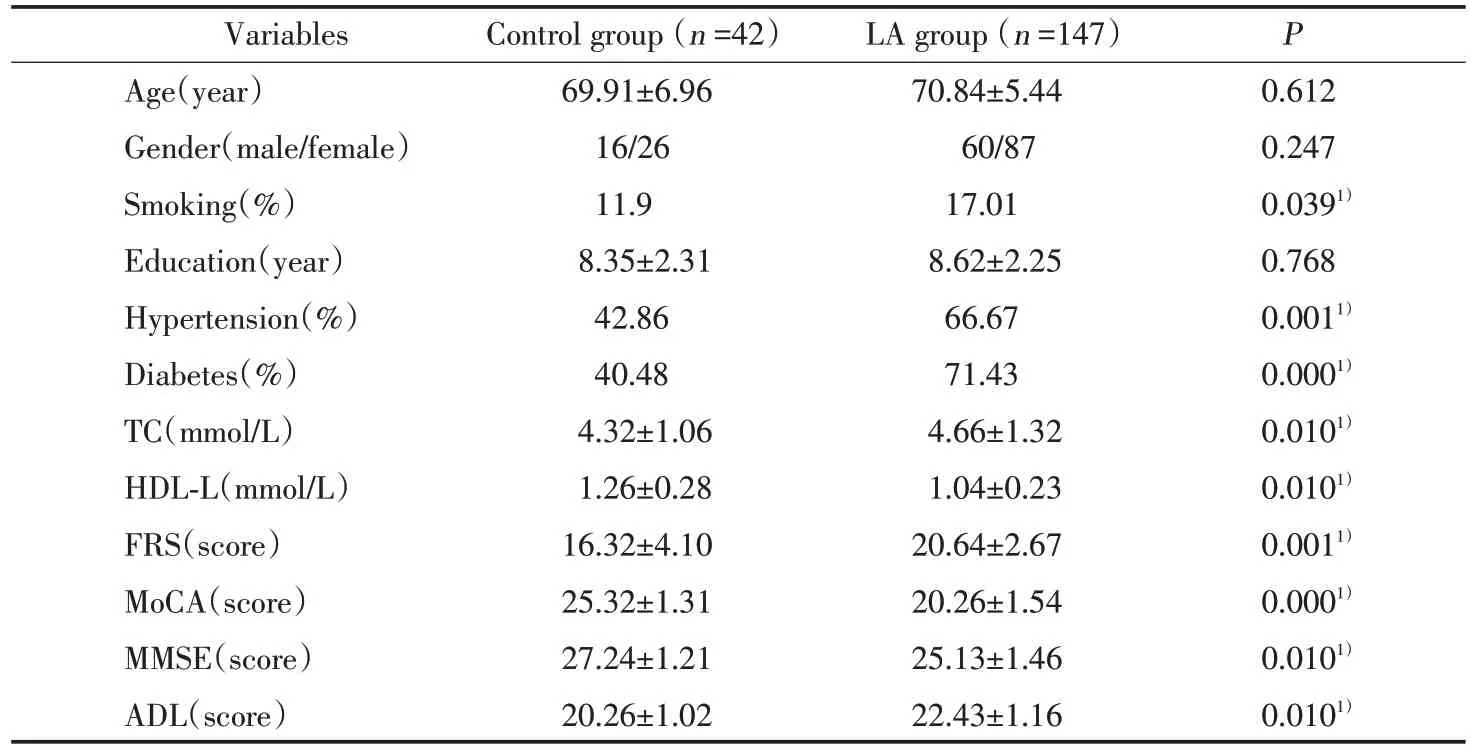
表1 LA組與對照組臨床和實驗室資料比較Tab.1 Clinical and laboratory data of LA group and control group
2.2 LA患者各危險分組的認知功能比較
分別對FRS積分值低危、中危及高危3組研究對象的認知功能評分進行比較。如表2所示:與低危組相比較,中危組及高危組的FRS積分值明顯升高,差異有統計學意義(P均<0.05),MMSE評分及MoCA評分明顯較低,差異有統計學意義(P均<0.05),中危組ADL評分差異無統計學意義(P>0.05),而高危組ADL評分明顯較高,差異有統計學意義(P<0.05);與中危組相比較,高危組FRS積分值及ADL評分明顯高,差異有統計學意義(P均<0.05),而MMSE評分及MoCA評分明顯較低,差異有統計學意義(P均<0.05)。
表2 LA患者各危險分組的認知功能(±s)Tab.2 Cognitive function scores in the three groups of LA patients(±s)
1)P<0.05 vs low risk group;2)P<0.05 vs intermediate risk group.
Variables Low risk group(n=42) Intermediate risk group(n=51) High risk group(n=54)FRS(score) 17.21±1.81 19.27±2.171) 22.36±2.011),2)MMSE(score) 26.59±1.02 25.32±1.531) 23.62±1.031),2)MoCA(score) 22.14±1.01 20.84±1.361) 18.36±1.251),2)ADL(score) 20.27±1.03 21.02±1.26 22.52±1.471),2)
如表3所示:LA患者的FRS積分值與MMSE評分及MoCA評分呈顯著負相關,相關系數分別為-0.143(P<0.05)及-0.156(P<0.05)。
3 討論
LA是白質的一種非特異性改變,既可見于無癥狀老年人,也可伴有認知功能障礙或局灶性神經系統體征。LA導致的認知功能障礙主要表現為精神運動速度減慢和執行能力下降,記憶障礙主要表現為近記憶力顯著下降和定向力、計算力減退[3]。目前的研究認為LA的發生與慢性腦缺血的作用密切相關[8],腦白質區的解剖學特點決定其易受到缺血的影響,腦室周圍深部白質主要是由穿支動脈供血,導致腦室周圍3~10 mm范圍內成為白質區域的“遠端供血區”、動脈供血的分水嶺區,因此在腦缺血或發生低灌注時,該區極易發生缺血改變,從而造成影像學相應的改變[9]。有研究認為長期高血壓、糖尿病等心血管危險因素造成的腦內小動脈硬化和狹窄、以及各種原因導致的廣泛腦低灌注是LA形成的主要病理機制[10]。白質損傷可引發同側皮質代謝率下降,導致皮質功能減退,從而出現認知功能的改變[11]。臨床研究發現,吸煙、高血壓、糖尿病、高膽固醇血癥等單個心血管危險因子均與認知功能障礙相關,表現在以下幾個方面:(1)薈萃分析證實吸煙人群比從未吸煙者發生老年性癡呆的風險增加50%~80%[12];(2)高血壓作為心血管疾病最重要的危險因素會增加血管性癡呆的風險,近年來越來越多的證據支持高血壓亦是AD的潛在危險因素,系統綜述揭示高血壓和老年性癡呆風險之間的關系依賴于年齡[13];(3)中年高膽固醇血癥增加晚年發生AD和老年性癡呆的風險[14];(4)糖尿病能促使MCI進展為癡呆,高血糖、胰島素缺乏、晚期糖化終末產物或糖尿病伴發病(如高血壓、肥胖和血脂異常)等均可能影響腦組織退行性病變[15]。
本研究利用FRS方程評價年齡、血壓、吸煙情況、糖尿病患病情況、HDL?C及TC水平6個心血管危險因素,計算FRS積分值,并證明:與老年非LA患者相比較,老年LA患者的認知功能水平(MMSE評分及MoCA評分)明顯降低,吸煙人數比例、高血壓、糖尿病、高脂血癥的患病比例明顯升高,且心血管危險因素越多,FRS積分值越高,認知功能水平越低。因此我們推測老年LA患者,長期高血壓、糖尿病、高脂血癥等心血管危險因素進一步促進腦內小動脈硬化和狹窄,加重了深部白質缺血及白質總代謝率下降,導致皮質功能減退,從而使認知功能水平下降。
綜上所述,老年LA患者心血管危險因素即FRS積分值與認知功能存在負相關,危險因素的項目越多,FRS積分值越高,認知功能水平及日常生活能力越低。因此,對于老年LA患者,除了治療腦功能損傷之外,還應積極控制心血管危險因素,防止認知功能障礙的發生及發展。
[1]Hachinski VC,Potter P,Merskey H.Leuko?Armos[J].Arch Neural,1987,44(1):21-23.
[2]Suades?Gonza1ez E,Jodar?Vicente M,Perdrix?Solas D.Memory def?icit in patients with subcortical vaseular cognitive impairment ver?sus Alzheimer?type dementia:the sensitivity of the‘word list’sub?test on the wechsler memory scale?Ⅲ[J].Rev Neurol,2009,49(12):623-629.
[3]Frlsoni GB,Ganuzzi S,Pantoni L,et al.The effect of white matter es?ions on congnition in the elderly?small but detectable[J].Nat Clin Pract Neurol,2007,38(3):620-670.
[4]郭洪志.腦白質疏松癥[J].臨床神經病學雜志,2002,15(1):3.
[5]Ettorre E,Cerra E,Marigliano B,et al.Role of cardiovascular risk factors(CRF)in the patients with mild cognitive impairment[J].Arch Gerontol Geriatr,2012,54(2):330-332.
[6]Ciobica A,Padurariu M,Bild W,et al.Cardiovascular risk factors as potential markers for mild cognitive impairment and Alzheimer′s dis?ease[J].Psychiatr Danub,2011,23(4):340-346.
[7]Wilson PW,D′Agostino RB,Levy D,et al.Prediction of coronary heart disease using risk factor categories[J].Circulation,1998,97(18):1837-1847.
[8]Wakita H,Tomimoto H,Akiguchi I,et al.Axonal damage and demy?elination in the white matter after chronic cerebral hypoperfusion in the rat[J].Brain Res,2002,924(1):63-70.
[9]Wallin A,Sjiogren M,Edman A,et al.Symptoms,vasctllar risk fac?tops and blood brain bmTier function in relation to CT white matter changes in dementia[J].Ear Neurol,2000,44(4):229-235.
[10]Kuo HK,Lipsitz LA.Cerebral white matter changes and geriatric syndromes:istherealink?[J].J Gerontol A Biol Sci Med Sci,2004,59(8):818-826.
[11]Otsuka Y,Yamauchi H,Sawamoto N,et al.Diffuse tract damage in the hemispheric deep white matter may correlate with global cogni?tive impairment and callosal atrophy in patients with extensive leu?koaraiosis[J].Am J Neuroradiol,2012,33(4):726-732.
[12]Anstey KJ,Von Sanden C,Salim A,et al.Smoking as a risk factor for dementia and cognitive decline;a recta?analysis of prospective studies[J].Am J Epidemiol,2007,166(4):367-378.
[13]Kennelly SP,Lawlor BA,Kenny RA.Blood pressure and the risk for dementia:a double edged sword[J].Ageing Res Rev,2009,8(2):61-70.
[14]Solomon A,KivipeIto M.Cholesterol?modifying strategies for Al?zheimer′s disease[J].Expert Rev Neurother,2009,9(5):695-709.
[15]Sims?Robinson C,Kim B,Rosko A,et al.How does diabetes accel?erate Alzheimer disease pathology[J].Nat Rev Neurol,20l0,6(10):551-559.

