嗜熱菌Thermaerobacter subterraneus DSM13965磷酸三酯酶的原核表達、純化及性質表征
林禹欣,劉惠麟,韓葳葳,詹冬玲,劉景圣
(1.吉林農業大學 食品科學與工程學院,長春 130118;2.吉林大學 分子酶學工程教育部重點實驗室,長春 130012)
有機磷農藥常被用作殺蟲劑噴灑在果樹和蔬菜上,主要通過與膽堿酯酶的活性內羥基結合抑制酶活性,使其失去分解乙酰膽堿的能力,導致乙酰膽堿的積累[1].
磷酸三酯酶(phosphotriesterase,PTE,EC31118)是降解有機磷毒劑的主要酶類,可與水果蔬菜表面殘留的農藥發生化學反應,破壞有毒成分的化學結構,使其變為無毒、可溶于水的小分子物質[2-4].
嗜熱酶具有較高的熱穩定性和高抗性[5-7].嗜熱磷酸三酯酶由于具有較高的熱穩定性及可溶性而使其在實際應用中潛力較大.目前發現的嗜熱磷酸三酯酶主要包括嗜熱菌Deinococcusradiodurans來源的磷酸三酯酶(Dr-OPH)、超嗜熱菌Sulfololussolfataricus來源的磷酸三酯酶(SsoPox)和嗜熱菌Geobacilluskaustophilus來源的磷酸三酯酶[2].
本文通過克隆ThermaerobactersubterraneusDSM13965的磷酸三酯酶(PTE)基因,用雙酶切將其與質粒pET15b連接,轉化入大腸桿菌BL21中進行誘導表達,利用His抗體鑒定目標蛋白,并研究重組蛋白(DSM-PTE)的酶學性質.
1 材料與方法
1.1 材 料
嗜熱菌T.subterraneusDSM13965購自德國菌種保藏中心;大腸桿菌BL21及質粒pET15b為美國Invitrogen公司產品;DNA快速提取試劑盒和DNA膠回收試劑盒購自杭州維特潔生化技術有限公司;限制性內切酶、T4-DNA連接酶及瓊脂糖為荷蘭Boehringer Mannheim公司產品;其他試劑均為美國Sigma公司產品.由上海生物工程有限公司對引物進行合成和測序.
1.2 方 法
1.2.1 同源序列比對 分別將T.subterraneusDSM13965的有機磷水解酶、來自G.KaustophilusHTA426的磷酸三酯酶、來自S.solfataricus的內酯酶/磷酸三酯酶和來自D.Radiodurans的有機磷水解酶進行同源序列比對.
1.2.2 嗜熱菌T.subterraneusDSM13965基因組DNA的調取 按細菌基因組DNA提取試劑盒(TIAGEN)說明提取TS基因組DNA,用質量分數為0.8%的凝膠電泳檢測基因組DNA的純度和濃度,分裝后于-40 ℃保存備用.
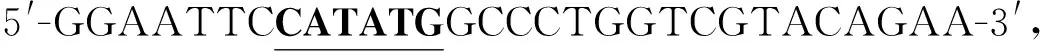
PCR反應條件:95 ℃預變性5 min,95 ℃變性1 min,58 ℃退火1 min,72 ℃延伸10 min,循環30次,72 ℃延伸20 min.通過質量分數為1.5%的瓊脂糖凝膠電泳檢測PCR產物,目的基因片段于-20 ℃保存.
1.2.4 磷酸三酯酶基因表達質粒的構建 由DNA膠回收試劑盒回收PCR產物,將PCR產物連接至pET-15b上,轉化入E.coliXL中.將篩選到含PTE的陽性克隆進行雙酶切和序列分析.對陽性克隆和質粒pET-15b分別進行NdeⅠ和BamHⅠ雙酶切,將酶切得到的目的基因與雙酶切后載體pET-15b相連.連接反應體系為:T4 DNA連接酶0.3 μL,T4 DNA連接酶緩沖液1.2 μL,雙酶切后的載體pET-15b 1.5 μL,雙酶切后的目的基因片段7 μL.
將反應物置于16 ℃金屬浴中連接過夜,連接產物轉化至感受態E.coliBL21中.挑取單菌落,培養并提取質粒,通過PCR對重組質粒進行篩選和序列分析.
1.2.5 目的基因的誘導表達及產物純化 將工程菌接種于含100 μg/mL氨芐青霉素(AMP)的10 mL Luria-Bertani(LB)液體培養基中,于37 ℃振蕩培養過夜,再按照質量分數的1%接種量接種于100 mL LB液體培養基中,相同條件下培養至A600=0.6~0.8,加入異丙基-β-D-硫代砒喃半乳糖苷(IPTG,終濃度為0.3 mmol/L),30 ℃誘導培養過夜.于4 ℃,6 000 r/min離心收集菌體,并懸浮于50 mmol/L pH=7.5的Na2HPO4/NaH2PO4緩沖液中,在冰浴中超聲裂菌,60 ℃熱處理30 min,離心,棄沉淀,上清液經鎳柱純化,收集蛋白峰.融合蛋白部分經聚乙二醇(10 000)濃縮后,檢測酶活.
1.2.6 磷酸三酯酶鑒定 用SDS-PAGE和Western-blot分析鑒定純化后得到的目標蛋白[8-9].通過質量分數為5%的濃縮膠和質量分數為10%的分離膠變性蛋白電泳進行檢測.
1.2.7 磷酸三酯酶的活力測定 以甲基對氧磷(methyl-paraoxon)為底物,通過分光光度計測定磷酸三酯酶活力.監測水解產物對硝基酚在405 nm隨時間變化的光吸收值,反應體系為2 mL,緩沖體系為50 mmol/L磷酸緩沖液(pH=7.5),甲基對氧磷的終濃度為0.1 mmol/L,加入適量的酶,70 ℃反應20 min,用T6紫外-可見分光光度計測定單位時間內的光吸收值,以不加入酶的體系作為空白對照.1個酶活力單位為每20 min催化水解1 μmol底物所需的酶量.酶比活計算公式如下:
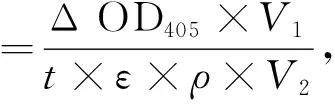
其中:Δ OD405為反應時間內405 nm處光吸收強度的變化值;V1為反應體系 (2 mL);ε為消光系數(0.016(μmol/L)-1);t為反應時間(min);V2為加入的酶量(mL);ρ為酶的質量濃度(mg/mL).每次做3個平行實驗,取平均值.
1.2.8 最適pH值及溫度的測定 分別以三羥甲基甲胺基丙磺酸(TAPS)、2-嗎啉乙磺酸(MES)、3-(環己胺)-1-丙磺酸(CAPS)和4-羥乙基哌嗪乙磺酸(HEPES)配制不同pH值的緩沖液,酶活性測定方法同1.2.7.在pH=4~11內檢測酶活力,最高酶活力設為100%,以相對活性為縱坐標對pH值做圖,求得最適pH值.
在30~90 ℃內測定融合蛋白的磷酸三酯酶活力,觀察溫度對酶活性的影響.最高酶活性設為100%,以相對活性為縱坐標對溫度做圖,求得最適溫度.
1.2.9 熱穩定性測定 將PTE純化酶液置于70 ℃水浴中,用石蠟油封頂,每間隔1 h取一次酶液進行活力測定.磷酸三酯酶活力測定同1.2.7.
2 結果與討論
2.1 同源序列比對結果
通過NCBI的protein blast檢索發現,與DSM-PTE同源性高的蛋白主要都是有機磷水解酶.將已知結構的有機磷水解酶[10-11]和DSM-PTE進行同源序列比對,結果如圖1所示.
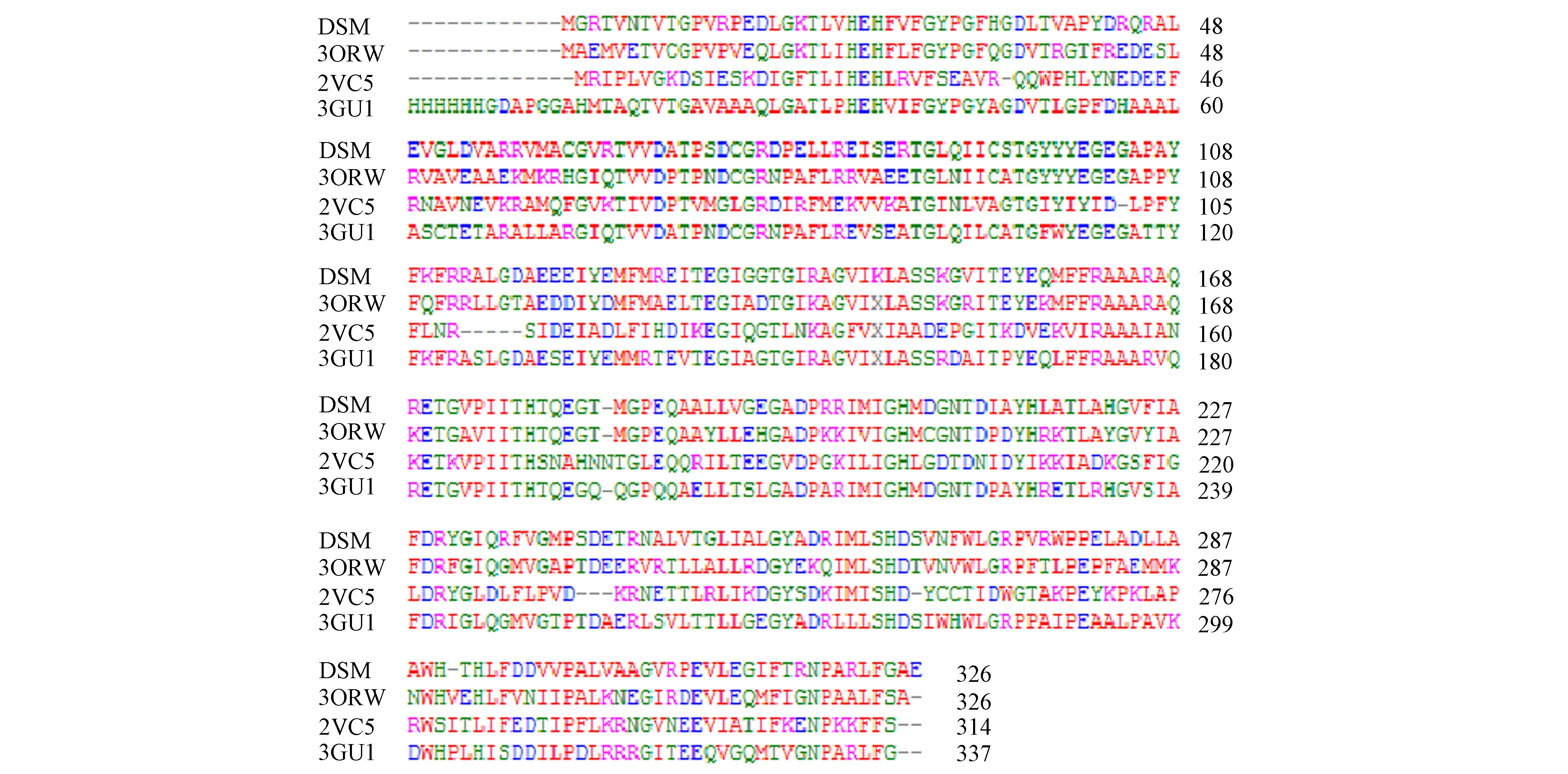
DSM為T.subterraneus DSM13965的有機磷水解酶(同源性99%);3ORW為G.kaustophilus HTA426的磷酸三酯酶(同源性62%);2VC5為S.solfataricus的內酯酶/磷酸三酯酶 (同源性35%);3GU1為D.radiodurans的磷酸三酯酶(同源性61%).圖 1 DSM-PTE同源序列比對Fig.1 Sequence alignment of DSM-PTE with other members
由圖1可見,其同源性均大于35%,推測DSM-PTE具有有機磷水解酶的活性.
2.2 磷酸三酯酶表達質粒的構建
TS基因組的調取結果如圖2所示.由圖2可見,TS基因組提取準確,以其為模板進行PCR擴增,結果如圖3所示.由圖3可見,目的片段(約1 000 bp)成功插入,與預期大小一致,序列測定結果表明,所獲目的基因正確.
2.3 重組蛋白DSM-PTE的表達與純化
用SDS-PAGE檢驗純化蛋白組分,結果如圖4所示.由圖4的第2條帶可見,重組蛋白的相對分子量為50 000,主要以二聚體形式存在.由Western-blot(第3條帶)的免疫印跡可見,重組蛋白DSM-PTE是約為50 000的大分子化合物.與文獻[12]結果相符,PTE在溶液中主要以單體和二聚體的形式存在.
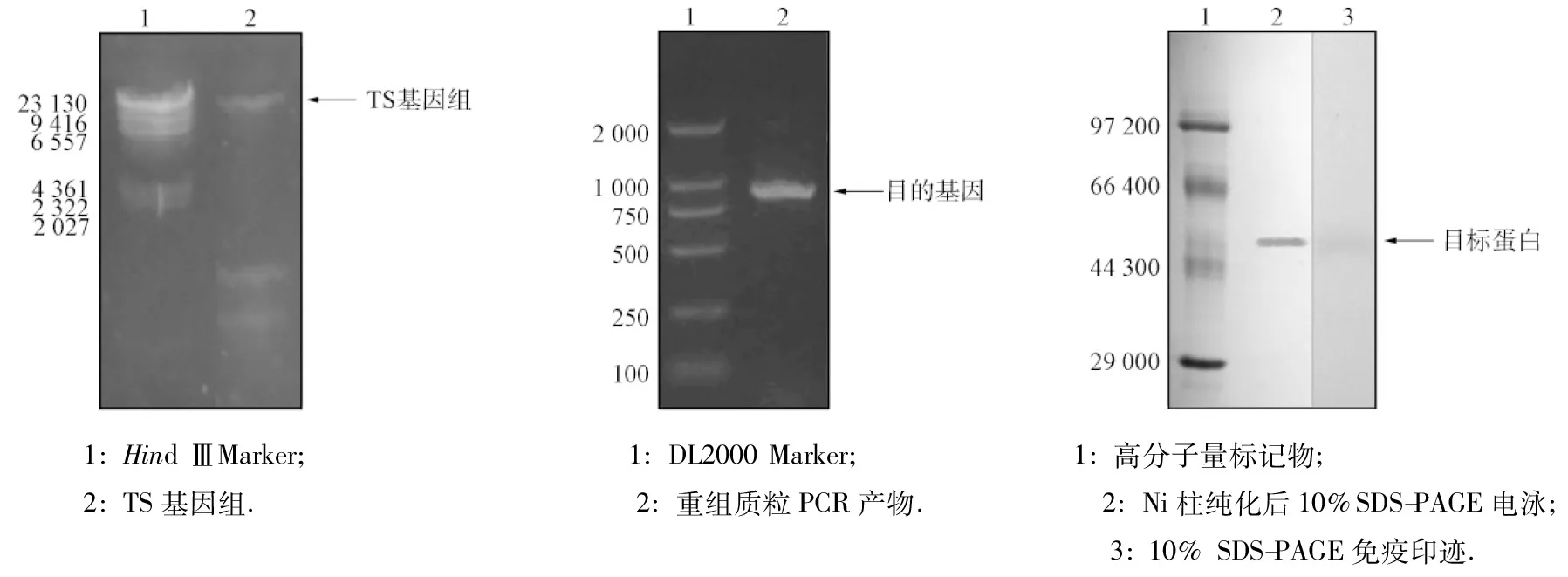
圖2 TS基因組的調取 圖3 磷酸三酯酶基因的調取 圖4 PTE蛋白純化電泳 Fig.2 Extraction of TS genome Fig.3 Extraction of PTE gene Fig.4 SDS-PAGE of purified PTE
2.4 最適溫度與pH值
本文以甲基對氧磷為底物,利用分光光度計測定磷酸三酯酶的活力.溫度和pH值的相對活力曲線如圖5所示.由圖5(A)可見,在70~90 ℃內,酶的相對活力均大于50%,其最適溫度為70 ℃;在30~60 ℃內,酶的相對活力均低于50%.表明異源表達的磷酸三酯酶是對溫度敏感的高溫酶.
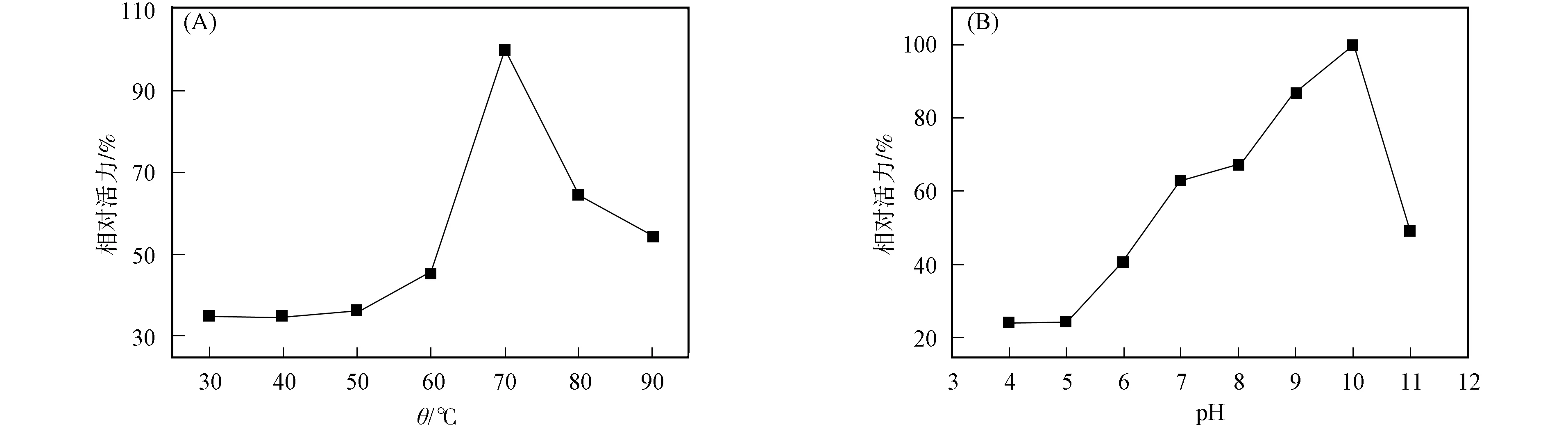
圖5 磷酸三酯酶的最適溫度(A)和pH值(B)Fig.5 Optimal temperature (A) and pH (B) of PTE
在70 ℃,TAPS,MES,CAPS和HEPES的緩沖液中,以甲基對氧磷作為底物,在pH=4.0~11.0內檢測磷酸三酯酶酶活力.由圖5(B)可見,酶相對活力最高的pH=10.0.當pH=7.0~11.0時,酶的相對活力均大于50%,當pH=4.0~6.0時,酶的相對活力低于40%,表明重組磷酸三酯酶適合中性偏堿的環境,是一種典型的堿性磷酸水解酶.
2.5 熱穩定性
磷酸三酯酶在70 ℃的相對活力與時間變化關系如圖6所示.由圖6可見,DSM-PTE具有較好的熱穩定性.工程菌分泌的磷酸三酯酶PTE主要以二聚體形式存在,酶活力隨時間的增加而逐漸減弱,這是因為二聚體解聚至無活力的單體所致,其半衰期為1 h.
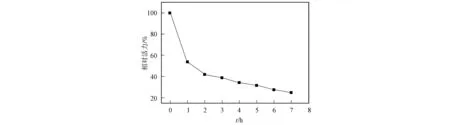
圖6 PTE的熱穩定性Fig.6 Thermal stability of PTE
綜上所述,嗜熱菌T.subterraneusDSM13965的磷酸水解酶基因編碼產物主要以二聚體的形式存在,并具有磷酸三酯酶的活性,在高溫下有良好的穩定性.
[1] Merone L,Mandrich L,Porzio E,et al.Improving the Promiscuous Nerve Agent Hydrolase Activity of a Thermostable Archaeal Lactonase [J].Bioresour Technol,2010,101(23):9204-9212.
[2] Aubert S D,LI Ying-chun,Raushel F M.Mechanism for the Hydrolysis of Organophosphates by the Bacterial Phosphotriesterase [J].Biochemistry,2004,43(19):5707-5715.
[3] Hong S B,Mullins L S,Shim H,et al.Mechanism-Based Inhibitors for the Inactivation of the Bacterial Phosphotriesterase [J].Biochemistry,1997,36(29):9022-9028.
[4] ZHANG Xin,WU Rui-bo,SONG Ling-chun,et al.Molecular Dynamics Simulations of the Detoxification of Paraoxon Catalyzed by Phosphotriesterase [J].J Comput Chem,2009,30(15):2388-2401.
[5] CHEN Lu-qing,ZHANG Xiu-yan,TANG Yan-jie,et al.Progress in the Molecular Mechanism and Strategies for Thermostability of Thermophili Enzyme [J].Bulletin of Science and Technology,2008,24(6):792-798.(陳路清,張秀艷,唐彥捷,等.嗜熱酶的穩定機制和穩定策略的研究進展 [J].科技通報,2008,24(6):792-798.)
[6] Merone L,Mandrich L,Rossi M,et al.A Thermostable Phosphotriesterase from the ArchaeonSulfolobussolfataricus:Cloning,Overexpression and Properties [J].Extremophiles,2005,9(4):297-305.
[7] Horne I,Sutherland T D,Oakeshott J G,et al.Cloning and Expression of the Phosphotriesterase GeneHocAfromPseudomonasmonteiliiC11[J].Microbiology,2002,148(9):2687-2695.
[8] Halio S B,Blumentals I I,Short S A,et al.Sequence,Expression in Escherichia Coli,and Analysis of the Gene Encoding a Novel Intracellular Protease (PfpI) from the Hyperthermophilic Archaeon Pyrococcus Furiosus [J].J Bacteriology,1996,178(9):2605-2612.
[9] Halio S B,Bauer M W,Mukund S,et al.Purification and Characterization of Two Functional Forms of Intracellular Protease PfpI from the Hyperthermophilic ArchaeonPyrococcusfuriosus[J].Applied and Environmental Microbiology,1997,63(1):289-295.
[10] Livnat A,Cintia R,Giuseppe M,et al.The Latent Promiscuity of Newly Identified Microbial Lactonases Is Linked to a Recently Diverged Phosphotriesterase [J].Biochemistry,2006,45(46):13677-13686.
[11] Lawrence R G,Sarah J S,Ademir N,et al.Phosphate Ester Hydrolysis:Metal Complexes as Purple Acie Phosphatase and Phosphotriesterase Analogues [J].Eur J Inorg Chem,2009,2009(19):2745-2758.
[12] Porzio E,Merone L,Mandrich L,et al.A New Phosphotriesterase from Sulfolobus Acidocaldarius and Its Comparison with the Homologue from Sulfolobus Solfataricu [J].Biochimie,2007,89(5):625-636.

