石油污染地下水中苯降解菌的代謝特征
金歡馳, 張玉玲, 黨江艷
(吉林大學 環境與資源學院, 水資源與環境研究所, 長春 130012)
微生物修復是一種低能耗處理石油污染地下水的有效方法[1]. 但土著微生物生長緩慢, 且數量有限, 使生物修復過程受限. 通過人工富集降解石油類土著微生物, 發揮其最大效能, 是提高石油污染地下水生物修復效率的主要方法[2]. 苯是石油污染組分中的常見物質, 由于其化學結構及易遷移的特點, 在自然環境中不易降解. 目前, 苯降解菌的研究主要為苯降解菌菌株的篩選鑒定、 降解影響因素、 降解酶的基因組學以及理論微生物降解途徑[3-5]等. Caldwell等[6]通過檢測苯降解過程的中間產物, 提出了苯轉化為苯甲酸的厭氧生物降解途徑; 文獻[7-8]分別采用高效液相色譜(HPLC)和紅外分析檢測苯降解的中間產物, 推測了苯的生物降解途徑及化學催化氧化途徑. 本文在采集樣品并分離出苯降解菌的基礎上, 模擬低溫地下水環境條件, 研究降解菌的代謝機制, 并推測苯降解菌在低溫環境中的代謝特征.
1 實 驗
1.1 儀器和試劑
HZQ-QX型全溫振蕩器(上海博訊實業有限公司); RE-52AA型旋轉蒸發儀(上海亞榮生化儀器廠); OI4560型吹掃捕集儀(美國OI公司); Agilent 6890/5973 GC-MS型氣質聯用儀(美國安捷倫公司); CH2O型電子顯微鏡(德國OLYMPUS公司). 所用主要化學試劑均為國產分析純, 苯標準品購自國家標準物質中心.
液體培養基: NH4NO32 g, K2HPO41.5 g, KH2PO43 g, MgSO4·7H2O 0.1 g, 無水CaCl20.01 g, Na2EDTA·2H2O 0.01 g, 苯 1 mL, 蒸餾水 1 L. 固體培養基在液體培養基的基礎上加入10 g瓊脂.
1.2 實驗方法
1.2.1 菌種來源 菌種來源于東北某油田區石油類污染淺層地下水, 主要特征污染物為苯[9].
1.2.2 苯降解菌的富集純化 將1 mL石油污染地下水置于液體培養基中, 密封, 于10 ℃,100 r/min培養至液體變渾濁, 每隔3~4 d將0.5 mL菌懸液轉移至150 mL液體培養基中, 共轉移5次; 采用稀釋涂布法, 先將富集后的培養液均勻涂布于固體培養基上, 再將浸有苯液的棉花置于培養皿蓋一側, 密閉倒置培養皿, 10 ℃培養2 d后挑選單菌落, 畫線分離, 得到6株以苯為唯一碳源和能源的菌株B1~B6.
1.2.3 石油污染地下水微環境模擬實驗 挑取單菌落置于裝有150 mL石油污染地下水(400 mg/L苯)的密閉玻璃瓶中, 空白溶液作為對照, 每組做3個平行樣. 在10 ℃,100 r/min的振蕩培養箱中放置3 d, 取1 mL上清液, 稀釋1 000倍后利用吹掃捕集-氣質聯儀測試苯的質量濃度, 確定苯的優勢降解菌.
1.2.4 優勢菌種降解苯的代謝產物檢測
1) 優勢苯降解菌生長曲線的繪制及兒茶酚雙加氧酶的活性檢測: 將0.5 mL菌懸液置于液體培養基中, 在10 ℃,100 r/min條件下培養, 每組做3個平行樣, 采用分光光度法測試微生物的OD660值, 繪制生長曲線, 并參照文獻[10-11]方法測試兒茶酚1,2-雙加氧酶和兒茶酚2,3-雙加氧酶的活性.
2) 雙加氧酶的檢測: 將0.002 0 g兒茶酚溶于蒸餾水中, 取2滴置于0.5 mL的發酵液中, 密封, 觀察兒茶酚溶液顏色和發酵液溶液顏色的變化.
3) 代謝產物檢測: 采用微環境降解實驗溶液, 通過兩種方式檢測降解代謝產物.
① 利用吹掃捕集儀和氣質聯用儀對樣品進行全掃描和測試, 并分析質譜中苯降解后的分子碎片峰;
② 將10 mL發酵液和3 mL二氯甲烷置于50 mL分液漏斗中, 振搖3 min, 取上層有機相過無水硫酸鈉, 經旋轉蒸發儀將萃取液濃縮至1 mL, 用氣質聯用儀全掃描分析.
儀器測定條件參見文獻[12].
1.2.5 優勢菌種的生理生化特性檢測 根據菌種特性, 主要進行三糖鐵實驗、 葡萄糖發酵實驗、 甲基紅實驗、 吲哚實驗、 產氨實驗、 檸檬酸鹽利用實驗、 油脂水解實驗、 淀粉水解實驗、 明膠液化實驗、 V.P實驗、 3-酮基乳糖測定實驗、 纖維素水解實驗、 產硫化氫實驗、 氧化酶實驗、 接觸酶實驗、 硝酸鹽還原實驗、 亞硝酸鹽還原和反硝化實驗.
1.2.6 菌種鑒定
1) 菌株顯微鏡下形態表征: 采用革蘭氏染色實驗鑒定菌種.
2) 菌種基因鑒定: 采用熒光定量PCR儀進行16S rDNA擴增, 在上海生物工程有限公司測序.
2 結果與討論
2.1 菌種的篩選結果與分析
實驗采用廢棄井返水事故產生的含水層地下水(主要為Ca-Na-HCO3-Cl型水), 水樣中總石油烴(TPH)的質量濃度為36 mg/L[9]. 本文模擬地下水中的微生物處于寡營養狀態, 使其生長環境與淺層地下水環境接近. 苯的初始質量濃度為394.36 mg/L, 6種菌在微環境中生長繁殖后, 在第3天取樣測試, 水相體系中苯的質量濃度測試結果如圖1所示. 由圖1可見, 6種菌均有降解苯的能力, 其中B6菌降解效果最好, 降解率為82.82%. 因此以B6菌為考察對象進行代謝特征研究.
2.2 B6菌降解苯過程中代謝物質分析
2.2.1 兒茶酚降解酶的活性檢測 B6菌的生長曲線及兒茶酚降解酶的活性測定結果如圖2所示. 由圖2可見, 在B6菌的生長期內, 兒茶酚2,3-雙加氧酶的活性基本為零, 表明在該實驗條件下, 兒茶酚2,3-雙加氧酶基本未參與苯的生物降解. 兒茶酚1,2-雙加氧酶的活性在該過程中逐漸升高, 3 d后逐漸下降, 與B6菌的生長曲線一致. 因此, 在B6菌降解苯過程中, 產生了兒茶酚1,2-雙加氧酶.
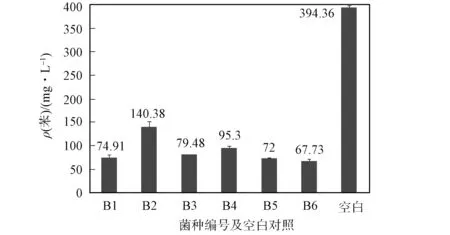
圖1 6種降解菌對苯的降解效果Fig.1 Biodegradation of benzene by six isolated-strains
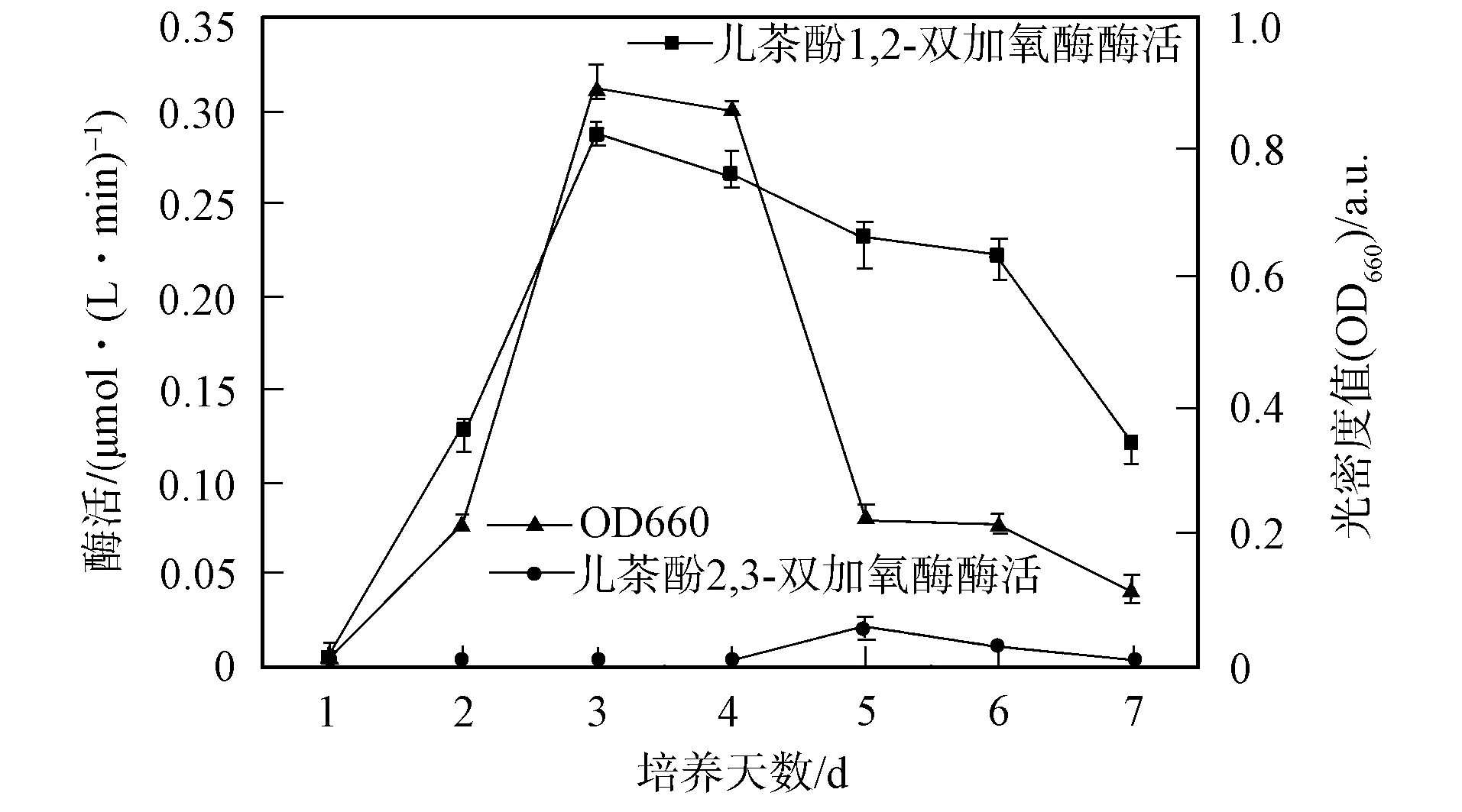
圖2 B6菌的生長曲線及兒茶酚降解酶的活性測定Fig.2 Growth curves of B6 and the enzyme activity of catechol dioxygenase
2.2.2 雙加氧酶的檢測分析 所有芳香族化合物均先降解為兒茶酚, 在雙加氧酶的作用下, 兒茶酚發生裂解, 使苯環斷裂[10,13]. 實驗中發現經過較短時間發酵液變為黃色, 表明兒茶酚已被雙加氧酶氧化, 從而證實苯系物降解途徑包括兒茶酚降解.

圖3 采用二氯甲烷萃取后B6菌全掃描色譜Fig.3 Full-scan spectrum of B6 strain extracted by methylene chloride
2.2.3 菌種代謝物的檢測分析 采用吹掃捕集-GC/MS直接吹掃、 二氯甲烷萃取液和正己烷萃取液定性檢測方法, 分析B6菌代謝產物, 在直接吹掃和正己烷萃取液定性檢測譜中未發現代謝中間產物的衍生物質, 而在經二氯甲烷萃取的溶液中發現了代謝中間產物的衍生物質, 測試結果如圖3所示. 由圖3可見, 在全掃描色譜中未出現甲苯和二甲苯等苯系物的譜峰, 表明B6菌將苯和其他苯系物均降解了. 在經二氯甲烷萃取后, 出現較多B6降解菌的中間代謝產物衍生物質, 如在保留時間19.73 min, 出現鄰苯二甲酸酯類物質, 在保留時間17.91 min, 出現內酯開環后生成的丁二酸酯類物質. 因此可推測B6菌生物降解苯的途徑如圖4所示, 主要按兒茶酚正位裂解途徑進行.

圖4 苯降解途徑Fig.4 Degradation approach of benzene
2.3 優勢菌種的生理生化特性檢測
B6菌的生理生化實驗結果列于表1. 由表1可見: B6菌在代謝過程中產生色氨酸酶、 脂肪酶、 淀粉酶、 明膠酶、 乳糖酶和氧化酶等, 葡萄糖、 乳糖、 蛋白質、 色氨酸、 脂肪、 淀粉、 明膠、 多肽、 纖維素、 含硫有機物、 細胞色素C、 硝酸鹽及亞硝酸鹽為其營養物質; 亞硝酸鹽為B6菌代謝的電子受體; 硝酸鹽為B6菌代謝的終末受氫體或電子受體.

表1 B6菌的生理生化實驗*
* “+”表示反應為陽性; “-”表示反應為陰性.
2.4 菌種鑒定結果
B6菌在顯微鏡下的形態如圖5所示. 由圖5可見, B6菌菌落形態為圓形不透明, 質地粗糙, 淡黃色. 根據革蘭氏染色和基因鑒定結果可知, B6菌為革蘭氏陽性紅平紅球菌, 其系統發育樹如圖6所示.
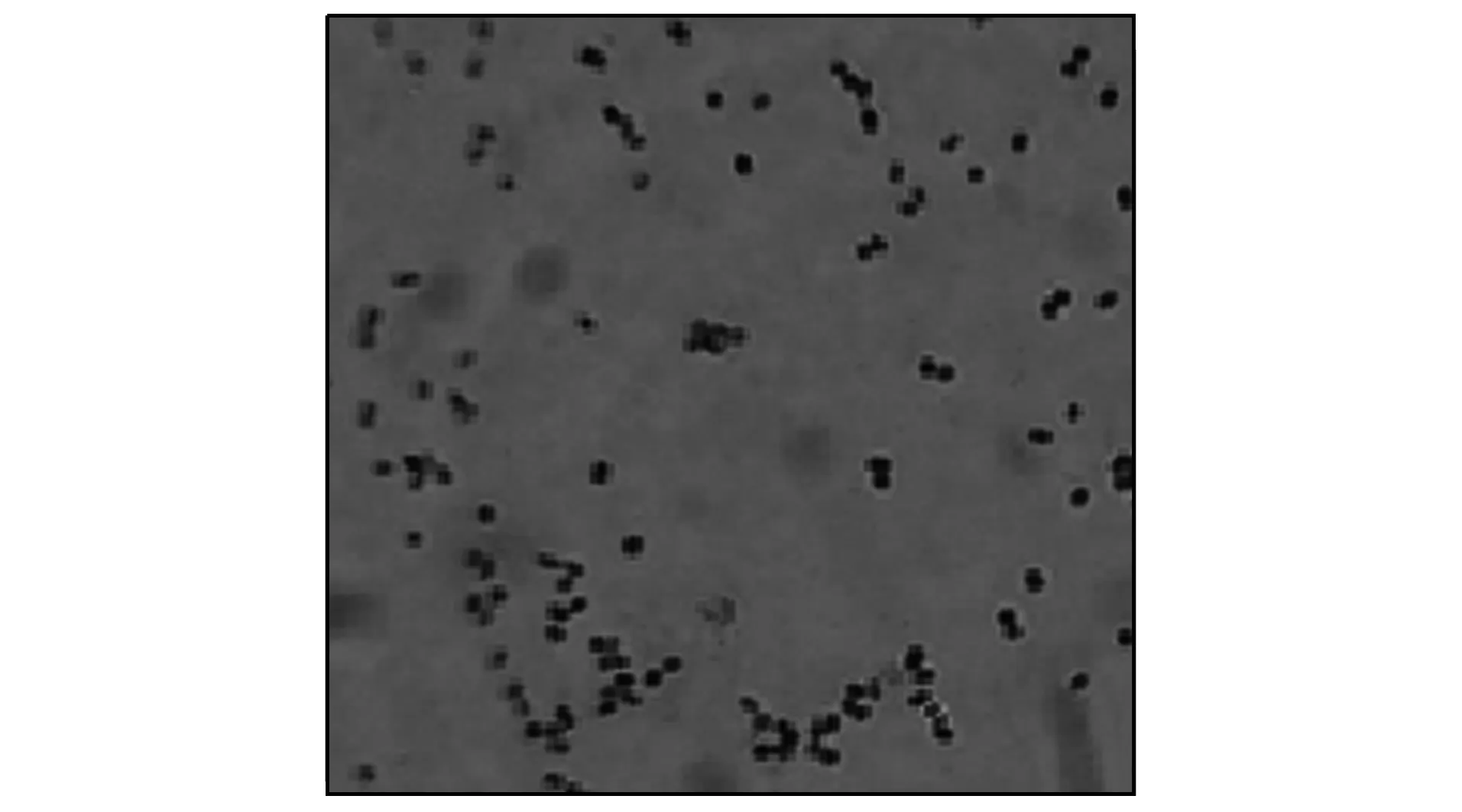
圖5 B6菌在顯微鏡下的形態Fig.5 Morphology of B6 strain
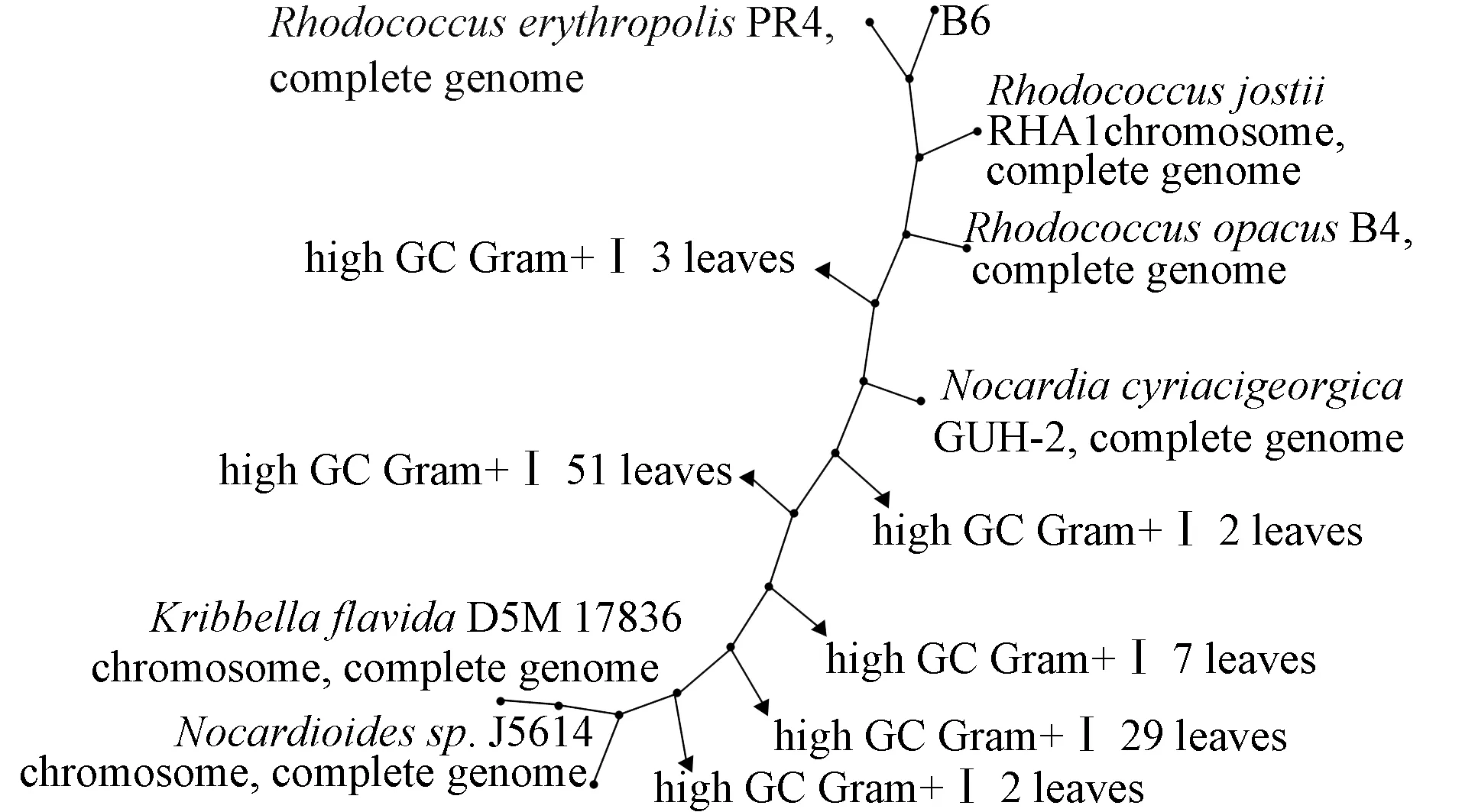
圖6 B6菌系統發育樹Fig.6 Phylogenetic tree of B6 strain
由圖6可見, B6菌與RhodococcuserythropolisPR4的同源性最高, 該菌可利用C8~C20的烷烴為唯一碳源和能源, 其代謝底物具有多樣性, 尤其對疏水化合物的代謝(如烴類、 煤和石油)[14].
綜上所述, 本文從石油污染的地下水樣品中富集、 純化和篩選得到一株紅平紅球菌B6, 該菌對苯具有較好的降解性能, 當苯的初始質量濃度為394.36 mg/L時, B6菌對苯的降解率為82.82%. B6菌在代謝過程中產生多種酶類物質, 利用葡萄糖、 乳糖和含硫有機物等作為營養物質, 亞硝酸鹽和硝酸鹽為其代謝電子受體. 通過檢測酶活及菌種代謝的中間產物可知, B6菌在實驗條件下對苯的生物降解途徑為兒茶酚正位裂解.
[1] Ryan M P, Pembroke J T, Adley C C. Ralstonia Pickettii in Environmental Biotechnology: Potential and Applications [J]. J Appl Microbiol, 2007, 103(4): 754-764.
[2] Kahng H Y, Malinvemi J C, Majko M M, et al. Genetic and Functional Analysis of the tbc Operons for Catabolism of Alkyl- and Chloroaromatic Compounds in Burkholderia sp.Strain JS150 [J]. Appl Environ Microbiol, 2001, 67(10): 4805-4816.
[3] Julia F. Anaerobic Biodegradation of Aromatic Hydrocarbons: Pathways and Prospects [J]. J Mol Microbiol Biotechnol, 2008, 15: 93-120.
[4] RAO Jia-jia, HUO Dan-qun, CHEN Bing-can, et al. Biodegradation Process of Aromatic Compounds [J]. Environmental Protection of Chemical Industry, 2004, 24(5): 323-327. (饒佳家, 霍丹群, 陳柄燦, 等. 芳香族化合物的生物降解途徑 [J]. 化工環保, 2004, 24(5): 323-327.)
[5] ZHANG Jing, REN Qing, ZHU Huan-shan. Current Situation and Prospects of Biodegradation of Aromatic Compounds [J]. Liaoning Urban and Rural Environmental Science & Technology, 2004, 24(1): 54-56. (張晶, 任慶, 朱煥山. 芳香族化合物生物降解研究現狀與展望 [J]. 遼寧城鄉環境科技, 2004, 24(1): 54-56.)
[6] Caldwell M E, Suflita J M. Detection of Phenol and Benzoate as Intermediates of Anaerobic Benzene Biodegradation under Different Terminal Electron-Accepting Conditions [J]. Environ Sci Technol, 2000, 34(7): 1216-1220.
[7] GAI Ke. Extraction and Separation of Intermediates in Plasma Degradation of Benzene [J]. Journal of Longdong University, 2008, 19(2): 36-37. (蓋軻. 苯等離子體降解中間產物的萃取與分離 [J]. 隴東學院學報, 2008, 19(2): 36-37.)
[8] YANG Meng, YUAN Lin-jiang. Study on Influence Factors and Biodegradation Mechanism of Benzene under Oxygen-Free Environment [J]. Journal of Water Resources & Water Engineering, 2010, 21(4): 101-104. (楊檬, 袁林江. 無分子氧環境中苯生物降解影響因素及降解機理研究 [J]. 水資源與水工程學報, 2010, 21(4): 101-104.)
[9] WANG Wei, SU Xiao-si, ZHANG Yu-ling, et al. Natural Attenuation of a Petroleum Contaminated Site [J]. Journal of Jilin University: Earth Science Edition, 2011, 41(Suppl 1): 310-314. (王威, 蘇小四, 張玉玲, 等. 石油類污染場地的自然衰減作用 [J]. 吉林大學學報: 地球科學版, 2011, 41(增刊1): 310-314.)
[11] Barbara H, Winnie D, Folkert F, et al. PCR-DGGE Method to Asses the Diversity of BTEX Monooxygenase Genes at Contaminated Sites [J]. FEMS Microbiol Ecol, 2006, 55(2): 262-273.
[12] ZHANG Yu-ling, ZHANG Lan-ying, Abubakal D. Study on Detection of Benzene in Groundwater by GC Using Purging and Trapping [J]. Journal of Jilin University: Earth Science Edition, 2003, 33(2): 255-256. (張玉玲, 張蘭英, 阿布巴卡爾·達布雷. 吹掃-捕集技術在GC法測定地下水中苯系物條件研究 [J]. 吉林大學學報: 地球科學版, 2003, 33(2): 255-256.)
[13] ZHANG Qiang, QU Yuan-yuan, ZHOU Ji-ti, et al. Advances in Hydroxylation of Aromatic Compounds with Oxygenase [J]. Chinese Journal of Applied & Environmental Biology, 2009, 15(4): 540-545. (張強, 曲媛媛, 周集體, 等. 芳香化合物羥基化酶研究進展 [J]. 應用與環境生物學報, 2009, 15(4): 540-545.)
[14] Komukai-Nakamura S, Sugiura K, Yamauchi-Inomata Y, et al. Construction of Bacterial Consortia That Degrade Arabian Light Crude Oil [J]. J Ferment Bioeng, 1996, 82(6): 570-574.

