葉酸抑制同型半胱氨酸誘導的人腎臟系膜細胞增殖
曹露,婁曉盈,牟娜娜,張泉,譚紅梅
(中山大學中山醫學院病理生理教研室,廣州 510080)
同型半胱氨酸(homocysteine,Hcy)是蛋氨酸轉甲基過程中的一個產物,高同型半胱氨酸血癥(hyperhomocysteinemia,HHcy)是心血管疾病的獨立危險因素[1]。臨床上,血漿Hcy正常濃度為5~15μmol/L,HHcy被定義為血漿 Hcy濃度在15 μmol/L以上[2]。體內外的研究[3-5]表明 Hcy與腎小球的損傷有一個緊密的聯系。葉酸(folic acid,FA)是人體必需的維生素,在Hcy與蛋氨酸之間的相互轉化過程中充當一碳單位的載體,在Hcy再次甲基化到蛋氨酸的過程中發揮重要的作用。大量研究觀察發現Hcy水平和FA水平呈現一個相反的關系,更進一步的研究實驗[6-8]顯示FA能夠降低血透病人、慢性腎移植、晚期腎病患者血漿Hcy濃度。在眾多促進腎小球病變的因子中,轉化生長因子-β(transforming growth factor-β,TGF-β)可以調節細胞的增殖、分化和凋亡,與腎臟纖維化和硬化的發生密切相關,但是對TGF-β在Hcy介導的腎小球損傷中的作用研究還不夠充分,FA能否降低Hcy導致的腎小球損傷以及TGF-β是否參與了這一過程還沒有得出確定的結論。眾所周知,腎小球系膜細胞是腎小球中非常活躍的細胞,具有收縮、支持、吞噬和分泌腎素的作用,對腎小球發揮正常功能具有重要意義。本實驗采用體外培養人腎臟系膜細胞(human renal mesangial cells,HMCs)來進行研究,觀察Hcy對HMCs增殖的影響和葉酸的干預作用,以及TGF-β、ERK是否參與了這一過程。
1 材料與方法
1.1 材料
RPMI1640(Roswell Park Memorial Institute 1640)培養基購于美國GIBCO公司,鼠抗人TGF-β單克隆抗體、鼠抗人ERK單克隆抗體及鼠抗人β-肌動蛋白(β-actin)單克隆抗體,購于美國Santa Cruz Biotechnology公司;辣根過氧化物酶標記抗小鼠抗體(evision two-stepTManti-mouse detection reagent,HRP)購自 Antibody Diagnostica Inc公司;噻 唑 藍 (methylthiazolyldiphenyl-tetrazolium bromide,MTT)、二甲基亞砜(dimethyl sulfoxide,DMSO)購于Sigma-Aldrich公司。
1.2 方法
1.2.1 MTT法測定細胞活力 收集對數期生長的HMCs,調整細胞密度,以1×104/孔接種于96孔板,置于37℃,5%CO2培養箱培養使細胞貼壁,細胞匯合度達50%~60%以上時,加入不同濃度的Hcy(0、200、400、600、800、1 000μmol/L)或 Hcy(400μmol/L)加不同濃度的 FA(50、100、200 μmol/L)處理24h,PBS輕輕洗滌,加入180μL新鮮培養液,再加入20μL MTT溶液,繼續培養4h,終止培養,每孔加入150μL DMSO,在酶聯免疫檢測儀492nm處測量各孔的吸光值。
1.2.2 Western blot法檢測 TGF-β和 ERK 的表達 以2×105/mL的密度接種HMCs,待細胞貼壁后,以不同的Hcy濃度、Hcy加不同濃度的FA處理細胞,48h后收集細胞,RIPA裂解液裂解,超聲破碎,Bio-RAD蛋白檢測試劑盒測定蛋白濃度,在聚丙酰胺凝膠中電泳后,250mA恒流濕轉蛋白于硝酸纖維素膜上,5%脫脂奶粉封閉1h,ERK一抗(1∶1 000),TGF-β一抗(1∶1 000)孵育過夜后,TBST洗3次,二抗孵育1h,TBST洗3次,膜鋪于曝光盒中,將適量的發光液滴在膜上,于暗室中曝光、顯影。
1.2.3 統計學分析 采用SPSS 13.0統計學軟件對HMCs存活率進行方差分析,采用TEST分析法對不同濃度的Hcy處理后和Hcy與不同濃度FA共同處理后各組間差異進行分析。
2 結果
2.1 Hcy誘導HMCs細胞增殖
MTT結果顯示,與對照組相比,Hcy處理后劑量依賴性地促進細胞增殖(見圖1)。Hcy 400 μmol/L時增殖明顯(P<0.01),選取400μmol/L濃度的Hcy進行葉酸干預作用的研究。
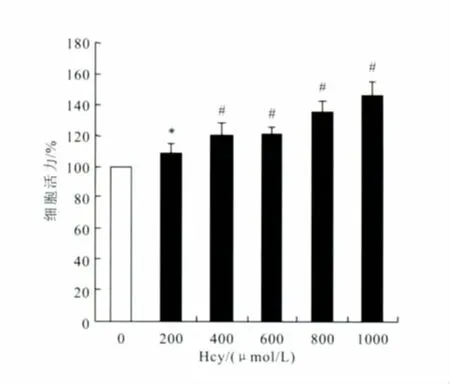
圖1 Hcy誘導HMCs細胞增殖不同濃度Hcy處理HMCs 24h,采用MTT法測定各組細胞活力。與對照組(Hcy=0)比較,*P<0.05,#P<0.001
2.2 FA抑制Hcy誘導的HMCs細胞增殖
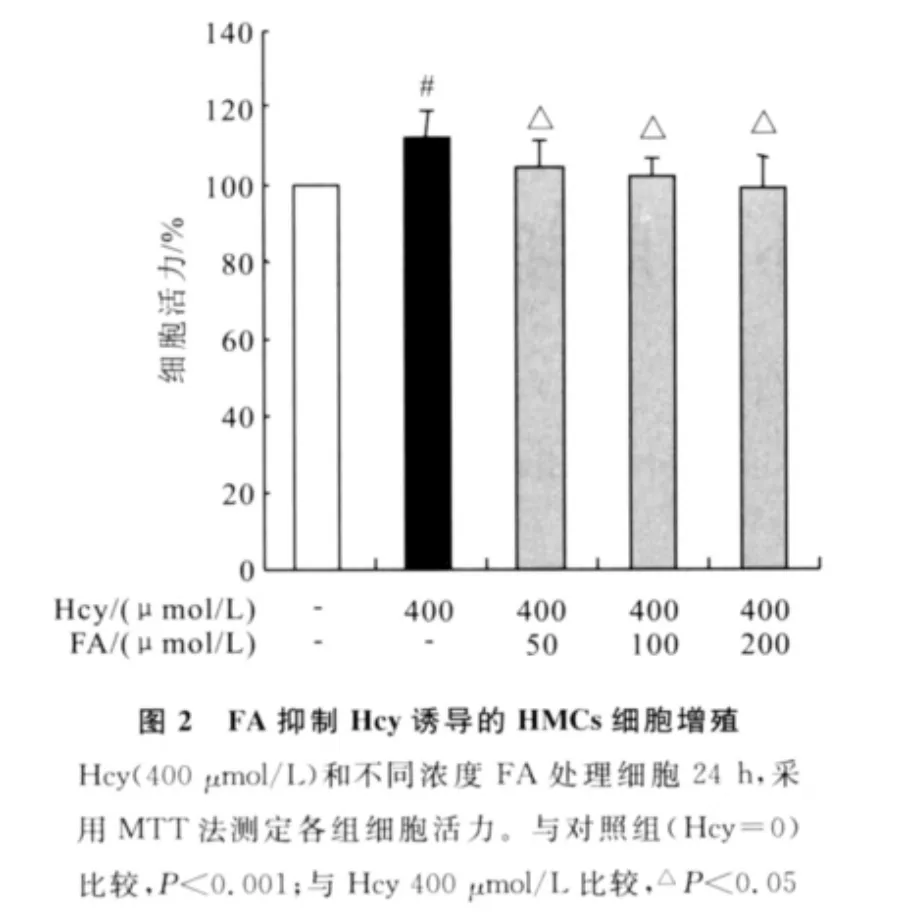
加入不同劑量FA干預后,與Hcy 400μmol/L組對比,HMCs細胞增殖能力呈現劑量依賴性地下降(見圖2)。
2.3 Hcy增強TGF-β和ERK蛋白表達
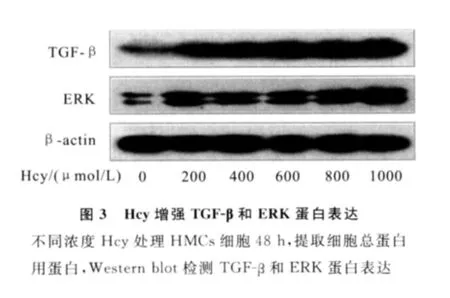
Western blot結果顯示,對照組TGF-β和ERK微量表達;Hcy處理后,隨著劑量的升高,TGF-β和ERK的表達依次增強(見圖3)。
2.4 FA抑制Hcy誘導的TGF-β和ERK蛋白表達
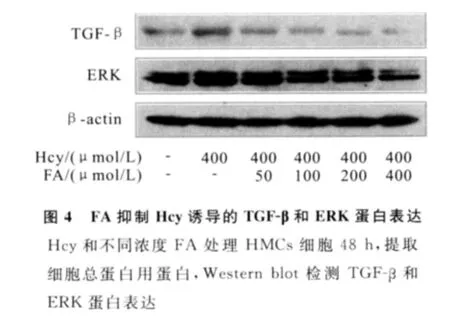
使用FA干預后,與400μmol/L濃度的 Hcy組比較,TGF-β和ERK的表達下降,并呈劑量依賴趨勢(見圖4)。
3 討論
McCully于1969年最先將重度HHcy(100~450μmol/L)與動脈粥樣硬化疾病相聯系,重度HHcy是由于參與Hcy代謝的轉甲基或轉硫作用的酶缺陷所致,常見的有胱硫酶合成酶及亞甲基四氫葉酸還原酶缺陷,重度HHcy病人有早發性動脈粥樣硬化,動靜脈栓塞及智力障礙。Ingram等[5]用體外培養的Sprague-Dawley大鼠的系膜細胞,首次研究證實Hcy在腎小球病變中發揮的作用和在血管病變中發揮的作用是一致的,提出Hcy在慢性腎臟病變的進展中發揮著潛在性作用,ERK的激活參與了Hcy導致的腎損傷的過程。進一步的實驗證實增加的Hcy水平也能直接作用腎小球的細胞,引起腎小球的損傷和最終的硬化。本實驗采用體外培養的HMCs,遺傳缺陷性劑量的Hcy,測定細胞活力、ERK和TGF-β的蛋白表達量。MTT檢測顯示Hcy明顯刺激了HMCs的增殖并且有劑量依賴的關系,同時觀察到Hcy處理的HMCs,ERK的蛋白表達量升高。有文獻[9]報道ERK通路的阻礙引起HMCs增殖的明顯降低。進一步的報道[10]表明ERK通路的激活在腎小球損傷的過程中的作用與細胞的增殖相關。無論是動物模型還是人類疾病,TGF-β被認為是一個多器官病理變化的發病機制,在同型半胱氨酸血癥的模型中,增加的TGF-β的蛋白表達量升高不僅發生在心臟,還發生在肺和肝臟,許多研究證實TGF-β作為腎小球硬化關鍵性的調節因子,其水平升高與腎小球的病變過程相聯系,也有研究[11]提出TGF-β和ERK的潛在性聯系,誘導系膜細胞增殖的發生,但是TGF-β與Hcy導致的腎臟損傷之間的關系還沒有完全被證實。我們的實驗觀察到在Hcy處理后TGF-β的表達與對照組相比有明顯的變化。FA的保護作用在心血管方面的研究最為廣泛,在腎臟損傷的保護中也具有重要的臨床意義,但是FA對Hcy導致的腎臟損傷的保護機制還沒有得到證實,TGF-β是否參與FA對Hcy導致的腎損傷保護的報道更少。本實驗采用體外的細胞模型,在400μmol/L Hcy損傷的基礎上用不同濃度的FA進行干預,觀察到FA能抑制Hcy誘導的HMCs細胞增殖,TGF-β蛋白表達也相應下降。通過實驗得出TGF-β和ERK可能參與了FA抑制Hcy誘導的HMCs細胞增殖作用。
[1]Liao D,Yang X,Wang H.Hyperhomocysteinemia and highdensity lipoprotein metabolism in cardiovascular disease[J].Clinical Chemical Laboratory Medicine,2007,45 (12):1652-1659.
[2]Yang ZZ,Zou AP. Homocysteine enhances TIMP-1 expression and cell proliferation associated with NADH oxidase in rat mesangial cells[J].Kidney International,2003,63(3):1012-1020.
[3]Li N, Chen YF, Zou AP. Implications of hyperhomocysteinemia in glomerular sclerosis in hypertension[J].Hypertension,2002,39(2):443-448.
[4]Abdel-Raheem MM, Hebert B, Potti A,et al.Hyperhomocysteinemia and the risk of thromboembolic phenomenon in patients with chronic renal failure[J].Thrombosis Research,2002,105(4):299-302.
[5]Ingram AJ,Krepinsky JC,James L,et al.Activation of mesangial cell MAPK in responseto homocysteine[J].Kidney International,2004,66(2):733-745.
[6]Alvares Delfino VD,de Andrade Vianna AC,Mocelin AJ,et al.Folic acid therapy reduces plasma homocysteine levels and improves plasma antioxidant capacity in hemodialysis patients[J].Nutrition,2007,23(3):242-247.
[7]Beaulieu AJ,Gohh RY,Han H,et al.Enhanced reduction of fasting total homocysteine levels with supraphysiological versus standard multivitamin dose folic acid supplementation in renal transplant recipients [J]. Arteriosclerosis,Thrombosis,and Vascular Biology,1999,19(12):2918-2921.
[8]Stam F,van Guldener C,ter Wee PM,et al.Effect of folic acid on methionine and homocysteine metabolism in end-stage renal disease[J].Kidney International,2005,67(1):259-264.
[9]Bokemeyer D,Panek D,Kramer HJ,et al.In vivo identification of the mitogen-activated protein kinase cascade as a central pathogenic pathway in experimental mesangioproliferative glomerulonephritis[J].Journal of the American Society of Nephrology,2002,13(6):1473-1480.
[10]Masaki T,Stambe C,Hill PA,et al.Activation of the extracellular-signal regulated protein kinase pathway in human glomerulopathies[J].Journal of the American Society of Nephrology,2004,15(7):1835-1843.
[11]Grewal JS,Mukhin YV,Garnovskaya MN,et al.Serotonin 5-HT2Areceptor induces TGF-beta1expression in mesangial cells via ERK:proliferative and fibrotic signals[J].Am J Physiol,1999,276(6Pt 2):F922-F930.

