G-CSF對大鼠燒傷合并海水浸泡后內皮祖細胞的影響
王 培,管云楓,徐添穎,繆朝玉
隨著軍事斗爭準備不斷深入,必須加強對未來的海上作戰救治的研究。在海上及登陸作戰時,可出現大批量的燒傷傷員,而且落水的可能性極大。海水具有高滲、高鈉、低溫的特點,燒傷后海水浸泡可引起嚴重的全身損害,并可進一步發展為多臟器功能障礙綜合征,從而危及生命。
內皮祖細胞(endothelial progenitor cells,EPC)是近10年來發現的一種內皮系起源的祖細胞,其主要的生理功能是在發生創傷后趨化到創面,然后分化、增殖形成內皮細胞,修復血管,從而為器官、組織的最終修復提供血流輸供[1]。因此,EPC的數量和功能與血管修復能力及創面的愈合都有著密切的關系,EPC在燒傷合并海水浸泡后的變化可反映戰傷后的血管修復能力。但是,該方面的內容國內外均未見報道。故本研究以大鼠燒傷后合并海水浸泡模型觀察模型早期EPC的數量變化,以及使用粒細胞集落刺激因子(G-CSF)對EPC數量的影響。
1 材料與方法
1.1 動物及分組 8周齡SD大鼠26只[上海中科院動物中心提供,許可證SCXK(滬)2003-0004],雄性,體重250~300 g。隨機分為①對照組(n=6);②燒傷合并海水浸泡模型組(n=10):致傷后浸泡在人工配制的海水中3 h后撈出;③實驗組(n=10):致傷后于海水浸泡3 h后下肢肌肉注射G-CSF(5 μg/kg)。各組大鼠在體重、鼠齡上無差異,造模后,分別在30 min、2 h、6 h和24 h從大鼠眼內眥球后靜脈叢各取血0.5 ml,置于EDTA抗凝管。
1.2 人工海水的配制 按照國家海洋局第三海洋研究所提供的我國東南沿海海水成分配制,滲透壓1250 ~1350 mmol/L,pH 值 8.2,比重 1.05 ~1.06。實驗室溫度25℃,人工海水溫度23~25℃。
1.3 動物模型制作 實驗動物傷前12 h禁食,采用10%水合氯醛(3 mg/kg)腹腔注射麻醉。于背部30%區域剪毛備皮,用3%凝固汽油均勻涂擦,燃燒15 s后濕巾滅火,致30%背部區域的Ⅱ度燒傷。燒傷合并海水浸泡組致傷后將動物置于固定架上,浸泡于人工海水中3 h,浸泡平面達劍突。
1.4 單個核細胞(PMBCs)分離 使用Ficoll(Amersham-Pharmacia公司,美國)梯度離心從外周血分離單個核細胞。首先將外周血與等量0.01 mol/L磷酸鹽緩沖液(pH:7.2)混勻,緩慢加至淋巴細胞分離液(2∶3)中,室溫下梯度離心。離心半徑15 cm,2400 rpm/min離心20 min,然后分離、收集單個核細胞層(淋巴細胞分離液與血漿中間的灰白色細胞層)。以含有1%牛血清白蛋白的磷酸鹽緩沖液沖洗3遍,再懸浮于0.1 ml上述緩沖液中。
1.5 雙色熒光標記流式細胞術檢測血EPC的數量
根據表面標記為干細胞抗原-1(stem cell antigen-1,Sca-1)陽性以及血管內皮生長因子受體2(vascular endothelial growth factor,VEGFR 2)陽性來確定血EPC數量。首先使用紅細胞裂解液裂解紅細胞(15 min)。然后加入10 μl異硫氰酸熒光素(FITC)標記的山羊抗大鼠Sca-1抗體和10 μl藻紅蛋白(PE)標記的山羊抗大鼠VEGFR 2抗體[2]。室溫避光孵育2 h單個核細胞。以同型的IgG-FITC或IgG-PE染色作為陰性對照。每份標本檢測105個細胞,獲得流式細胞散點圖,從中圈選單個核細胞散點區,對所圈選的單個核細胞進行分析,計數FITC和PE雙陽性細胞比例,反映EPC數量變化。
1.6 統計學處理 采用SPSS 13.0軟件進行統計分析。數據以均數±標準差(±s)表示,組間比較用單因素方差分析,P<0.05為差異有統計學意義。
2 結果
2.1 燒傷合并海水浸泡對血EPC數量的影響 燒傷合并海水浸泡使血EPC數量顯著降低(P<0.05,表1)。
2.2 G-CSF對抗燒傷合并海水浸泡對血EPC數量的影響 G-CSF在造模后2 h、6 h和24 h均顯著改善燒傷合并海水浸泡后血液中EPC數量下降趨勢(P<0.05),但造模30 min后對血EPC的數量影響不大(表1)。
3 討論
燒傷致死主要是因創面經久不愈,以及感染導致的多臟器功能衰竭。目前公認其發病機理是嚴重燒傷后引發過度應激又發生自身毀損炎癥反應,嚴重者或繼發感染者則并發臟器功能障礙或衰竭。燒傷創面的修復反映了從血管損傷、通透性增加,到新生血管形成及過度增殖的變化過程,臨床表現為液體滲出、創面愈合、瘢痕形成等。修復過程復雜,影響因素眾多,極易產生不良后果[2-5]。在海上作戰,燒傷還往往伴有其他復合傷。若傷病員落水,被海水浸泡后,其感染幾率更高,生存率則更低[4-6]。內皮細胞早已被證明在燒傷的愈合中具有重要意義[6-9]。燒傷合并海水浸泡可以嚴重損害內皮功能[10]、凝血功能[11],最終導致創面的微循環障礙[12]。
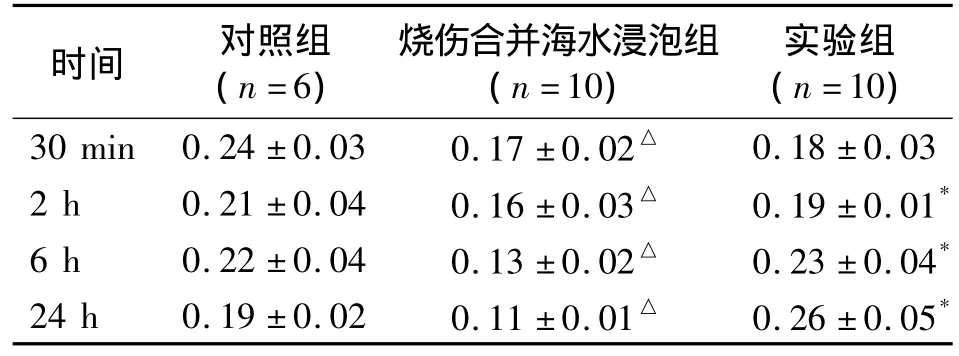
表1 各組血EPC實驗結果(%)
EPC是一類存在于骨髓和全身循環血液中,能增殖、分化為血管內皮細胞,但尚未成熟為血管內皮細胞表型,也未形成血管的前體細胞[13-15]。大量國內外研究發現,EPC不僅參與血管形成,同時也參與出生后血管生成和內皮損傷后的修復。但是EPC的功能在燒傷中的作用則遠未為人所知。最近3~5年以來,開始有EPC在燒傷中的作用的零星報道。2006年,謝松濤等[16]對燒傷患者臍血來源的EPC進行純化鑒定及定向分化,發現EPC具有分化為成熟血管內皮細胞的能力,并且參與了血管重建,具有促進血管新生、加速缺血組織血管化的作用。Fox等[17]隨后在2008年發現在燒傷72 h后,EPC數量明顯增加。但是隨后 Groger等[18]和 Foresta等[19]分別發現了燒傷可以使早期(24 h)的血EPC數量明顯降低。而且,EPC數量下降最明顯的那些燒傷患者,預后最差,死亡率最高[19]。筆者猜測這種差異可能是因為時間點選擇的不同:燒傷后24 h和72 h EPC的動員可能完全不一樣,燒傷后24 h,為骨髓中儲存著的EPC動員入血;而在72 h后,則可能是經過燒傷應激后大量增殖形成的新EPC動員入血。本文發現,在燒傷合并海水浸泡后24 h,大鼠的血EPC數量明顯低于對照組,和Groger等[18]和Foresta 等[19]的結果基本一致。
G-CSF屬于造血生長因子,隨著基因工程技術的發展,國內外許多重組的造血生長因子已投入生產[20]。G-CSF主要來源于巨噬細胞、內皮細胞及纖維母細胞,能高度特異性地刺激中性粒細胞系的前體細胞存活。早在1995年,曹麗萍等[21]就發現了燒傷患者的G-CSF濃度增高。G-CSF的增高有利于中性粒細胞的動員、增加,從而有利于抑制感染,提高患者生存率。目前,G-CSF在臨床上已成為燒傷的常用藥[22]。但是,增加中性粒細胞的數量可能并不是促進G-CSF對燒傷患者愈合作用的唯一機制。從本實驗結果來看,G-CSF顯著增加了血中的EPC數量,直接影響了新生內皮細胞的數量和在創傷局部的聚集。因此,EPC的數量無疑可以極大地影響燒傷合并海水浸泡的預后。據此可以初步推測:G-CSF的應用會增加EPC的數量,而這種量的增加作用可能有利于燒傷、燒傷合并海水浸泡的創面恢復。
綜上所述,大鼠燒傷、燒傷合并海水浸泡復合傷時,血EPC數量在24 h內下降明顯。而G-CSF的使用可逆轉這種趨勢,增加EPC數量,從而有利于創面愈合,增加血液EPC數量可能是G-CSF在燒傷合并海水浸泡治療中顯效的重要機制之一。
[1] Urbich C,Dimmeler S.Endothelial progenitor cells[J].Circulation Research,2004,95(4):343-353.
[2] Wang P,Xu TY,Guan YF,et al.Nicotinamide phosphoribosyltransferase protects against ischemic stroke through SIRT1-dependent adenosine monophosphate-activated kinase pathway[J].Ann Neurol,2011,69(2):360-374.
[3] 阮 兢,鄭慶亦,陳錦河,等.成批燒傷的衛勤組織與臨床救治[J].東南國防醫藥,2011,13(1):5-7.
[4] 李 勇,李國華,李明華.海水浸泡傷早期救治原則[J].臨床軍醫雜志,2008,12(6):12-17.
[5] 李衛東,宋 斌.海上聯合作戰衛勤保障的主要特點與對策[J].海軍醫學雜志,2007,28(3):230-232.
[6] 宗 林,倪洋林,王玉秀,等.光棒及纖維支氣管鏡在頭面部燒傷插管中的應用[J].東南國防醫藥,2011,13(5):393-395.
[7] An J,Li A,Yang Z,et al.Dynamic changes of fibrinopeptides A and B in sera of burn patients and their effects on vascular endothelial cells[J].Burns,1994,20(2):128-131.
[8] Infanger M,Schmidt O,Kossmehl P,et al.Vascular endothelial growth factor serum level is strongly enhanced after burn injury and correlated with local and general tissue edema[J].Burns,2004,30(4):305-311.
[9] 晏 澤.燒傷后一氧化氮,內皮素動態變化與燒傷的關系[J].醫學綜述,1999,5(4):180-183.
[10]閆 紅,賴西南,葛衡江.兩種復合戰傷合并海水浸泡對血管內皮細胞損傷的比較研究[J].中華航海醫學與高氣壓醫學雜志,2003,10(3):133-135.
[11]閆 紅,賴西南,葛衡江.戰傷合并海水浸泡對內皮細胞凝血功能的影響[J].中華航海醫學與高氣壓醫學雜志,2006,13(2):121-123.
[12]馬 軍,王甲漢,李志清,等.大鼠燙傷合并海水浸泡后創面病理學改變的特點[J].南方醫科大學學報,2009,29(6):1297-1299.
[13] Urbich C,Dimmeler S.Endothelial progenitor cells:characterization and role in vascular biology[J].Circ Res,2004,95(4):343-353.
[14]周音頻,黃 嵐.血管內皮祖細胞動員在損傷血管修復中的作用及調控因素[J].中國動脈硬化雜志,2004,12(2):233-234.
[15]喻 楊,黃 嵐.內皮祖細胞功能狀態及其調節[J].中華心血管病雜志,2007,35(11):1067-1069.
[16]謝松濤,陳 璧,陶 克.人臍血來源內皮祖細胞的純化鑒定及定向分化的研究[J].中華燒傷雜志,2006,22(5):355-358.
[17] Fox A,Smythe J,Fisher N,et al.Mobilization of endothelial progenitor cells into the circulation in burned patients[J].Br J Surg,2008,95(2):244-251.
[18] Groger A,Piatkowski A,Grieb G,et al.The mobilisation of mononuclear cells and endothelial progenitor cells after burn injury in a porcine model[J].Burns,2010,36(4):545-551.
[19] Foresta C,Schipilliti M,De Toni L,et al.Blood levels,apoptosis,and homing of the endothelial progenitor cells after skin burns and escharectomy[J].J Trauma,2011,70(2):459-465.
[20]李 靜,陶維良,魏世東,等.重組人粒細胞集落刺激因子(rhG-CSF)的安全性與臨床評價[J].中國醫院用藥評價與分析,2008,8(7):484-486.
[21]曹麗萍,鄧詩琳.燒傷后血粒細胞集落刺激因子的變化及其與感染的關系[J].中華外科雜志,1995,33(7):403-405.
[22]張道坤,鄭國平,楊建秋,等.粒細胞巨噬細胞集落刺激因子在燒傷治療中的應用進展[J].中華燒傷雜志,2009,25(4):316-318.

