DBH基因和α-2BAR基因多態性與原發性高血壓的相關性研究
張培哲,沈 滟,李 舍,駱 延,龔平原
原發性高血壓是遺傳與環境因素相互作用所致的復雜性疾病,臨床上認為鹽離子和肥胖作為重要的環境和機體因素與高血壓的發生密切相關[1]。患者通常存在紅細胞膜的鈉泵活性降低,鈉、鉀、氯等離子的協同轉運功能異常以及肥胖等特征[2]。腎素—血管緊張素系統對維持血管張力及水鈉平衡起了重要的調節作用[3],交感神經系統參與腎臟血流的調節。有研究表明α-2BAR基因12Glu9位點與自主神經的緊張性有一定的相關性,其表達產物能影響血管內皮對縮血管物質的反應性,從而影響外周微、小動脈內皮舒張功能,引起血壓變化[4]。多巴胺β羥化酶可將多巴胺(dopamine,DA)轉化為去甲腎上腺素(norepinephrine,NE),是兒茶酚胺類遞質代謝的關鍵酶之一,大量的證據表明,DBH 結構基因特性決定血漿多巴胺β羥化酶的活性[5-6],從而通過影響DA和NE的合成調控心血管功能。α-2BAR基因和DBH基因與原發性高血壓的關系日益受到人們的重視。目前雖有研究發現α-2BAR基因的12Glu9位點和DBH基因啟動子區的19 bp Insert/Delet位點與原發性高血壓可能相關,但α-2BAR基因12Glu9位點和DBH基因的19 bp Insert/Delet位點與原發性高血壓的相關性還有待進一步證實。本研究通過對洛陽地區漢族人群中α-2BAR基因的12Glu9位點和DBH基因的19bp Insert/Delet位點的多態性進行檢測,探討α-2BAR基因和DBH基因與原發性高血壓和有關離子濃度變化的相關性。
1 對象與方法
1.1研究對象選擇在洛陽市第八人民醫院門診就診的、初診為原發性高血壓患者196例(病例組),男103例,女93例,平均年齡(58.381±11.919)歲。符合WHO/ISH的診斷標準。經體格檢查及實驗室檢查,未經降壓治療,每日鹽攝入量>6 g,排除繼發性高血壓、嚴重肝腎功能異常。選擇同期健康體檢者121例(對照組),男63例,女58例,平均年齡(53.525±18.018)歲。近2個月內未服藥,且每天鹽攝入量<6 g。入選者均知情并同意。
1.2方法
1.2.1樣品采集與基因組DNA提取 每日上午8:00~9:00在空腹情況下測量血壓,收縮壓和舒張壓均取3次測量平均值。然后采集靜脈血5 mL,其中3 mL用于鹽離子濃度測量,另外2 mL采用碘化鉀法提取外周血基因組DNA[7]。
1.2.2功能性多態位點的選擇 選取了α-2BAR基因和DBH基因最受關注的兩個功能性多態位點。其中19 bp Insert/Delet位點是DBH基因啟動子區的一個插入缺失序列。
1.2.3功能性多態位點的基因分型 用Premier5.0軟件設計引物,引物的序列參照NCBI提供的DNA序列信息。α-2BAR基因12Glu9位點上游引物的序列為5’-AGGGTGTTTGTGGGGCATCTCC-3’,下游引物的序列為5’-CAAGCTGAGGCCGGAGACACTG-3’; DBH基因19bp Insert/Delet位點上游引物的序列為5’-GCAAAAGTCAGGCACATGCACC-3’,下游引物的序列為5’-GTCAGCGAGATGGGGAGGTGGA-3’, 兩位點的PCR反應體系包含雙組分簡單型PCR反應系統(Golden Easy PCR System,TIANGEN)4.5 μL,模版0.5 μL,ddH20 4.5 μL,引物各0.25 μL。α-2BAR基因位點的PCR反應條件為94℃預變性3 min,94℃變性30 s,69℃退火30 s,72℃延伸1 min,循環35次,最后72℃延伸4 min;DBH基因位點的PCR反應條件為94℃預變性5 min,94℃變性30 s,67.5℃退火30 s,72℃延伸1 min,循環35次,最后72℃延伸5 min。取PCR產物4 μL,經8%聚丙烯酰胺凝膠恒壓電泳200 V×3 h后,0.1%硝酸銀染色、顯色判別基因型;最后隨機取代表不同的分型結果的PCR產物各3份進行測序,進一步明確各分型結果所代表的具體堿基。
1.2.4統計分析 用SPSS 10.0進行部分數據的處理,使用Fittine軟件進行Hard-Weinberg平衡檢驗,使用CLUMP2.3軟件對基因型頻率和等位基因頻率在病例組與對照組之間進行比較,使用單因素方差分析法分析基因型與收縮壓、舒張壓等臨床指標之間的關系。
2 結果
2.1兩組相關資料比較病例組個體的體質量指數較對照組明顯偏高,兩組之間有統計學意義,同時病例組的Na+濃度較對照組也有顯著差異,而K+濃度、Cl-濃度無顯著差異(表1)。
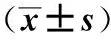
表1 病例組和對照組之間相關臨床指標的比較
2.2基因分型結果及哈德-溫伯格平衡檢驗通過分型并結合測序,檢測到α-2BAR基因12Glu9位點具有3種基因型,Glu9/Glu9基因型體84人、Glu9/Glu12基因型167人、Glu12/Glu12基因型58人;檢測到DBH基因19 bp Insert/Delet位點的各基因型頻數為:Insert/ Insert基因型72人、Insert/Delet基因型155人、Delet/Delet基因型55人。α-2BAR基因12Glu9位點和DBH基因19 bp Insert/Delet位點在該人群樣本中均符合哈德-溫伯格平衡(P=0.119,F=0.089;P=0.083,F=0.103)。
2.312Glu9位點和19bpInsert/Delet位點與原發性高血壓的關系分析α-2BAR基因的基因型頻率、等位基因頻率在病例組和對照組之間均無統計學意義 (P=0.158,P=0.876),DBH基因的基因型頻率、等位基因頻率在病例組和對照組之間均無統計學意義 (P=0.322,P=0.442) (表2)。

表2 基因型及等位基因頻率在病例組和對照組中的比較
2.4兩基因與有關臨床指標的關系分析使用單因素方差分析基因型與收縮壓、舒張壓等臨床指標之間的關系,結果顯示各基因型之間收縮壓、舒張壓、體質量指數、Na+濃度、K+濃度、 Cl-濃度均無顯著性差異(表3)。

表3 α-2B AR基因和DBH基因位點基因型和各臨床特征之間的關系
3 討論
α-2BAR基因和DBH基因在腎素—血管緊張素系統中起重要的作用。已有研究發現α-2BAR基因中谷氨酸重復的3個缺失與小動脈順應性和人類的肥胖有密切關系[4,8-9],另外Ueno等的研究發現α-2BAR基因與自主神經系統的功能有關[10],其中α-2BAR基因的12Glu9位點多態性通過影響自主神經系統功能導致代謝紊亂[10-11],在向心性肥胖者中Glu9/Glu9個體的自主神經緊張性明顯受抑制[12],但通過本實驗得出α-2BAR基因 12Glu9位點在本人群中與原發性高血壓無顯著相關性。關于該基因與人類心腦血管病的報道多來自歐美國家人群,尚未見來自國內的相關報道。本研究首次在中國漢族人群中開展了α-2BAR基因與高血壓的關系研究,但由于本實驗的樣本量較小以及選樣的區域性等因素的影響,未發現α-2BAR基因對高血壓有顯著影響。
DBH基因19 bp Insert/Delet位點的多態性與多巴胺β羥化酶活性有一定的相關性。多巴胺β羥化酶將DA羥化為NE,是DA轉化為NE的關鍵酶之一,其活性影響NE的合成,NE對心血管功能調節、鎮痛和情感障礙起重要作用。已有研究表明DA可以調控心血管功能,進而影響NE的升壓作用[13-14]。本研究發現DBH基因19 bp Insert/Delet位點與原發性高血壓無顯著相關性。有關該基因的相關報道大多為其中樞神經作用,有關心血管的作用還不明確。本實驗通過研究其與原發性高血壓的相關性來闡述其影響,具有一定的參考價值,但本實驗的人群具有地區局限性,所選取的樣本量也有待進一步提高,該基因與原發性高血壓的相關性是否存在地區差異性也有待進一步探討。
參考文獻:
[1] Blaustein MP,Zhang J,Chen I,et al.How does salt retention raise blood pressure[J].Am J Physiol Regul Integr Comp Physiol,2006,290(3):514-523.
[2] Morrison RG,Mills C,Moran AL,et al. A moderately high fat diet promotes salt-sensitive hypertension in obese zucker rats by impairing nitric oxide production[J].Clin Exp Hypertens,2007,29(6):369-381.
[3] Junemaitre X,Inoue I,Willians C,et al.Haplotype of angiotensinogenin essential hypertension[J].Am J Hum Genet,1997,60(6):1448-1460.
[4] 李新立,梁立榮,倪春輝,等.α-2B腎上腺素能受體基因 I/D多態性與小動脈順應性的關系[J].中華心血管病雜志,2006,34(3): 249-251.
[5] 龔平原,張科進,高曉彩,等.中央執行功能與單胺氧化酶A、多巴胺β羥化酶基因功能多態性的關聯研究[J].中華行為醫學與腦科學雜志,2011,20(4):289-291.
[6] 趙曉萍,謝惠君,湯國梅,等.多巴胺β 羥化酶基因多態性與帕金森病遺傳易感性[J].中華行為醫學與腦科學雜志,2003,20(3):238-240.
[7] 趙書平,張俊潔,尤建,等.一種碘化鉀提取外周血基因組DNA的方法[J].中華醫學遺傳學雜志,1999,16(6):395-396.
[8] Cubells JF,van kammen DP,Kelley ME,et al.Dopamine beta-hydroxylase: two polymorphisms in linkage disequilibrium at the structural gene DBH associate with biochemical phenotypic variation[J].Hum Genet, 1989, 102(5):533-540.
[9] Katariina S, Leo N, Markku L,et al.A Deletion in the α2B-Adrenergic receptor gene and autonomic nervous function in central obesity[J].Obes Re,2003,11(8):962-970.
[10] Ueno LM,Frazzatto ES,Batalha LT,et al.alpha2B-Adrenergic receptor deletion polymorphism and cardiac autonomic nervous system responses to exercise in obese women [J].Intl J Obes,2006,30(2):214-220.
[11] Suzuki N,Matsunaga T,Nagasumi K,et al.Alpha(2B)-adrenergic receptor deletion polymorphism associates with autonomic nervous system activity in young healthy Japanese[J].J Clin Endocrinol Metab,2003,88(3):1184-1187.
[12] Sivenius K,Niskanen L,Laakso M,et al.A deletion in the alpha 2B-adrenergic receptor gene and autonomic nervous function in central obesity [J].Obes Res,2003,11(8):962-970.
[13] Abe M,Wu Z,Yamamoto M,et al.Association of dopamine beta-hydroxylase polymorphism with hypertension through interaction with fasting plasma glucose in Japanese[J].Hypertension Res,2005,28(3):215-221.
[14] 潘棱,沈曉麗,林立芳,等.對原發性高血壓患者血漿兒茶酚胺的探討[J].華西醫學,1998 ,13( 4):430-431.

