土壤鹽分對三角葉濱藜抗旱性能的影響
譚永芹,柏新富,* ,侯玉平,張振華
(1.魯東大學生命科學學院,煙臺 264025;2.魯東大學地理與規劃學院,煙臺 264025)
干旱和鹽脅迫是影響植物生長發育、引起農作物減產的主要非生物脅迫因子,干旱通過導致植物水分平衡失調,進而引起代謝紊亂[1];鹽分脅迫則會導致滲透脅迫、離子毒害等作用,擾亂植物的營養元素平衡[2-3],并誘發氧化脅迫等次生脅迫作用[4-5],從而影響植物正常生長。雖然Na+是造成植物鹽分脅迫的主要因子,然而已有實驗證明Na+對許多植物的生長發育或產量、品質都有良好的作用[6-7];Slama等[8]研究還顯示Na+可以提高滲透脅迫下鹽生植物的光合能力。一些荒漠旱生植物更是把地上部積累Na+作為適應干旱環境的有效策略之一[9-10]。在土壤中較多NaCl存在的條件下,植物細胞質膜內負外正的膜電勢和胞外Na+濃度升高建立起的Na+電化學勢梯度,有利于Na+從外界環境到植物細胞內的被動運輸[11-12],因此,干旱條件將誘使更多Na+被植物體吸收和積累。但是,目前有關植物抗旱性的研究多集中在光合作用、水分利用效率、滲透調節、抗氧化酶活性、抗旱性綜合指標等方面,對干旱鹽漬環境導致的植物積Na+及其在植物適應干旱中的作用僅有少量相關報道[13-15],本試驗以耐鹽植物三角葉濱藜(Atriplex triangularis Willd)為材料,研究NaCl對干旱脅迫下三角葉濱藜生長、光合作用、抗氧化活性、水分吸收的調節,探討NaCl改善植物對干旱脅迫適應的機制,以豐富人們對植物適應干旱鹽漬環境機制的了解。
1 材料與方法
1.1 實驗材料與處理
實驗于2012年3—5月在魯東大學生命科學學院溫室內進行,供試材料為三角葉濱藜(Atriplex triangularis)。將種子播種于裝有混合土壤(園土∶細沙=1∶1)的直徑45cm的花盆中,適時澆水,確保土壤濕潤,出苗后間苗,每盆留7株小苗。待植株長出6片真葉(高約15cm)時將材料分成A、B、C、D、E五組(每組3盆)。A、B兩組澆水,C、D、E三組分別澆濃度為0.1、0.2、0.4mol/L的NaCl溶液,澆水或處理液的量為每盆12L,確保盆土中溶液被替換為相應濃度的處理液。隨后B、C、D、E組停止澆灌,進行自然干旱處理;處理A則保持見干澆水,即A為沒有進行干旱處理的對照(CK)、B為干旱處理(Dry)、C為干旱加0.1mol/L的NaCl(Dry+0.1mol/L NaCl)、D為干旱加0.2 mol/L的NaCl(Dry+0.2 mol/L NaCl)、E為干旱加0.4 mol/L的NaCl(Dry+0.4mol/L NaCl)。在處理期間每5d取成熟葉片進行相關指標測定。
1.2 測定方法
1.2.1 植株生長狀況測定
株高增加值以處理前子葉至頂端的高度與實驗結束時(處理后的第20天)子葉至頂端的高度的差值計算,每處理重復測定7株。
1.2.2 光合參數測定
利用便攜式光合作用測定系統(TPS-1型,PP System,英國)對不同處理下的三角葉濱藜光合參數進行測定(測定光強為960—980μmol·m-2·s-1,開路測定)。該系統能同步獲得活體葉片的凈光合速率(Pn)、空氣CO2濃度(Ca)、細胞間隙CO2濃度(Ci)等生理生態參數,氣孔限制值(Ls)用Berry和Downtow[16]的方法計算:。每種處理均取上數第1個成熟葉為測定對象,各處理均重復測定5株植物的5個葉片。
1.2.3 抗氧化酶活性和丙二醛(malondialdehyde,MDA)含量測定
超氧化物歧化酶(superoxide dismutase,SOD)活性和過氧化物酶(peroxidase,POD)活性測定參照孫群等[17]的方法;過氧化氫酶(catalase,CAT)活性測定采用郝建軍等[18]的方法;丙二醛含量參照趙世杰[19]的方法測定。
1.2.4 土壤、葉片相對含水量(RWC)測定
用烘干稱重法

1.2.5 植株水勢、滲透勢和細胞膨壓的測定
植株水勢用壓力室法測定;葉片滲透勢采用露點微伏壓計(HR-33T,美國)測定,葉片先在-18℃冰箱冷凍12h以上,取出解凍至室溫后擠壓出組織液測定;細胞膨壓由“水勢-滲透勢”計算得出。
1.2.6 葉片Na+含量測定
葉片Na+的提取參照王寶山等[20]的方法,提取液中Na+含量用原子吸收分光光度計(GBC-932B型,澳大利亞)測定。
1.3 數據處理
測定結果以平均值±標準差計。用Origin軟件作圖、SPSS統計軟件進行數據處理和差異性分析。
2 結果與分析
2.1 土壤鹽分對三角葉濱藜生長的調節
很多研究表明植物的生長對水分脅迫最為敏感[21]。通過對各處理的植株在處理期間生長狀況的測定發現,雖然干旱抑制了植株生長,使植株株高增加量顯著低于對照(CK),但干旱加NaCl處理(Dry+0.1—Dry+0.4mol/L NaCl)的植株生長情況明顯優于干旱處理(Dry)(圖1)。經方差分析和多重比較顯示,植株株高增加量在處理D、E之間以及處理C、D之間差異不顯著(P>0.05),但處理C、D、E都顯著高于處理B(P<0.05)。說明在土壤加入0.1—0.4 mol/L NaCl可明顯緩解干旱脅迫對植株生長的抑制作用。
2.2 土壤鹽分對三角葉濱藜葉片光合作用的調節
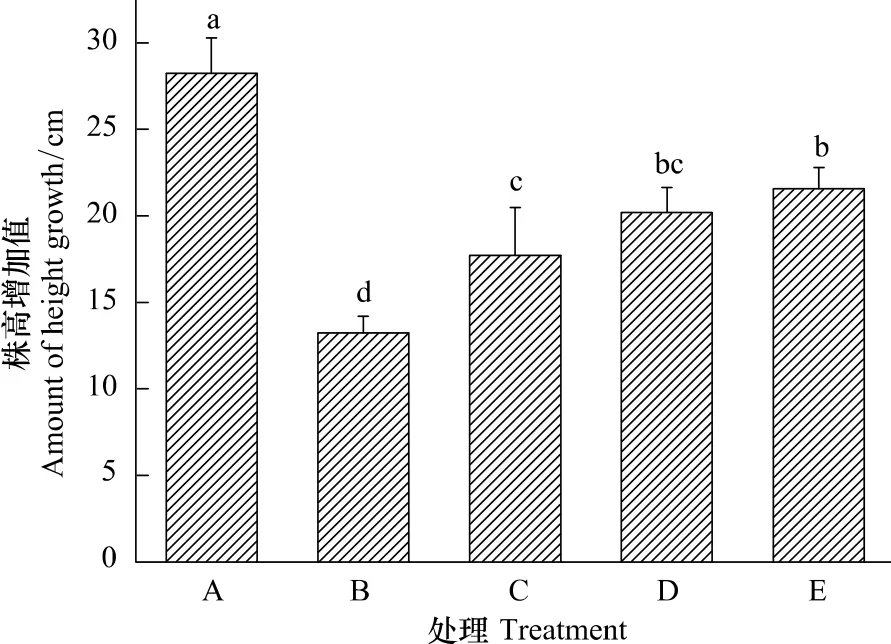
圖1 各處理三角葉濱藜植株株高在處理期間的增長量Fig.1 The amount of height growth in arrowleaf saltbush during the period of treatment
對各處理葉片光合速率的測定結果表明,干旱脅迫導致三角葉濱藜葉片的光合速率顯著降低(圖2),其中處理B(Dry)在處理后第5天光合速率開始大幅下降,至處理后第20天降至近0;而處理C、D、E(Dry+0.1—Dry+0.4mol/L NaCl)的光合速率下降幅度明顯小于處理B。進一步分析各處理的細胞間隙CO2濃度和氣孔限制值的變化發現,處理B植株在處理后的前10 d葉片細胞間隙CO2濃度下降、氣孔限制值升高,10 d后細胞間隙CO2濃度快速升高、氣孔限制值則大幅下降;而處理C、D、E的細胞間隙CO2濃度和氣孔限制值均無大幅度的下降和升高的變化(圖2)。依據高輝遠等[22]的觀點,可以認為處理B在處理后的前10 d光合速率下降的原因是氣孔關閉或部分關閉導致的CO2供應不足,10 d后光合速率下降的主要原因則是光合機構受損導致的葉肉細胞光合活性的降低;而處理C、D、E在測定期限內,光合速率下降的原因主要是氣孔因素,并沒有引起光合機構的明顯受損。可見,在土壤中適量NaCl的存在可緩解干旱對葉片光合作用的影響。
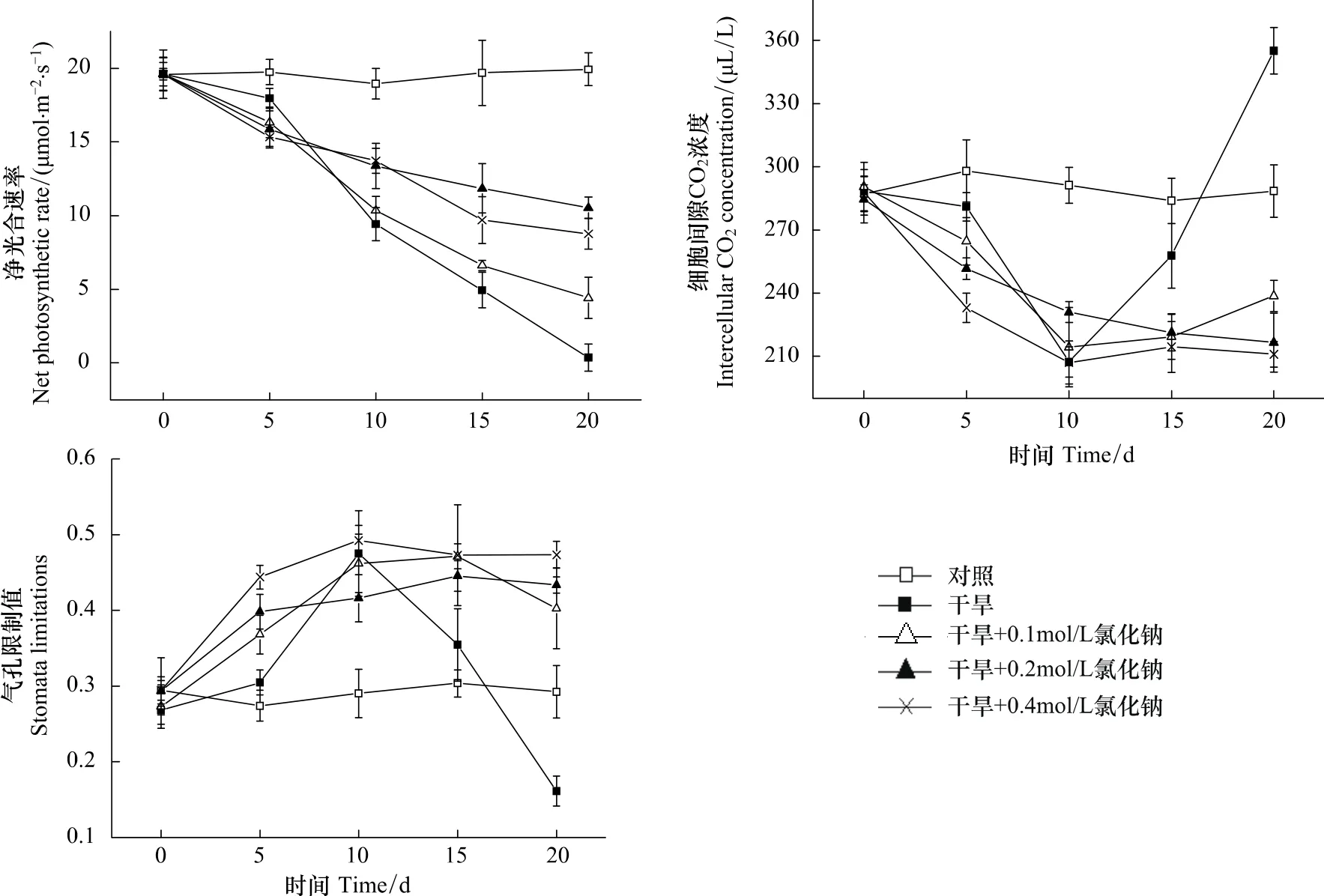
圖2 葉片凈光合速率、細胞間隙CO2濃度和氣孔限制值隨干旱時間的變化Fig.2 Changes in net photosynthesis,intercellular CO 2 concentration and stomata limitations in arrowleaf saltbush upon treatment time
2.3 土壤鹽分對三角葉濱藜葉片抗氧化活性的調節
超氧化物歧化酶(SOD)、過氧化物酶(POD)和過氧化氫酶(CAT)是植物抗氧化系統中重要的抗氧化酶,分別清除超氧陰離子自由基[23]、羥基自由基和過氧化氫[24],是植物體內消除活性氧傷害的重要防線。從圖3中可看出,處理A(CK)植株葉片3種酶活性相對穩定,干旱處理的植株葉片3種酶的活性則顯著升高,且處理B(Dry)的3種酶活性的升高幅度明顯高于處理C、D、E(Dry+0.1—Dry+0.4mol/L NaCl),并在處理15d后又出現SOD和CAT活性的急劇下降。
MDA是脂質過氧化的產物,其含量表明植物體受活性氧破壞的程度。MDA積累越多,表明植物細胞受傷害程度越大[25-26]。圖3顯示,三角葉濱藜葉片中MDA含量隨干旱時間的延長均呈增加趨勢,但處理B的植株葉片MAD含量顯著高于處理C、D、E,在干旱處理后20d其MAD含量約為的后三者的1.5—2倍。
2.4 各處理土壤和植株水分狀況及組織Na+含量的比較
為了進一步探明土壤鹽分在三角葉濱藜耐旱中的作用,本實驗對不同處理的土壤和植株水分狀況以及組織Na+含量進行了測定,結果見圖4和表1。圖4顯示土壤RWC除對照組因澆水而保持較高外,各處理均隨干旱時間的延長而持續下降,但處理C、D、E的土壤RWC下降幅度明顯小于處理B;葉片RWC的變化只是在干旱處理的前5d,因土壤水分較充足,各處理的葉片RWC變化均較小,隨后變化趨勢與土壤相似。這一結果說明土壤鹽分的增加既可使土壤維持相對較高的含水量,也有利于保持植株水分。對植株水勢、滲透勢等的測定結果(表1)進一步證實,雖然處理C、D、E的植株水勢與處理B的差異不明顯,但由于組織內積累了較多的Na+,降低了滲透勢,從而維持了相對較高的細胞膨壓和葉片姿態。
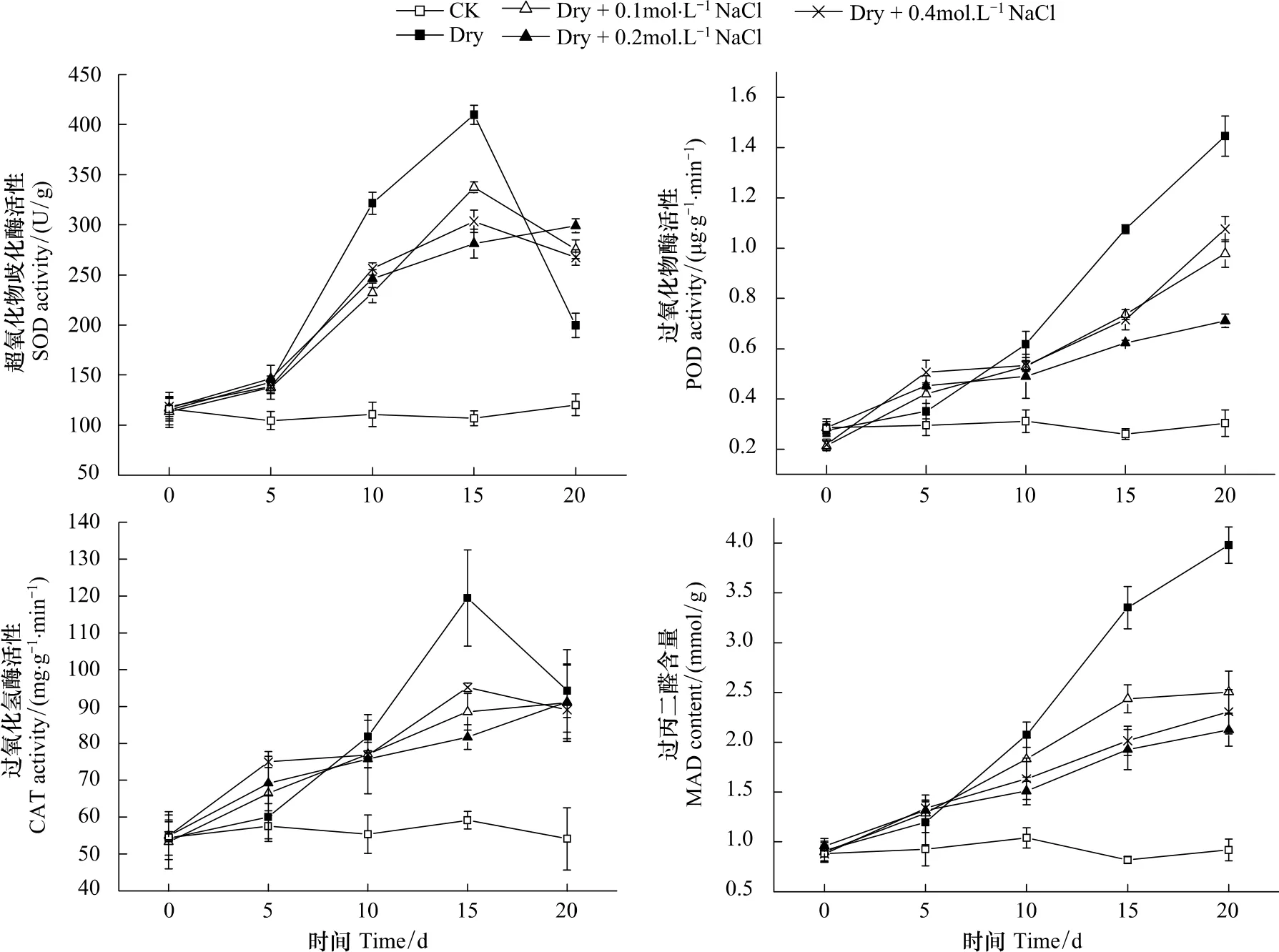
圖3 不同土壤鹽分下三角葉濱藜葉片抗氧化酶活性和丙二醛含量隨干旱持續時間的變化Fig.3 Changes in antioxidant enzyme activity and MAD content in arrowleaf saltbush upon drought duration under different soil salinity
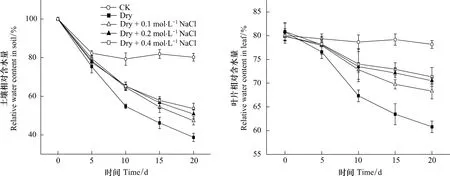
圖4 土壤和葉片相對含水量隨干旱處理時間的變化Fig.4 Variations of RWC in soil and leaves upon drought duration under different soil salinity
3 討論
干旱脅迫導致植物細胞供水不足,進而影響植物代謝和生長發育的各個方面,包括光合速率下降、膜脂過氧化加劇、生長受抑制等。植物則通過滲透調節降低其滲透勢和水勢,增強從外界介質吸水的動力,以維持細胞膨壓和植株的代謝、生長[27]。有研究顯示,Na+可以改善滲透脅迫下鹽生植物的滲透勢,增加組織的含水量,且鹽分的攝入使植物能夠在較低能耗的前提下積累Na+,比合成、積累有機物進行滲透調節更為經濟有效[8,28]。本試驗結果表明,處理C、D、E(盆土用0.1—0.4 mol/L NaCl溶液澆灌后進行干旱處理)與處理B(盆土直接用水澆灌后進行干旱處理)相比,隨著干旱持續時間的延長,不僅土壤和植株均能維持相對較高的含水量,而且由于組織內積累了較多的Na+,使滲透勢顯著降低,增強了植株吸水力和保水力,使葉片能夠維持相對較高的細胞膨壓,進而有利于植株代謝的維持和保持生長。
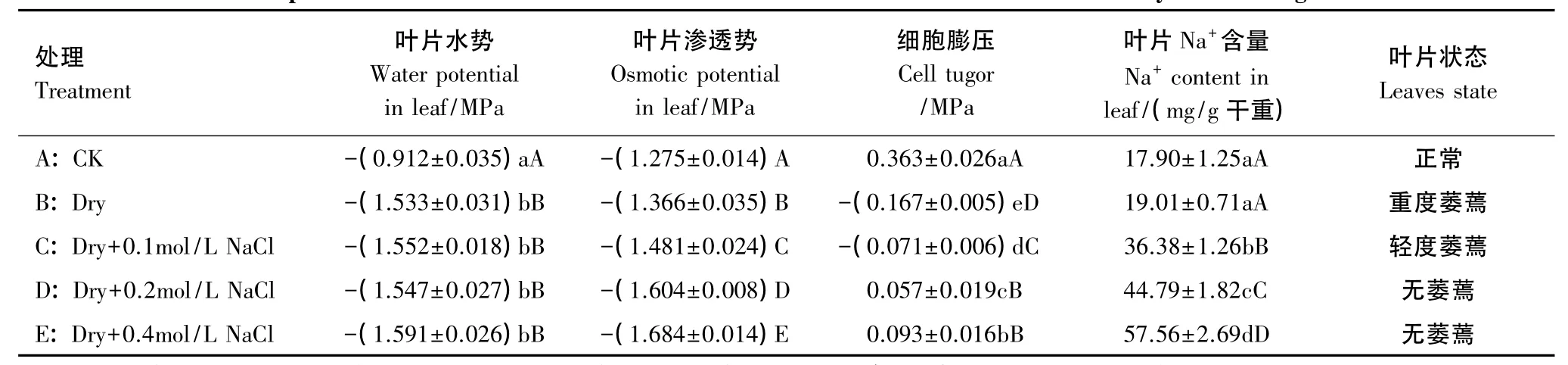
表1 干旱處理后第20天植株葉片水分狀況和Na+含量的比較Table 1 Comparison of the water status and Na+content in arrowleaf saltbush leaves in 20 days after drought treatment
干旱脅迫下細胞內產生過剩的活性氧自由基,造成細胞膜系統損傷,影響植物的光合作用等一系列代謝活動[29];同時,活性氧也可作為第二信使介導逆境脅迫下植物體內的信號轉導,調節抗氧化酶等相關基因表達及酶活性的上升,從而提高植物的耐逆性[24,30]。SOD、POD和CAT是植物體內重要的抗氧化酶,已有大量研究證明植物的抗旱能力和受傷害程度與這3種酶的活性密切相關,總體表現為SOD、POD、CAT活性隨干旱脅迫強度的增大而升高,當脅迫強度超出植物能夠承受的程度后,SOD、CAT活性出現降低,POD活性則因植物種類不同而表現出差異[31-34]。本試驗對各處理植株光合指標和抗氧化酶活性的測定結果顯示,處理B在干旱處理后的前10 d光合速率下降的原因是氣孔關閉或部分關閉導致的CO2供應不足;10 d后光合速率下降的主要原因則是光合機構受損導致的葉肉細胞光合活性的降低;而處理C、D、E在測定期限內光合速率下降的原因主要是氣孔因素,并沒有引起光合機構的明顯受損。對抗氧化酶活性測定結果則表明,處理B的三角葉濱藜葉片SOD、POD、CAT活性顯著增加,在干旱處理后第15天后,SOD和CAT活性又大幅度下降;而處理C、D、E的SOD、POD、CAT活性變化幅度均明顯小于處理B。根據前人的研究與分析,可以推測,處理B干旱期間SOD、POD、CAT活性的大幅升高是干旱脅迫導致的大量活性氧自由基產生所誘導的植株保護性反應,后期SOD和CAT活性的大幅度降低則是活性氧自由基產生的超出了植株清理能力所能承受的范圍而導致細胞傷害的結果;而處理C、D、E在干旱期間3種酶活性的變化幅度較小,說明NaCl溶液澆灌土壤減弱了干旱脅迫誘導的活性氧自由基的產生,本試驗中對MDA含量的測定結果也證明了這一點。可見,在土壤中適量NaCl的存在可減少活性氧自由基的產生,緩解活性氧自由基誘導的膜脂過氧化作用,降低了干旱脅迫對葉片光合系統的損傷。
可見,土壤中適量鹽分存在能夠增加三角葉濱藜對Na+的吸收和積累、降低組織滲透勢、維持較強的吸水和保水力,從而減弱因干旱脫水導致的過量活性氧自由基產生對細胞膜系統的損傷和對光合機構的破壞,有利于維持相對較高的物質生產能力和細胞的持續生長,最終表現為耐旱性能的增強。
[1]Lu C M,Zhang Q D,Kuang T Y,Wang Z,Gao Y Z.The mechanism for the inhibition of photosynthesis in rice by water stress.Acta Agronomica Sinica,1994,20(5):601-606.
[2]Akita S,Cabuslay G S.Physiological basis of differential response to salinity in rice cultivars//Bassam N E,Dambroth M,Loughman B C,eds.Genetic Aspects of Plant Mineral Nutrition(Vol 42).London:Kluwer Academic Publishers,1990:431-448.
[3]St?pień P,K?bus G.Water relations and photosynthesis in Cucumissativus L.leaves under salt stress.Biologia Plantarum,2006,50(4):610-616.
[4]Zhang Z G,Shang Q M,Wang L H,Mao SL,Zhang B X.The characteristics of active oxygen metabolism in pepper leaf cells under suboptimal temperature,weak light and salt stress.Acta Horticulturae Sinica,2009,36(11):1603-1610.
[5]Han B,Sun J,Guo SR,Jin C Y.Effects of calcium on antioxidant enzymes activities of cucumber seedlings under salt stress.Acta Horticulturae Sinica,2010,37(12):1937-1943.
[6]Harmer P M,Benne E J.Sodium as a crop nutrient.Soil science,1945,60(2):137-148.
[7]Truog E,Berger K C,Attoe O J.Response of nine economic plants to fertilization with sodium.Soil Science,1953,76(1):41-50.
[8]Slama I,Ghnaya T,Messedi D,Hessini K,Labidi N,Savoure A,Abdelly C.Effect of sodium chloride on the response of the halophyte species Sesuvium portulacastrum grown in mannitol-induced water stress.Journal of Plant Research,2007,120(2):291-299.
[9]Wang SM,Wan C G,Wang Y R,Chen H,Zhou ZY,Fu H,Sosebee R E.The characteristics of Na+,K+and free proline distribution in several drought-resistant plants of the Alxa Desert,China.Journal of Arid Environments,2004,56(3):525-539.
[10]Yang X G,Fu H,Niu D C.Response of physiology of Zygophyllum xanthoxylum seedlings under drought stress.Acta Prataculturae Sinica,2007,16(5):107-112.
[11]Chen M,Li P H,Wang B S.Na+transporters and plant salt tolerance.Plant Physiology Communications,2007,43(4):617-622.
[12]Niu X,Bressan R A,Hasegawa P M,Pardo J M.Ion homeostasis in NaCl stress environments.Plant Physiology,1995,109(3):735-742.
[13]Huang W,Li Z G,Qiao H L,Li C Z,Liu X J.Interactive effect of sodium chloride and drought on growth and osmotica of Suaeda salsa.Chinese Journal of Eco-Agriculture,2008,16(1):173-178.
[14]Liu J P,Gao B,Li X,Song J,Fan H,Wang B S,Zhao K F.The effects of salinity and drought interaction on seed germination and seedling growth of Suaeda salsa L.from different habitats.Acta Ecologica Sinica,2010,30(20):5485-5490.
[15]Bai X F,Zhu JJ,Wang Z L,Tan Y Q,Liu L D.Relationship between the Salt accumulation and the drought resistance in several woody plants in arid zone.Scientia Silvae Sinicae,2012,48(7):45-49.
[16]Berry J A,Downton W J S.Environmental regulation of photosynthesis.//Govind J,ed.Photosynthesis(VolⅡ).New York:Academic Press,1982:263-343.
[17]Sun Q,Hu J J.Research Technology of Plant Physiology.Yangling:Northwest A & F University Press,2006:165-177.
[18]Hao J J,Kang Z L,Yu Y.Experimental Techniques of Plant Physiology.Beijing:Chemical Industry Press,2007:102-103.
[19]Zhao SJ,Liu H S,Dong X C.The Experimental Guide for Plant Physiology.Beijing:China Agricultural Science & Technology Press,1998:161-165.
[20]Wang B S,Zhao K F.Comparison of extractive methods of Na and K in wheat leaves.Plant Physiology Communications,1995,31(1):50-52.
[21]Shan L.Plant drought resistance and semi-dryland farming.Agricultural Research in the Arid Areas,2007,25(1):1-5.
[22]Gao H Y,Zou Q,Cheng B S.Study on the stomatal and nonstomatal limitation during the diurnal course of photosynthesis in soybean leaves.Acta Botanica Boreali-Occidentalia Sinica,1993,13(2):96-102.
[23]Asada K.Production and scavenging of reactive oxygen species in chloroplasts and their functions.Plant Physiology,2006,141(2):391-396.
[24]Apel K,Hirt H.Reactive oxygen species:metabolism,oxidative stress,and signal transduction.Annual Review of Plant Biology,2004,55(1):373-399.
[25]Jiang M Y,Guo SC.Iron-catalysed lipid peroxidation in rice seedlings under osmotic stress.Acta Physiologica Sinica,1996,22(1):6-12.
[26]Yu Z Q,Sun M G,Wei H X,Kong Y J,Kong H L.Effect of salt and drought intercross stress on lipid peroxidation and activity of cell defense enzymes in leaves of Gleditsia sinensis seedlings.Journal of Northwest Forestry University,2007,22(3):47-50.
[27]Chen H,Jiang J G.Osmotic adjustment and plant adaptation to environmental changes related to drought and salinity.Environmental Reviews,2010,18(NA):309-319.
[28]Chen CS,Xie Z X,Liu X J.Interactive effects of drought and salt stresses on winter wheat seedlings growth and physiological characteristics of stress-resistance.Chinese Journal of Applied Ecology,2009,20(4),811-816.
[29]Elstner E F.Oxygen activation and oxygen toxicity.Annual Review of Plant Physiology,1982,33(1):73-96.
[30]Mano J.Early events in environmental stresses in plants-induction mechanisms of oxidative stress//Inze D,Montago MV,eds.Oxidative Stress in Plants.New York:Taylor and Francis Publishers,2002:217-245.
[31]Yan X F,Li J,Zu Y G.Effect of drought stress on activity of cell defense enzymes and lipid peroxidation in korean pine seedlings.Acta Ecologica Sinica,1999,19(6):850-854.
[32]Peng L X,Wu D,Li H,Yan G R.Effects of water stress on activities of antioxidant enzymes of Elaeagnus angustifolia L.seedlings.Journal of Tianjin Agricultural University,2007,14(1):1-5.
[33]Zhou H B,Wang Y C,Shi SL,Zhou JH.Response of antioxidant system in leaves of Tetraena mongolica and Zygophyllum xanthoxylon seedlings to drought stress.Acta Botanica Boreali-Occidentalia Sinica,2011,31(6):1188-1194.
[34]Wang SC,Liang D,Li C,Hao Y L,Ma F W,Shu H R.Influence of drought stress on the cellular ultrastructure and antioxidant system in leaves of drought-tolerant and drought-sensitive apple rootstocks.Plant Physiology and Biochemistry,2012,51:81-89.
參考文獻:
[1]盧從明,張其德,匡廷云,王忠,高煜珠.水分脅迫抑制水稻光合作用的機理.作物學報,1994,20(5):601-606.
[4]張志剛,尚慶茂,王立浩,毛勝利,張寶璽.亞適溫、弱光照及鹽脅迫下辣椒葉片活性氧代謝特征.園藝學報,2009,36(11):1603-1610.
[5]韓冰,孫錦,郭世榮,金春燕.鈣對鹽脅迫下黃瓜幼苗抗氧化系統的影響.園藝學報,2010,37(12):1937-1943.
[10]楊鑫光,傅華,牛得草.干旱脅迫下幼苗期霸王的生理響應.草業學報,2007,16(5):107-112.
[11]陳敏,李平華,王寶山.Na+轉運體與植物的耐鹽性.植物生理學通訊,2007,43(4):617-622.
[13]黃瑋,李志剛,喬海龍,李存楨,劉小京.旱鹽互作對鹽地堿蓬生長及其滲透調節物質的影響.中國生態農業學報,2008,16(1):173-178.
[14]劉金萍,高奔,李欣,宋杰,范海,王寶山,趙可夫.鹽旱互作對不同生境鹽地堿蓬種子萌發和幼苗生長的影響.生態學報,2010,30(20):5485-5490.
[15]柏新富,朱建軍,王仲禮,譚永芹,劉林德.干旱區木本植物鹽分積累與其耐旱性的關系.林業科學,2012,48(7):45-49.
[17]孫群,胡景江.植物生理學研究技術.楊凌:西北農林科技大學出版社,2006:165-177.
[18]郝建軍,康宗利,于洋.植物生理學實驗技術.北京:化學工業出版社,2007:102-103.
[19]趙世杰,劉華山,董新純.植物生理學實驗指導.北京:中國農業科技出版社,1998:161-165.
[20]王寶山,趙可夫.小麥葉片中Na、K提取方法的比較.植物生理學通訊,1995,31(1):50-52.
[21]山侖.植物抗旱生理研究與發展半旱地農業.干旱地區農業研究,2007,25(1):1-5.
[22]高輝遠,鄒琦,程炳嵩.大豆光合日變化過程中氣孔限制和非氣孔限制的研究.西北植物學報,1993,13(2):96-102.
[25]蔣明義,郭紹川.滲透脅迫下稻苗中鐵催化的膜脂過氧化作用.植物生理學報,1996,22(1):6-12.
[26]于振群,孫明高,魏海霞,孔艷菊,孔紅嶺.干旱和鹽分交叉脅迫對皂角幼苗膜脂過氧化及保護酶活性的影響.西北林學院學報,2007,22(3):47-50.
[28]陳成升,謝志霞,劉小京.旱鹽互作對冬小麥幼苗生長及其抗逆生理特性的影響.應用生態學報,2009,20(4):811-816.
[31]閻秀峰,李晶,祖元剛.干旱脅迫對紅松幼苗保護酶活性及脂質過氧化作用的影響.生態學報,1999,19(6):850-854.
[32]彭立新,吳迪,李慧,閻國榮.水分脅迫對沙棗幼苗抗氧化酶活性的影響.天津農學院學報,2007,14(1):1-5.
[33]周紅兵,王迎春,石松利,周健華.四合木和霸王幼苗抗氧化系統對干旱脅迫的響應差異.西北植物學報,2011,31(6):1188-1194.

