OPRK1基因SNP與梅花鹿晝間行為性狀的相關性
呂慎金,楊 燕,魏萬紅
(1.臨沂大學生命科學學院,臨沂 276005;2.揚州大學生物科學與技術學院,揚州 225009;3.臨沂市農業科學院,臨沂 276012)
隨著分子生物學的發展,近年來許多學者將動物的數量性狀與基因進行關聯性分析,以篩選候選基因[1]。動物的行為也受到基因的控制,將動物行為與基因型進行相關性分析,不但可以了解行為表達的機制,也可以更為深刻的了解如何操作與控制動物行為,以更好的為人類和改善動物福利服務[2],而有關該方面的研究正處于探索之中。李劍虹等曾利用SNP方法對大白、長白和杜洛克豬的Kappa阿片(OPRK1)受體進行分析,結果表明Kappa阿片受體基因SNP對母豬靜止站立行為性狀存在一定影響[3]。對嗜酒(alcoholpreferring)和厭酒小鼠(alcohol-avoiding)的OPRK1基因多態性分布研究結果表明,在BALB/cJ厭酒小鼠OPRK1啟動子區發現突變序列,而另外C57BL/6ByJ和CXBI兩種小鼠沒有發現多態位點,但其腦中mRNA表達水平不同[4]。
應激行為能引起機體分泌多種內源性阿片肽[5]。目前發現并克隆了3種阿片受體,分別為Kappa受體[6]、Mu 受體[7]和 Delta受體[8]。Kappa阿片受體又稱作 OPRK1(Kappa Opoioid Receptor 1)基因,屬于 G 蛋白偶聯受體家族成員。研究表明OPRK1阿片受體主要分布在與痛覺、情緒、行為等有關的中樞神經系統區域,對動物的神經反應和行為表現有重要影響[9-10]。內源性阿片肽與不同的受體結合,參與表達性格、情緒、種屬生存行為等一些基本反應,也對傷害性刺激、應激、獎賞等有不同的反應[7]。梅花鹿(Cervus nippon)屬于哺乳綱(Mammalia)、偶蹄目(Artiodactyla)、鹿科(Cervidae)、花鹿屬(Cervus)。我國梅花鹿共6個亞種:東北亞種(C.n.hortulorum)、華南亞種(C.n.kopschi)、四川亞種(C.n.sinchuanicus)、臺灣亞種(C.n.taiouanus)、山西亞種(C.n.grassianus)和華北亞種(C.n.mandarinus)[11]。目前,野生梅花鹿僅存3個亞種,都被列為國家Ⅰ級保護動物[12]。人工飼養梅花鹿品系基本是在東北亞種的基礎上選育而成[13]。近年來,國內對圈養梅花鹿報道主要集中在飼養繁殖、疾病防治、鹿茸生產等方面,對梅花鹿的行為學、遺傳學研究也有報道[14-16],而OPRK1基因多態性和梅花鹿晝間行為性狀是否相關尚無報道。因此,本研究以PCR-SSCP技術為手段,分析了OPRK1基因在梅花鹿中的單核苷酸多態性,驗證基因多態性和動物行為性狀是否相關,為進一步研究候選基因在動物行為遺傳特性方面提供理論基礎,也為與行為性狀相關基因的篩選提供途徑和方法。
1 材料與方法
1.1 研究材料
本研究梅花鹿來自揚州市動物園和揚州市平山堂養殖場兩地((119°26'E,32°24'N))。兩地均處于亞熱帶南部季風氣候區,四季分明,年平均氣溫15.4℃,最冷月1月的平均氣溫1.8℃,最熱月7月的平均氣溫為27.5℃。日照2 113 h,無霜期238 d,年降水量1 020 mm。平山堂養殖場位于揚州市瘦西湖景區,該場占地面積約1 500 m2,共4個半敞開式圈舍,每個圈舍面積20 m×10 m,共觀測記錄25只成年梅花鹿(♂15只,♀10只)。江蘇省揚州市動物園位于揚州市郊區灣頭鎮,該園占地面積約52.6 hm2,梅花鹿個體散放公園食草區內(100 m×50 m),共觀測記錄23只(♂13只,♀10只)。兩地梅花鹿飼喂時間均為每天8:00和15:00左右各1次。食物主要為白三葉(Trifolium repens)、紫花苜蓿(Medicago sativa)和其它青草,補充精料為配合飼料,飼料主成分為玉米、豆粕、麩皮、食鹽及多種維生素、礦物質、微量元素等。
1.2 研究方法
1.2.1 行為性狀觀察
首先對兩地梅花鹿個體進行辨識,利用耳標、角的形狀、身體上的斑痕及個體大小等體型外貌特征區分梅花鹿個體。
在正式觀察之前進行為期7 d的預觀察,確定動物的行為格局和記錄方法,并對觀察者進行培訓。正式觀察時間為2006年7—12月及2007年2—6月,每周觀察4 d。采用目標動物取樣法每天8:30—16:30在距離動物5—15 m處對動物的行為進行觀察。觀察時1人觀察口述,1人記錄,每2 h輪換1次。根據梅花鹿生理特點以及前人研究結果[17],將梅花鹿行為參數定義如下:
取食 梅花鹿的上下唇協同動作,對青草、飼料等食物進行切割、咀嚼、吞咽的過程,若梅花鹿在移動過程中有上述動作發生,仍將其視為取食行為;反芻 梅花鹿在非睡眠時,頭部高于背中線,對食物進行逆嘔、咀嚼等過程,反芻分站立反芻和臥倒反芻;臥息 梅花鹿的臥息包括休息、淺睡和睡眠,臥下時,前肢先跪下,后肢下蹲,接著腹部著地,最后臀部觸地,臥姿分為左側臥和右側臥;
觀望 梅花鹿頭昂起,耳朵朝有異響或異樣方向轉動,四肢靜止不動,情況危急時則尾巴翹起,用力踏地;移動 梅花鹿從一地點到另外一地點的動作,移動包括走動和跑動,以走動為主;
修飾 梅花鹿為求得舒適而進行的自潔行為及排除蚊蠅干擾或對身體某些部位進行舔舐、輕咬、蹭墻、搔扒等行為;
其它 梅花鹿的飲水、排尿、排糞、嬉戲、鳴叫等。觀測過程中,如果由于天氣等原因不能觀測,則在1周內補充觀測。
由于動物園梅花鹿受游客影響較大,因此周末以及國家法定節日期間單獨觀測統計[18]。觀測結束后,對行為記錄數據進行整理,錄入計算機進行分析。
1.2.2 血樣采集
梅花鹿麻醉后頸靜脈采血5—10 mL,置于15 mL指型管中(內置1—2.5 mL裂解液),充分搖動至血細胞完全破裂,溶液呈粘稠狀為止。兩地共采集樣本48份,其中,揚州市平山堂養殖場共采集血樣25份(♂15只,♀10只);動物園采集樣本23份(♂13只,♀10只),并做好詳細的個體信息登記。
1.2.3 引物信息
應用Primer 5.0軟件,根據GenBank中收錄有關OPRK1基因序列NC_007312、NW_00149302設計9對引物(表1)。各引物均由上海生工科技有限公司合成。引物稀釋過程分2步進行:首先稀釋為正常擴增的10倍濃度,-20℃長期保存;使用時再稀釋10倍,作為正常使用的引物濃度。
1.2.4 最佳PCR擴增體系
PCR 反應體系為 20 μL,其中 0.20 μL(5U/μL)Taq 酶,2.20 μL 10×buffer(含 Mg2+),1.20 μL 濃度為1 μmol/L引物,1.20 μL濃度為2.0 mmol/L dNTPs,1.40 μL濃度為50 ng/L基因組DNA,最后用去離子滅菌水補齊至20 μL體系。PCR反應程序如下:94℃預變性5 min,然后94℃變性45 s,54—56℃退火40 s,72℃延伸30 s,共33個循環。72℃延伸5 min,產物4℃保存。

表1 梅花鹿OPRK1基因引物信息Table 1 Information of primers for sika deer with OPRK1 gene
1.3 分析方法
建立模型:
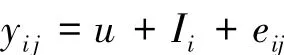
式中,yij為行為性狀觀測值;u為群體均值;Ii為第i基因型效應值;eij為隨機誤差。應用SPSS軟件一般線性模型,對不同基因型與行為性狀的關系進行比較分析。所有動物行為性狀以8 h統計記錄,以行為持續時間(M±S.E.)為觀測變量,以不同基因型作為另一變量,輸入SPSS軟件分析系統,即可進行統計分析。
2 結果與分析
2.1 基因組DNA提取及PCR擴增產物檢測
從梅花鹿血樣中提取的基因組DNA溶于300 μL TE中,室溫溶解24 h后用1.0%瓊脂糖凝膠電泳檢測。結果表明提取的基因組沒有降解,條帶較均勻一致,所含DNA符合生物學試驗要求(圖1)。在設計的9對引物中,只有位于第二內含子引物P-5和第三外顯子的P-9引物獲得擴增產物(圖2)。對引物P-5進行SSCP分析,結果表現3種基因型,分別命名為EE、EF、FF(圖3)。對引物P-9進行SSCP分析,結果表現3種基因型,分別命名為 GG、GH、HH(圖4)。

圖1 梅花鹿基因組DNAFig.1 The genome DNA of sika deer

圖2 引物P-9 PCR產物檢測結果Fig.2 Result of agrose gel electrophoresis for PCR product of primer P-9

圖3 引物P-5多態性檢測結果Fig.3 Result of polymorphism amplified by primer P-5

圖4 引物P-9多態性檢測結果Fig.4 Result of polymorphism amplified by primer P-9
2.2 OPRK1基因測序結果及同源性分析
將引物P-5所得EE、FF 2個基因型,引物P-9所得GG、HH兩個基因型的克隆產物直接進行正反測序。測序結果表明,P-5引物獲得序列與牛同源性達到97%,P-9引物與牛的同源性達到99%,因此可確定所獲基因序列為梅花鹿序列。通過測序圖比對發現引物P-5擴增片段在DNA序列72bp處發生G→A突變(圖5),引物P-9擴增產物在132bp處發生T→A的突變(圖6)。但氨基酸比較表明這兩處突變均為沉默突變。

圖5 OPRK1基因引物P-5擴增片段2個基因型序列比對Fig.5 The sequence alignment of two gene types amplified by primer P-5

圖6 OPRK1基因引物P-9擴增片段的基因型序列比對Fig.6 The sequence alignment of gene types amplified by primer P-9
2.3 OPRK1基因的遺傳學分析
在梅花鹿兩個群體中,對OPRK1引物P-5和P-9的基因頻率和基因型頻率進行檢測分析(表2),在OPRK1基因引物P-5擴增結果中檢測3種基因型,其中EE型基因型頻率最高,而EF和FF型基因型頻率相等,適合性χ2檢驗結果表明梅花鹿在該位點處于Hardy-Weinberg不平衡狀態(P<0.01)。在OPRK1基因引物P-9擴增結果中也檢測到3種基因型,其中純合子HH的基因型頻率最高,GG基因型頻率最低,適合性χ2檢驗結果表明,梅花鹿在該位點也處于Hardy-Weinberg不平衡狀態(P<0.01)。

表2 OPRK1基因各引物等位基因頻率和基因型頻率及Hardy-Weinberg平衡檢驗Table 2 Alleles and genotype frequency and equilibrium test of Hardy-Weinberg for OPRK1 gene
2.4 OPRK1基因多態性與行為性狀的關系
對OPRK1基因SNP位點基因型與梅花鹿各行為性狀進行最小二乘分析,P-5引物基因型對梅花鹿修飾行為有極顯著影響(P<0.01),對其余各行為無顯著影響。引物P-9各基因型對觀望行為有極顯著影響(P<0.01),對臥息和修飾行為有顯著影響(P<0.05),對其余行為性狀均無顯著影響。
進一步對不同基因型各行為性狀的最小二乘均值進行多重比較(表3)。引物P-5各基因型間修飾行為EE型、FF型和EF型之間兩兩差異顯著(P<0.05),其中FF型行為持續時間最長為15 min左右,EE型行為持續時間最短為3 min左右。在所觀測的7種行為性狀中,其它行為EE型和FF型差異顯著(P<0.05);而另外5種行為性狀在各個基因型中沒有檢測到顯著差異。引物P-9各基因型間臥息行為GG型比GH型個體行為持續時間平均高近90 min,且兩者之間差異顯著;觀望行為GG型、HH型和GH型3種基因型個體的行為持續時間依次升高,且GH型比GG型高4倍,3種基因型之間兩兩差異顯著(P<0.05),但GH和GG兩種基因型之間存在極顯著差異(P<0.01);修飾行為HH型比GG型和GH型個體行為持續時間都高4 min多,且HH型和另外兩者存在顯著差異(P<0.05)。

表3 OPRK1基因不同基因型在梅花鹿中各行為性狀比較(分鐘)Table 3 Comparison for behavior traits of each genotype of OPRK1 in sika deer(min)
3 討論
3.1 群體平衡的遺傳學分析
本研究中,在OPRK1基因引物P-5及P-9擴增結果中都檢測到3種基因型,且梅花鹿在這兩個位點均處于Hardy-Weinberg不平衡狀態。群體不平衡可能是由于基因的遺傳漂變或選擇、選配等因素所致[19]。遺傳漂變即在有限群體中由于取樣誤差造成了基因頻率的隨機波動,其產生因素有始祖效應、小群體效應及瓶頸效應。而群體育種規模較小,導致群內個體間不能隨機交配是目前養殖業普遍存在的現象,引種、雜交、分群、近交等都會引起基因遺傳漂變現象的發生。群體越小,等位基因頻率改變的幾率越大,低頻率基因向下漂變的可能性就越大[20]。本研究中樣本量較小,這是造成檢測群體處于不平衡狀態的重要原因。結論也可能說明兩地梅花鹿群體在飼養管理過程中該位點一直受到選擇的影響;同時分析可知,長期的群體內閉鎖繁育也可導致群體處于不平衡狀態。所以要保持現有梅花鹿群體基因頻率不變,保存現有基因資源,對梅花鹿群體選育時首先要考慮防止遺傳漂變現象的發生;同時要考慮選擇、選配對群體基因頻率的影響,結合當前行業發展趨勢及實際生產要求,在群體有足夠大規模時,進行雜交、近交及人工選配。
3.2 OPRK1基因多態性與行為性狀的關聯分析
對OPRK1基因引物P-5和P-9不同基因型各行為性狀的最小二乘均值進行多重比較可知,引物P-5各基因型間修飾行為差異顯著,在所觀測的7種行為性狀中,其它行為EE型和FF型差異顯著。P-9引物獲得基因型在兩地梅花鹿行為性狀分析中,臥息行為之間差異極顯著;觀望行為的3種基因型個體的行為持續時間依次升高,且3種基因型之間兩兩差異顯著(P<0.05);修飾行為也存在顯著差異(P<0.05)。李劍虹等曾利用SNP方法對大白、長白和杜洛克豬的Kappa阿片(OPRK1)受體進行分析,結果表明Kappa阿片受體基因SNP對母豬靜止站立行為性狀存在一定影響[3]。有研究報道Kappa阿片受體基因敲除的小鼠對激動劑的鎮痛作用消失,運動減少和煩躁不安的作用也顯著降低[21。Kappa阿片受體也參與腦內系統神經回路的活動,系統神經回路上的神經遞質(包括多巴胺和阿片肽)通過調節特定的靶神經元群的活動,從而作為一系列行為如學習、記憶、睡眠、攝食、飲水、性行為、攻擊等行為和情緒變化的物質基礎[22]。同樣在小鼠上已經發現了Kappa阿片受體基因的多態性[4]。本研究表明,OPRK1基因引物P-5也檢測到基因多態性,且不同基因型之間對梅花鹿的修飾行為產生一定作用,P-9位點擴增產物分析表明,其不同基因型對臥息、觀望行為也產生顯著影響。同樣以BDNF為目的基因對梅花鹿日常行為性狀進行研究的結果表明,不同基因型之間對梅花鹿的臥息及運動行為有顯著差異[23],因此,初步認為本研究結果和文中所述有相似之處。
動物行為是一個復雜的生物現象,其行為性狀是長期的自然選擇和人工選擇的產物,本研究選擇OPRK1作為影響梅花鹿行為性狀的候選基因,采用SNP方法分析該基因部分外顯子序列單核苷酸位點突變和行為性狀的關系,結論表明OPRK1基因可能和梅花鹿的臥息與觀望行為存在統計學意義,初步認為GG型可能和動物臥息行為相關,GH可能和動物的觀望行為有關。李劍虹等把豬長時間靜止站立確定為是一種動物“規癖行為”[3]。圈養條件下,動物長時間臥息或者站立觀望可以認為是動物的一種“規癖”或者“呆板”行為。有學者認為,規癖行為的出現是由于對生產性狀的過度選育而造成的[24-25],也有學者研究發現規癖是由于動物在圈養條件下,其生存環境單調狹小造成的[26]。Grandin在20世紀70年代沒有發現牛卷舌和其它異常行為,而在1996年發現Holstein品種表現為卷舌規癖,這可能是長期定向選擇的結果,對高產母豬(產仔數高)的研究也發現其表現較多的行為規癖[27]。對動物園動物研究表明,動物園中馴養的靈長類動物因飼養環境單調狹小帶來的緊張對其健康不利[28],導致動物出現無目的踱步、咬柵欄、搖擺身體、空嚼等呆板行為。有報道指出對小鼠進行應激刺激后可導致OPRK1基因的mRNA差異表達[29]。梅花鹿圈養與外界的干擾也是一種應激刺激,從而導致OPRK1基因外顯子表現多態性,并且這種多態性與觀望行為存在一定相關。另有研究表明,小鼠恐懼及焦慮行為同樣可影響Kappa阿片受體在腦杏仁核的表達狀況[30]。梅花鹿恐懼與焦慮的表現之一就是增加觀望時間,這種觀望行為的增加,也是其自身進化和環境適應相互作用的結果,表現在分子水平上,就有可能導致某些行為相關基因的突變,從而在OPRK1基因檢測獲得多態位點。
因此,在梅花鹿馴化飼養過程中,由于選擇選配或者飼養環境單調狹小或外界干擾刺激過多,可能增加其長時間站立觀望行為。在適應環境或干擾后又導致其臥息行為顯著升高,根據本研究對OPRK1基因不同基因型與行為性狀的相關分析結果,推測OPRK1基因可能在育種或者飼養過程中受到一定的選擇壓力,影響其行為規癖發育的傾向性,從而某種程度上可能形成“規癖”或者“呆板”行為。
[1] Robinson G E,Fernald R D,Clayton D F.Genes and social behavior.Science,2008,322(5903):896-900.
[2] Donaldson Z R,Young L J.Oxytocin,vasopressin,and the neurogenetics of sociality.Science,2008,322(2903):900-904.
[3] Li J H,Cui W G,Wang Y,Bao J.Single nucleotide polymorphism in exon partial sequence of sow kappa opioid receptor gene.Acta Genetica Sinica,2004,31(12):1369-1374.
[4] Saito M,Ehringer M A,Toth R,Oros M,Szakall I,Sikela J M,Vadasz C.Variants of K-opioid receptor gene and mRNA in alcohol-preferring and alcohol-avoiding mice.Alcohol,2003,29(1):39-49.
[5] Gilbert P E,Martin W R.The effects of morphine and nalorphine-like drugs in the nondependent,morphine-dependent and cyclazocine-dependent chronic spinal dog.The Journal of Pharmacology Experimental Therapeutics,1976,198(1):66-82.
[6] Evans C J,Keith D E Jr,Morrison H,Magendzo K,Edwards R H.Cloning of a delta opioid receptor by functional expression.Science,1992,258(5090):1952-1955.
[7] Meng A M,Liu J S.The progress on the opioid receptor function.Chinese Journal of Neuroimmunlolgy and Neurology,2002,9(3):180-182.
[8] Chen Y,Mestek A,Liu J,Hurley J A,Yu L.Molecular cloning and functional expression of a mu-opioid receptor from rat brain.Molecular Pharmacology,1993,44(1):8-12.
[9] Mansour A,Fox C A,Burke S,Meng F,Thompson R C,Akil H,Watson S J.Mu,delta,and kappa opioid receptor mRNA expression in the rat CNS:an in situ hybridization study.The Journal of Comparative Neurology,1994,350(3):412-438.
[10] Wittert G,Hope P,Pyle D.Tissue distribution of opioid receptor gene expression in the rat.Biochemical and Biophysical Research Communications,1996,218(3):877-881.
[11] Guo Y S,Zheng H Z.On the geological distribution,taxonomic status of species and evolutionary history of Sika Deer in China.Acta Theriologica Sinica,2000,20(3):168-179.
[12] Xu H F,Lu H J,Sheng H L,Gu C M.Status and current distribution of South China Sika Deer.Chinese Biodiversity,1998,6(2):87-91.
[13] Sheng H L,Cao K Q,Li W J.Cervus Nippon,the Deer in China.Shanghai:East China Normal University Press,1992:8-18.
[14] Liu H,Shi H Y,Hu J C.Daily activity rhythm and time budget of Sichuan Sika Deer(Cervus nippon sichuanicus)in spring.Acta Theriologica Sinica,2004,24(14):282-285.
[15] Guo Y S,Zheng H Z.Life table and the rate of natural increase in Sichuan Sika Deer.Acta Theriologica Sinica,2005,25(2):150-155.
[16] Lu X P,Wei F W,Li M,Yang G,Liu H.The relationship between Chinese Sika Deer(Cervus Nippon)genetic diversity and Japan deer.Chinese Science Bulletin,2006,51(3):292-298.
[17] Whittington C J,Chamove A S.Effects of visual cover on farmed red deer behaviour.Applied Animal Behaviour Science,1995,45(3/4):309-314.
[18] Lu S J,Todd P A,Yang Y,Liu Y Q,Fan H M,Wei W H.The effects of visitor density on Sika Deer(Cervus nippon)behaviour in Zhu-Yu-Wan Park,China.Animal Welfare,2010,19(1):61-65.
[19] Thévenon S,Thuy L T,Ly L V,Maudet F,Bonnet A,Jarne P,Maillard J C.Microsatellite analysis of genetic diversity of the vietnamese Sika deer(Cervus nippon pseudaxis).Journal of Heredity,2004,95(1):11-18.
[20] Tamate H B,Okada A,Minami M,Ohnishi N,Higuchi H,Takatsuki S.Genetic variations revealed by microsatellite markers in a small population of the Sika Deer(Cervus nippon)on Kinkazan Island,Northern Japan.Zoological Science,2000,17(1):47-53.
[21] Wang J N,Zhang D C.Research on the opioid receptor gene knock out mice.Chinese Clinical Neuroscience,2003,11(2):185-187.
[22] Zhang R M,Feng Z T,Zhang L Q.Clinical and Treatment of Opiates Such As Heroin Dependence.Taiyuan:Shanxi Science and Technology Press,1999:28-46.
[23] Lu S J,Yang Y,Wei W H.The association of BDNF gene polymorphisms with normal behavior traits in house-hold Sika Deer(Cervus nippon).Acta Ecologica Sinica,2011,31(17):4881-4888.
[24] Wright S.The relationship of livestock breeding to theories of evolution.Journal of Animal Science,1978,46(5):1192-1200.
[25] Belyaev D K.Destabilizing selection as a factor in domestication.Journal of Heredity,1998,70(5):301-308.
[26] Grandin T.Genetics and the Behavior of Domestic Animals.San Diego:Academy Press,1997:319-343.
[27] Von Borell E,Hurnik J F.The effect of haloperidol on the performance of stereotyped behavior in sows.Life Sciences,1991,49(4):309-314.
[28] Carlstead K,Shepherdson D.Effects of environmental enrichment on reproduction.Zoo Biology,1994,13(5):447-458.
[29] Lucas L R,Dragisic T,Duwaerts C C,Swiatkowski M,Suzuki H.Effects of recovery from immobilization stress on striatal preprodynorphin-and kappa opioid receptor-mRNA levels of the male rat.Physiology and Behavior,2011,104(5):972-980.
[30] Knoll A T,Muschamp J W,Sillivan S E,Ferguson D,Dietz D M,Meloni E G,Carroll F I,Nestler E J,Konradi C,Carlezon W A Jr.Kappa opioid receptor signaling in the basolateral amygdala regulates conditioned fear and anxiety in rats.Biological Psychiatry,2011,70(5):425-433.
參考文獻:
[3] 李劍虹,崔衛國,王宇,包軍.豬Kappa阿片受體基因外顯子部分序列單核苷酸多態性分析.遺傳學報,2004,31(12):1369-1374.
[7] 孟愛民,劉景生.阿片受體功能研究進展(綜述).中國神經免疫學和神經病學雜志,2002,9(3):180-182.
[11] 郭延蜀,鄭惠珍.中國梅花鹿地史分布、種和亞種的劃分及演化歷史.獸類學報,2000,20(3):168-179.
[12] 徐宏發,陸厚基,盛和林,顧長明.華南梅花鹿的分布和現狀.生物多樣性,1998,6(2):87-91.
[13] 盛和林,曹克清,李文軍.中國鹿類動物.上海:華東師范大學出版社,1992:8-18.
[14] 劉昊,石紅艷,胡錦矗.四川梅花鹿春季晝夜活動節律與時間分配.獸類學報,2004,24(14):282-285.
[15] 郭延蜀,鄭慧珍.四川梅花鹿生命表和種群增長率的研究.獸類學報,2005,25(2):150-155.
[16] 呂曉平,魏輔文,李明,楊光,劉海.中國梅花鹿(Cervus nippon)遺傳多樣性及與日本梅花鹿間的系統關系.科學通報,2006,51(3):292-298.
[21] 王佳楠,張德昌.阿片受體基因敲除小鼠的研究.中國臨床神經科學,2003,11(2):185-187.
[23] 呂慎金,楊燕,魏萬紅.圈養梅花鹿BDNF基因多態性與日常行為性狀的關聯分析.生態學報,2011,31(17):4881-4888.

