造紙系統中的微生物控制
羅靈芝 王建華 邱振權 王 斌
(1. 華南理工大學,廣東廣州,510640;2. 浙江永泰紙業集團股份有限公司,浙江杭州,311421;3. 納爾科(中國)環保技術服務有限公司,上海,200062)
為了解決纖維原料供需矛盾突出的問題,廢紙漿使用量逐年增加。據中國造紙協會調查資料,2011年全國紙漿消耗總量為9044 萬t,其中廢紙漿消耗總量為5660 萬t,占62%。與漂白化學漿相比,回收的廢紙漿中含有較多的微生物及微生物生長所需的營養物質。在封閉的白水循環系統中,這些微生物大量滋生,容易造成一系列問題[1-3],如形成腐漿引起斷紙,腐蝕設備,降低助劑使用效果,產生紙張斑點、破孔,嚴重影響紙機運行性能和成紙質量等問題。為了解決這些問題,除對系統進行定期清洗外,合理地使用防腐殺菌劑是解決造紙系統中微生物污染的重要途徑。但是,目前有關造紙用防腐殺菌劑的研究報道還較少,而紙機微生物控制又相當復雜,涉及微生物學、分析化學、制漿造紙工藝學等多個專業,是一門綜合性的科學。因此,系統、準確地分析造紙過程中微生物的狀況至關重要。
本文將從造紙系統中常見微生物種類和性質、微生物檢測方法、造紙系統微生物繁殖狀況、微生物控制需注意的問題等角度,探討了如何做才能更好地對造紙流程中微生物污染問題進行預防和控制,并列舉實例進行說明。
1 造紙系統中常見的微生物種類
微生物是分布最為廣泛的生命形式,幾乎分布到地球上的所有環境中。造紙系統為微生物生長提供了充分的食物,例如:纖維、淀粉等碳水化合物、硫酸鋁、高分子聚合物、膠乳、水分等。造紙流程中的微生物主要包括細菌(Bacteria)、真菌(Fungi)以及藻類(Algae)。
1.1 細菌
1.1.1 好氧菌(Aerobic Bacteria)造紙系統中的絕大部分微生物都為好氧菌。常見的有假單胞菌屬(Pseudomonas)、芽孢桿菌屬(Bacillus)、絲狀細菌(filamentous bacteria)、白硫菌屬(Beggiatoa)等。假單胞菌屬和芽孢桿菌屬經常與纖維、碳水化合物及填料交雜在一起,產生黏泥。
1.1.2 厭氧菌(Anaerobic Bacteria)
厭氧菌生長在無氧環境中,多活躍在造紙流程中攪拌效果不好的區域,如漿槽死角、管道拐角,并且會因過程能效低而產生揮發性脂肪酸,產生味道。厭氧菌很容易腐蝕設備,如硫酸根還原菌(Sulfate-Reducing Bacteria)可將硫酸根還原成硫化氫,產生味道的同時會引起腐蝕[2];梭菌屬(Clostridium)通過產生有機酸也會對造紙設備產生腐蝕。
1.1.3 兼性菌(Facultative Aerobes)
兼性菌既可生長在有氧的環境也可生長在無氧的環境,如腸桿菌屬 (Enterobacter)、大腸埃希氏菌(Escherichia coli)等。
上述大多數細菌在中性或微堿性條件下生長,特殊時候,一些細菌為了抵御惡劣的環境還會形成芽孢,這種芽孢是特定環境下形成的休眠體,可以對抗干燥、高溫、化學藥品等,當所處環境利于生長時,這些芽孢便會萌發生成細胞,是很難處理的一類微生物。
1.2 真菌
真菌喜歡生長在偏酸性環境中,在造紙系統中發現的真菌主要包括酵母菌和霉菌(常見的是曲霉和青霉)。酵母菌也能夠引起黏泥沉積,但一般較細菌產生的黏泥量少。霉菌則會產生菌絲,形成菌絲體,與填料、纖維等物質交織構成污染。
1.3 藻類
藻類一般隨清水進入造紙系統,通常生長在有陽光照射的區域,借助光合作用產生氧氣,為細菌生長提供豐富的有機營養源。若造紙系統中發現大量藻類,則說明清水處理程度不夠。
Blanco 等人對微生物生長的影響因素進行了歸納,如表1 所示[4]。
2 微生物檢測方法
2.1 浮游微生物檢測
已見報道的微生物檢測方法主要有稀釋平板計數法(Aerobic Plate Count,APC)、電阻抗法(Impedance method)、快速測試片法(Petrifilm)、三磷酸腺苷檢測法(Adenosine Triphosphate,ATP 法)、流式細胞術(Flow Cytometry,FCM)、固相細胞計數法(Solid Phase Cytometry,SPC)、微菌落技術(Bacterial Microcolony)、放射測量法(Radiometric)和多聚酶鏈式反應法 (Polymerase Chain Reaction,PCR)等。其測定方法及原理如下。

表1 微生物生長的影響因素
(1)平板計數法為國家標準測定法,需要將待測樣置于含有一定量培養液的平皿中,恒溫培養48 h,然后進行人工計數。
(2)電阻抗法依據細菌在生長繁殖過程中會產生一系列的代謝物質,這些代謝物質會引起培養基中的電惰性物質(如碳水化合物、蛋白質、類脂)轉化為電活性物質,從而導致液體培養基阻抗發生變化,通過測量培養基的阻抗變化,即可算出樣品中的細菌量。
(3)快速測試片法以紙片、紙膜等作為培養基載體,可以針對檢測的目標菌體的不同,在其中附著不同的顯色物質,經過一定時間的培養后,在紙片、紙膜上形成相應的特征菌落,人工計數即可。
(4)三磷酸腺苷檢測法的測定原理是基于蟲光素酶只有在ATP 存在時才會催化蟲熒光素產生熒光,并且在特定條件下其熒光強弱與ATP 濃度呈線性關系;而活菌體內都含有ATP,當細菌死亡后,ATP 也很快就會被分解掉,因此通過測定ATP 的濃度即可推算出活菌總數。
(5)流式細胞術利用流式細胞儀對處在快速、直線、流動狀態中的單細胞或生物顆粒進行多參數、快速定量分析,同時對特定群體加以分選。
(6)固相細胞計數法是將流式細胞儀和熒光顯微鏡技術結合使用。
(7)微菌落技術是將待測標本定量接種于醋酸纖維素薄膜上,放于恒溫箱中培養,染色后對標本區的微菌落作顯微鏡計數。
(8)放射測量法的檢測基于細菌在其生長繁殖的過程中,利用培養基中加14C 標記的底物代謝,產生14CO2,通過測量14CO2的含量就可以確定細菌數。
(9)多聚酶鏈式反應則是一種分子生物學技術,可看作是生物體外的特殊DNA 復制。
平板計數法計數準確,廣泛沿用至今,但耗時最長,操作較為繁瑣。電阻抗法的檢測時間和檢測結果準確度與細菌數有關,當細菌數大于104cfu/mL 時,測量時間較短,檢測結果較準確;而當細菌數小于102cfu/mL 時,檢測準確度下降。流式細胞術的最大優點是檢測范圍廣,最低檢出限低,能夠有效地區分死菌和活菌,并可以同時對其進行計數[5],然而該方法使用的試劑價格較高,因此該方法在國內很少使用。固相細胞計數法不需要前增菌過程,并且可以檢測的細菌種類也很廣泛,但也存在檢測費用高的問題。微菌落技術本身存在最低檢出限局限于103cfu/mL 以上的問題。而放射測量法需要利用專門的儀器來測定放射性,且需用加標14C 底物作培養基,操作難度增加。
相比而言,快速測試片法以其實用、較經濟等優點,越來越多地受到工廠和檢測部門的青睞。對于細菌總數的檢測來說,快速測試片法可將檢測時間由國家標準的48 h 縮短至24 h,同時在測試片中加入了顯色劑、增強了菌落的目視效果,而且避免了熱瓊脂法不適宜受損細菌恢復的缺陷。而ATP 熒光檢測法雖然其檢測試劑價格較貴,且發光反應會受到稀釋濃度等因素影響,但由于其儀器簡便,測定快捷,也常在工廠作為快速測試片法的輔助參考。Kiuru 等人就曾指出在造紙過程中也可采用ATP 法評估微生物活動[7]。
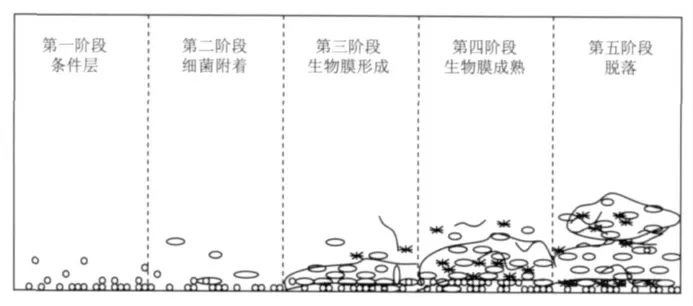
圖1 紙機設備表面生物膜形成過程
2.2 生物膜檢測
微生物在造紙過程中以兩種形式存在,一種是浮游狀態,一種是附著狀態。浮游狀態的微生物一般情況下不會對生產造成很大影響,但如果這些微生物附著到槽體管道或紙機其他設備上形成聚集體即生物膜,就會逐步引發生產問題,其形成過程可以分為五個階段(見圖1[8])。
第一階段:條件層。水系統中的有機物如聚糖類營養物質首先黏附到紙機設備表面,成為微生物繁殖的良好場所。第二階段:細菌附著。異養細菌附著到條件層上。第三階段:生物膜形成。附著到條件層表面的細菌在生長代謝過程中不斷產生胞外多糖,保護內部細菌的同時,成為進一步吸引其他細菌附著的營養物。第四階段:生物膜成熟。微生物大量繁殖,生物膜不斷增厚。第五階段:脫落。當生物膜厚度達到一定程度,生物膜內部的細胞由于缺少營養物質開始死亡,生物膜附著力開始下降,在一定的剪切力作用下,這些單個細胞或大的聚集體就逐步脫離紙機設備表面,進入到紙機水系統或紙張上,導致紙張產生斑點、孔洞等。
生物膜檢測與浮游細菌有所不同,原因之一在于生物膜中包含的細菌種類往往較多,檢測更難也更耗時。
凱米拉公司曾開發出Hedgehog 法對殺菌劑控制生物膜的優劣進行判定。該檢測是將平板膜置于紙機系統中進行1 天~14 天充分的污染,然后對殺菌劑作用前后生物膜的活性進行檢測,但耗時較長,不能對生產問題立刻進行決策。近年來,凱米拉又新開發出一種PiBa 法,可以對初始生物膜形成進行測定。
其他化學品公司也擁有各自的生物膜檢測方法。如赫克力士公司使用Decutec 法通過光散射對生物膜厚度、生長速度和密度進行檢測。納爾科公司采用OxiPRO 法對紙機上的沉積和生物膜的生長情況進行檢測。
事實上,對生物膜的生長進行檢測并控制固然重要,但在浮游微生物還沒有接觸紙機表面之前就將其殺死才是解決問題的根本。
3 造紙系統中的微生物繁殖狀況分析
在需要快速地解決工廠微生物污染問題時,通常采用顯微鏡定性分析和微生物快速測試片定量分析相結合的方法,適當配以一定的元素能譜檢測。
以某涂布紙板廠的問題涂布紙板為例,其涂布紙板表面人眼迎著光線觀察有零星的亞光斑點,排除涂料配方等問題后,懷疑為微生物污染。
首先,對涂布紙板表面進行顯微鏡觀察,400X顯微鏡下能觀測到大量的分叉真菌菌絲,這說明確實存在微生物污染。隨后對正常區域紙板和問題區域紙板分別進行能譜分析,結果也證明了這點。因為所有的有機體都需要能量來源以供存活及生長,如碳(C)、氮(N)、磷(P)等。表2 為涂布紙板表面不同區域的C 含量。而從表2 可以看到,與正常區域的C 質量分數79.93%相比,問題區域涂布紙板的C質量分數為69.59%,下降了近10 個百分點,這說明確實有微生物活動。將顯微鏡下的涂布紙板表面微生物形態與目前已被發現的微生物形態作比較,大致可確認為霉菌,而且很有可能是青霉和地霉。
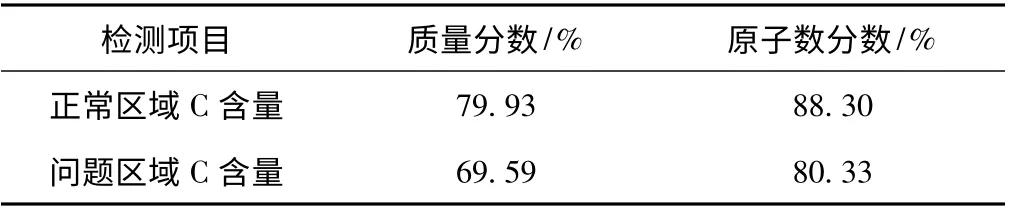
表2 涂布紙板表面不同區域的C 含量
選取培養霉菌的快速測試片對系統霉菌繁殖狀況進行分析。取樣點原則上為各個進入系統的源頭,如原料、水流、輔料等。按照生產流程,可以選擇:漿料卸料塔、紙機漿池、網下白水、填料、涂料、清水等。
由于該涂布紙板共4 層,亦即分為面層漿、襯層漿、芯層漿和底層漿;涂層為3 層,包括面涂、預涂和底涂;面層漿料由木漿和白紙邊組成;襯層漿料為100%脫墨漿 (DIP);芯層漿料由混合辦公廢紙(MOW)和損紙組成;底層漿料為100%白紙邊。因而取樣點分別為:卸料塔出口的木漿、白紙邊、DIP、MOW、損紙;紙機漿池的面漿、襯漿、芯漿、底漿;網下白水的面白水、襯白水、芯白水、底白水;輔料槽的噴淋淀粉、膠乳、表膠、碳酸鈣;涂料槽的面涂料、預涂料、底涂料;清水。以霉菌測試片培養后,測定結果見圖2。
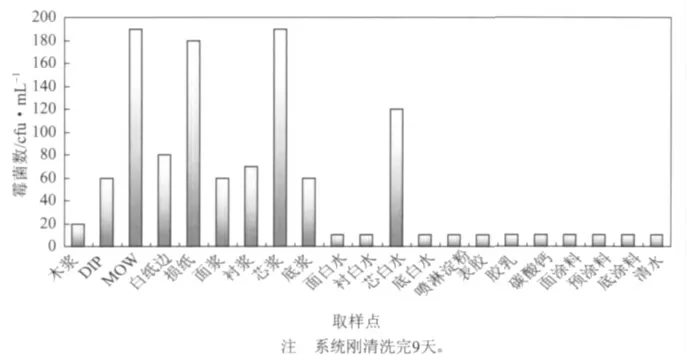
圖2 紙機系統中霉菌繁殖狀況
從圖2 中不難發現,MOW 和損紙中的霉菌數明顯偏高,而由這兩個原料組成的芯層漿料也因而霉菌數很高(另外,實驗中還以細菌快速測試片對各取樣點細菌數進行了分析,MOW 和損紙漿料中細菌數量級也均達到108cfu/mL 以上)。由此也得出了問題的源頭所在。這說明,紙機原料中本身的微生物尤其是混合辦公廢紙和損紙漿中微生物沒有控制好,后面雖然會經過烘缸高于100℃的高溫,但是霉菌變成了休眠體-霉菌孢子存活了下來,在適宜的環境下,儲存一段時間,孢子就會發芽生長,導致紙面亞光斑的出現。
另外,亞光斑主要出現在高定量紙板上這一現象也從另一角度上佐證了上述結論,因為在生產高定量紙板的時候,主要增加的是芯層漿料比例。
因此,加強源頭混合辦公廢紙及損紙的管理、選擇合適的防霉殺菌劑對這些廢紙漿的微生物進行監控是解決該問題的重要途徑。
4 微生物控制需注意的問題
(1)并非所有的泥狀沉積和紙張表面斑點都源于微生物污染。需要結合實際生產工藝條件是否發生變化,如硫酸鋁或CPAM 是否過量添加、系統pH 值是否波動幅度過大等,以及通過適當地改變殺菌劑用量配以一定的物理化學分析來進行判斷。簡單地講,若加入殺菌劑或提高殺菌劑用量,沉積或斑點就消失,則說明微生物污染很有可能是導致這些問題的主要原因,否則需考慮其他因素。
(2)當系統內回用白水細菌數達到107cfu/mL 時,說明在系統內已產生了腐漿及黏著物[9],需要考慮使用殺菌劑。在殺菌劑的選擇上,除根據實際需要如系統霉菌含量過高要考慮使用防霉類殺菌劑外,一般優先選擇廣譜類殺菌劑,并且應用時還需考慮系統中加入的其他助劑種類、特點,考慮匹配性問題,某紙板廠就曾發生過施膠淀粉與防腐殺菌劑不適合引發結塊導致施膠障礙的問題。殺菌劑原則上添加在微生物滋生的各個源頭;而添加方式上,輔料配料等槽體中宜連續添加,而濕部造紙系統宜間歇添加。殺菌劑用量需適宜,用量過低起不到應有的效果,用量過高則會導致成本增加并且可能與過程中其他化學品相互作用[10]。
(3)高端紙制品造紙系統中好氧菌數不應超過104cfu/mL,低端紙制品造紙系統中也不應超過108cfu/mL。建議絕大多數紙廠白水中菌數量級控制在106cfu/mL 以下,冷卻水中控制在104cfu/mL 以內[11]。另外,清水處理也很關鍵。盡管處理后的清水中好氧菌數比造紙系統中的低得多,但有報道指出,若清水處理不好,好氧菌數只達到102cfu/mL,也會給紙機帶來微生物污染問題[12]。
(4)定期清洗紙機系統可明顯減少微生物污染問題。
5 結 語
由于微生物生長的復雜性及造紙生產工藝的多樣性,只有首先根據各類微生物適宜生長的環境、微生物形態等定性地對其進行判斷,然后再根據現場工藝條件和微生物數量狀況,制定相應的殺菌劑應用方案,才能較好地解決微生物污染問題。更前瞻性地來講,對菌種及菌數進行簡單檢測后應用殺菌方案可以很快解決一時的污染問題,但做不到一勞永逸。由于造紙是一個動態的過程,在制定好基礎的應用方案后,應借鑒助留劑的成功經驗,考慮對殺菌劑實行在線連鎖控制,實時監控微生物繁殖狀況,做到防患于未然。
[1] HUANG Qi-ran,YANG Wei-he,QIU Mei-jian,et al. Application of Polyhexam Ethylene Guanidine Hydrochloride in Paper Industry[J].China Pulp & Paper,2011,30(6):32.黃奇然,楊偉和,邱美堅,等. 聚六亞甲基鹽酸胍在造紙工業中的應用[J]. 中國造紙,2011,30(6):32.
[2] Blanco M A,Negro C,Gaspar I,et al. Slime problems in the paper and board industry[J]. Applied Microbiology and Biotechnology,1996,46(3):203.
[3] ZHUO Wen-yu. The application of bactericide in papermaking[J].Paper Science & Technology,2011,30(4):64.卓文玉. 造紙殺菌劑的應用[J]. 造紙科學與技術,2011,30(4):64.
[4] Blanco M A,Negro C,Gaspar I,et al. COST E1 Paper recycling:An introduction to problems and their solutions[M]. Luxembourg:Office of official publications of the European communities,1997.
[5] Thusitha S G,Paul V A,Duncan A V,et al. A flow cytometry method for rapid detection and enumeration of total bacteria in milk[J].Applied and Environmental Microbiology,2000,66(3):1228.
[6] Melvin P,Weinstein S M,Barth Reller L. Comparative evaluation of oxoid signal and bactec radiometric blood culture systems for the detection of bacteremia and fungemia[J]. Journal of Clinical Microbiology,1988,26(5):962.
[7] Kiuru J,Tukiainen P,Tsitko I,et al. Management of broke handling[C]//Proceedings of zellcheming annual meeting,Wiesbaden,Germany,2008.
[8] Schenker A P,Singleton F L,Davis C K. Non biocidal programmes for biofilm control in papermachine circuits[C]. Proceedings of Eucepa symposium,chemistry in papermaking,Florence,Italy,1998.
[9] TANG Jiang-tao,CHEN Jian,YANG Mei,et al. A new biocide for microbiological control in papermaking process[J]. Guangxi Journal of Light Industry,2008(3):28.唐江濤,陳 健,楊 梅,等. 新殺菌劑對造紙過程微生物的控制[J]. 廣西輕工業,2008(3):28.
[10] Casini G. A novel bromine oxidizing technology for microbiological control[J]. Paperi ja puu-paper and timber,2003,85(7):394.
[11] Ludensky M. Control and monitoring of biofilms in industrial applications[J]. International Biodeterioration & Biodegradation,2003,51(4),255.
[12] YANG Ren-dang,CHEN Ke-fu,CHEN Xue-zhi,et al. Biocides:Solve the Microbial Contaminant Problems in Papermaking Process[J]. China Pulp & Paper. 2002,21(2):49.楊仁黨,陳克復,陳學志,等. 應用殺菌劑解決造紙過程中的微生物污染[J]. 中國造紙,2002,21(2):49.

