火雞肌肉丙氨酰氨肽酶的酶學特性
田 甜,魏延玲,何立超,阮貴萍,張迎陽,章建浩*
(國家肉品質量安全控制工程技術研究中心,教育部肉品加工與質量控制重點實驗室,農業部農畜產品加工與質量控制重點開放實驗室,南京農業大學食品科技學院,江蘇 南京 210095)
氨肽酶廣泛存在于動物、植物和微生物體內,發揮著從蛋白質或多肽鏈的N末端切割酰胺鍵逐一釋放氨基酸的作用。氨肽酶在火腿的加工過程中水解寡肽(特別是三肽和四肽)釋放游離氨基酸,游離氨基酸再通過Strecker降解和美拉德反應產生小分子化合物,形成產品的特征風味[1]。丙氨酰氨肽酶(AAP)廣泛存在于各類動物骨骼肌中,其底物范圍廣,特別是水解苯丙氨酸、賴氨酸、甲硫氨酸、丙氨酸和亮氨酸形成的酰胺鍵,由于水解丙氨酸的速率最快,故稱為丙氨酰氨肽酶[2]。
火雞原產于墨西哥,是世界上最大的肉用禽類;與肉雞相比,火雞的肉質鮮嫩可口,蛋白質含量高,脂肪和膽固醇含量低,并富含豐富的B族維生素和VE,被美國營養學家推崇為“超級營養食物”[3]。目前,我國火雞產業處于“易產難銷”的狀態,市面上的火雞產品種類少、價格高,不利于消費;但隨著人民生活水平的提高、健康飲食的不斷關注以及食品種類多元化的發展,火雞可能將成為人們餐桌上優質的肉源性食物的首選。國際上對于火雞的研究多集中在火雞加工[4]、火雞鮮肉及產品的保鮮[5-6]、脂質氧化及抗氧化[7-9]、膽固醇氧化[10]及類PSE肉[11-12]等方面,而火雞肌肉蛋白質水解及相關蛋白酶的酶學特性及作用機理還缺乏系統研究。本文以火雞肌肉為原料,研究其中的重要氨肽酶AAP酶學特性及其鹽分和水解產物等對其酶活力的影響,探索AAP等氨肽酶在火雞加工過程中對蛋白質水解及風味品質形成的作用機理,為調控及提高產品風味品質提供理論依據。
1 材料與方法
1.1 材料與試劑
冷凍火雞下腿60只由南京雨潤集團提供,使用前于4~10℃條件下自然解凍。
丙氨酸-7-氨基-4-甲基香豆素(Ala-AMC)、7-氨基-4-甲基香豆素(AMC) 瑞士Bachem公司;β-巰基乙醇(BC級) 美國Amresco公司;丙氨酸、亮氨酸、賴氨酸、甲硫氨酸、苯丙氨酸(BR級) 上海楷洋生物技術公司;其他試劑均為分析純。
1.2 儀器與設備
M2e多功能酶標儀 美國MD公司;96孔黑色酶標板 美國Costar公司;722s可見分光光度計 上海精密儀器有限公司;TGL 20M-Ⅱ冷凍高速離心機 湖南省凱達實業發展有限公司;T25 digital高速分散機 德國IKA集團。
1.3 方法
1.3.1 丙氨酰氨肽酶活力測定
1.3.1.1 酶的提取
丙氨酰氨肽酶的提取參考Toldrá[13]、Rosell[14]等的方法,并進行了適當的修改。具體方法如下:剔除火雞樣品中可見的脂肪和結締組織,剁碎后準確稱取10g左右(精確到0.001g),加入50mL酶提取緩沖液(50mmol/L PBS緩沖液,pH7.5,含5mmol/L EDTA),在冰浴條件下用高速分散機勻漿3次(15000~17000r/min,每次10s,間隔20s),10000×g離心20min,上清液經4層紗布過濾即得粗酶液。粗酶液再經質量分數為45%~65%的硫酸銨進行分級分離,沉淀用最少量的蒸餾水溶解后用蒸餾水透析。
1.3.1.2 酶活力測定
丙氨酰氨肽酶活力的測定參考Toldrá等[15]的方法,并進行了適當的修改。具體方法如下:酶反應緩沖液為50mmol/L的Tris-HCl(pH7.5)含體積分數0.1% β-巰基乙醇(記為緩沖液A),向270μL緩沖液A中加入30μL酶液,37℃條件下預熱10~20min,加入3μL 25mmol/L熒光底物Ala-AMC反應20min后立刻加入600μL無水乙醇終止反應。產生的熒光強度用多功能酶標儀于激發波長(λex)380nm、發射波長(λem)440nm處測定。對照組在加入底物后立刻加入600μL無水乙醇終止反應。
酶活力(U)單位定義為:每小時釋放1μmol AMC所需的酶量。相對酶活力為:各處理組的酶活力相對于最高酶活力的百分比(最高酶活力記為100%)。
1.3.1.3 AMC標準曲線的繪制
用無水乙醇溶解AMC,配制5mmol/L的AMC標準液。取21支試管分7組(每組3支平行樣)編號。向7組試管中分別加入0、5、10、15、20、25、30μL的AMC標準液,再加入緩沖液A至試管中溶液體積為300μL。混勻后放入37℃水浴中保溫20min后加入600μL無水乙醇。產生的熒光強度用多功能酶標儀于λex為380nm、λem為440nm處測定。對照AMC標準曲線計算酶反應產生的AMC濃度,進而計算酶活力。
1.3.2 蛋白質含量的測定
采用考馬斯亮藍G-250比色法[16]。
1.3.3 最適溫度的測定
在反應體系不變的情況下,分別在0、6、25、40、50、60、70、80℃條件下恒溫反應20min,然后測定各組酶活力。
1.3.4 最適pH值的測定
在其他測定條件不變的情況下,酶反應最適pH值的測定分別在以下緩沖液(濃度均為50mmol/L)中進行:醋酸-醋酸鈉緩沖液(pH3.0~5.0)、磷酸緩沖液(pH5.5~7.0)、Tris-HCl緩沖液(pH7.5~10.0)。
1.3.5 NaCl濃度對AAP活力影響的測定
向緩沖液A中加入NaCl至終濃度為800mmol/L,將其進行稀釋,配制NaCl濃度梯度為200~800mmol/L的緩沖液作為酶反應液。在其他條件不變的情況下,測定不同NaCl濃度對AAP活力的影響。
1.3.6 不同氨基酸對酶活力影響的測定
參考Toldrá等[15]的方法,用緩沖液A分別配制濃度為100mmol/L的丙氨酸、亮氨酸、賴氨酸、甲硫氨酸和苯丙氨酸溶液,調節pH值至7.5。然后用緩沖液A將各氨基酸溶液濃度稀釋到6.2、12.5、25.0、50.0mmol/L。在其他條件不變的情況下,測定酶活力。
1.3.7 數據分析
利用SPSS 17.0進行回歸分析,擬合出各游離氨基酸對酶活力的作用曲線,得回歸方程;利用SAS軟件進行方差分析,分析NaCl濃度對AAP影響的差異性(P<0.05)。
2 結果與分析
2.1 火雞腿肉中AAP的純化結果
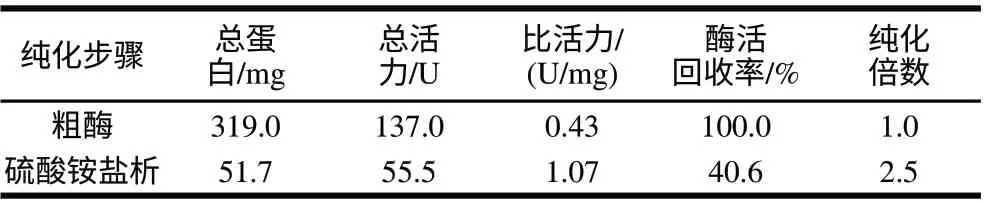
表 1 火雞腿肉中AAP的純化結果Table 1 Purification of AAP from turkey leg muscle
由表1可知,經過45%~65%的硫酸銨鹽析后,酶的總蛋白和總活力均降低,而比活力和酶的純度均提高了1.5倍,酶活回收率為40.6%。火雞腿肉中AAP酶總活力137.0U,略低于Toldrá等[13]報道的豬腿肉中的AAP酶總活力,這可能與AAP的來源及酶反應緩沖體系的不同有關。
2.2 溫度對AAP活力的影響
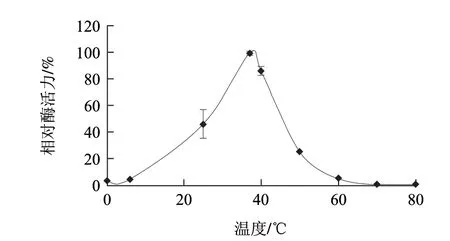
圖 1 溫度對AAP相對酶活力的影響Fig.1 Effect of temperature on AAP activity
如圖1所示,AAP相對酶活力隨著溫度的升高呈現先升高后降低的變化趨勢;AAP相對酶活力在37~39℃之間達到最大值;當溫度低于6℃或高于60℃時,AAP幾乎沒有活力。說明當酶反應溫度控制在37~39℃之間時,酶處于最適反應條件能最大地釋放酶活。牛肉中AAP的最適溫度為37℃,但在低溫條件下(6℃以下)仍能保持較高的活力[17];不同部位的氨肽酶的最適溫度不同,雞腸道氨肽酶[18]的最適溫度在40~50℃之間,高于火雞肌肉中氨肽酶的最適溫度,這可能與腸道溫度比肌肉溫度高有關,而氨肽酶的最適溫度可能接近于所處環境的溫度。
2.3 pH值對AAP活力的影響
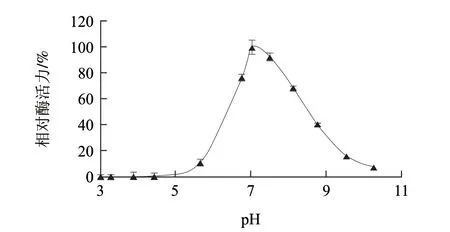
圖 2 pH值對AAP相對酶活力的影響Fig.2 Effect of pH on AAP activity
如圖2所示,AAP相對酶活力隨著pH值的升高呈現先升高后降低的變化趨勢;AAP相對酶活力在pH6.8~7.5之間達到最大值;當pH值小于5.0或大于10.3時,AAP幾乎沒有活力。這一結果驗證了AAP是一種中性氨肽酶。不同來源的AAP的最適pH值不同,Nishimura等[19]從雞肉中提取的AAP卻表現出弱酸性的最適pH值為6.5左右,Ye Xiujuan等[17]從牛肉中提取的AAP表現出弱堿性的最適pH值為8.0左右。
2.4 NaCl濃度對AAP活力的影響
如圖3所示,鹽分對丙氨酰氨肽酶活力有一定的抑制作用,但抑制作用較弱。NaCl濃度低于200mmol/L時,它對AAP的抑制作用不顯著(P>0.05);鹽濃度在200~400mmol/L之間時,隨著鹽濃度增加,AAP相對酶活力顯著降低;隨著鹽濃度繼續增加,AAP相對酶活力變化不顯著(P>0.05),800mmol/L的NaCl可以抑制10%的AAP相對酶活力。NaCl對豬骨骼肌中的丙氨酰氨肽酶同樣具有抑制作用,且隨著NaCl濃度的增加,酶活力逐漸降低,但NaCl的抑制作用較強,800mmol/L的NaCl使相對酶活力降低了近60%[20]。這可能與酶反應體系的差別有關,包括緩沖液、pH值及底物濃度。

圖 3 NaCl對AAP相對酶活力的影響Fig.3 Effect of NaCl on AAP activity
2.5 蛋白質水解產物氨基酸對AAP活力的抑制作用
以氨基酸濃度為橫坐標,AAP的相對酶活力為縱坐標,將賴氨酸(Lys)、甲硫氨酸(Met)和亮氨酸(Leu)對AAP活力的影響進行回歸分析。將AAP相對酶活力抑制率為50%時各種游離氨基酸的濃度記為IC50,用于比較各游離氨基酸對AAP活力抑制作用的強弱。
2.5.1 Lys對AAP活力的影響
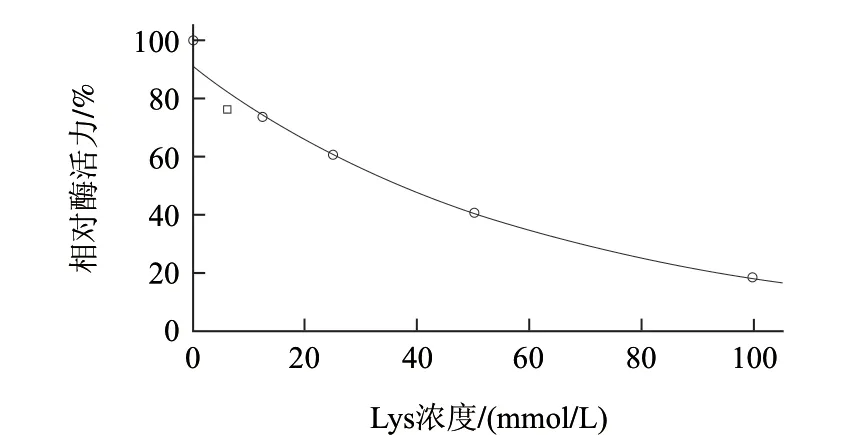
圖 4 賴氨酸對AAP相對酶活力的作用曲線Fig.4 Function curve of AAP activity by lysine
如圖4所示,Lys對AAP相對酶活力的影響的回歸方程為y = e4.511―0.016x,該回歸模型顯著(P<0.01),擬合度較高(R2=0.99)。AAP相對酶活力隨著Lys濃度的增加呈下降趨勢,Lys濃度每增加10mmol/L,AAP相對酶活力降低約15%;當Lys濃度為100mmol/L時,AAP僅有18.4%的殘余相對酶活力;Lys對AAP相對酶活力的IC50為37.4mmol/L。
2.5.2 Met對AAP活力的影響
如圖5所示,Met對AAP相對酶活力影響的回歸方程為y = e4.634―0.008x。此回歸模型顯著(P<0.01),擬合度較高(R2=0.98)。AAP相對酶活力隨著Met濃度的增加呈下降趨勢,Met濃度每增加10mmol/L,AAP相對酶活力降低約7%,Met對AAP相對酶活力的抑制作用比Lys的抑制作用弱;Met對AAP相對酶活力的IC50為90.2mmol/L。

圖5 甲硫氨酸對AAP相對酶活力的作用曲線Fig.5 Function curve of AAP activity by methionine
2.5.3 Leu對AAP活力的影響

圖 6 亮氨酸對AAP活力的作用曲線Fig.6 Function curve of AAP activity by leucine
如圖6所示,Leu對AAP相對酶活力影響的回歸方程為y = e4.560―0.011x。回歸模型顯著(P<0.01),擬合度較高(R2=0.98)。由方程可知AAP相對酶活力隨著Leu濃度的增加呈下降趨勢,Leu濃度每增加10mmol/L,AAP相對酶活力降低約11%,由此可見,Leu對AAP相對酶活力的抑制作用強弱介于Met和Lys之間;當AAP相對酶活力抑制率為50%時,Leu濃度為58.9mmol/L。
2.5.4 苯丙氨酸(Phe)對AAP活力的影響
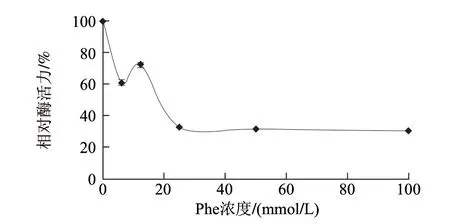
圖 7 苯丙氨酸對AAP活力的作用曲線Fig.7 Function curve of AAP activity by phenylalanine
由圖7可知,Phe對AAP相對酶活力抑制作用較強,Phe濃度在0~25mmol/L之間時,隨著其濃度的增加AAP相對酶活力波動下降;Phe濃度達到25mmol/L時,AAP相對酶活力降低了67%;而當Phe濃度大于25mmol/L時,AAP相對酶活力變化不顯著;當AAP相對酶活力為50%時,Phe濃度小于20mmol/L。
2.5.5 Ala對AAP活力的影響
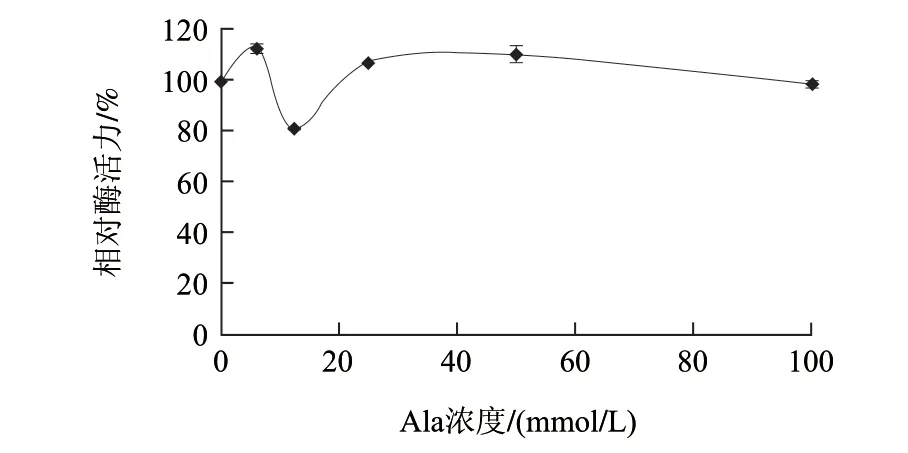
圖 8 丙氨酸對AAP活力的作用曲線Fig.8 Function curve of AAP activity by alanine
由圖8可知,Ala對AAP幾乎沒有抑制作用;當Ala濃度為100mmol/L時,AAP仍有98.7%的相對酶活力;IC50大于100mmol/L。
綜上所述,AAP活力被產物氨基酸廣泛抑制,AAP優先水解寡肽的N端丙氨酸,而丙氨酸的抑制作用反而最弱,這與Toldrá等[15]研究結果一致。IC50值越小,表明該氨基酸對AAP的抑制作用越強。由各氨基酸對AAP活力的IC50值可以看出:苯丙氨酸對AAP活力的抑制作用最強,其次是賴氨酸、亮氨酸和甲硫氨酸。Toldrá等[14]研究了游離氨基酸對豬和人骨骼肌中AAP抑制作用發現,2種來源的AAP都被游離氨基酸廣泛抑制,且起抑制作用的氨基酸范圍大致相同。起抑制作用的氨基酸均為疏水性氨基酸且支鏈氨基酸的作用更強。各產物氨基酸對人骨骼肌中AAP的抑制強弱為Leu>Phe>Met>Lys>Ala,而對豬骨骼肌中AAP的抑制強弱為Phe>Leu>Lys>Met>Ala。對比發現,Ala都是最弱的抑制劑,各產物氨基酸對火雞肉與豬肉中的AAP的抑制強弱順序更接近,這可能與不同來源的AAP的基因組成有關。游離氨基酸對調控細胞內蛋白質轉換(蛋白質降解與合成的動態平衡)的過程具有重要作用,氨肽酶水降解寡肽產生游離氨基酸,游離氨基酸反過來又能抑制氨肽酶的降解作用,這種反饋抑制機制或許是操控整個蛋白質轉換過程的潛在點。
3 結 論
丙氨酰氨肽酶是火雞肉中一種重要的蛋白質水解酶,溫度和pH值均能顯著影響AAP活力,37~39℃、pH6.8~7.5時AAP活力最高,而鹽分對AAP活力只有較弱的抑制作用;AAP的產物氨基酸可抑制其水解活性,但主要產物Ala對其抑制作用最弱,這種反饋機制通過氨基酸的積累會自動抑制AAP活力。因此,通過調節火雞加工過程中的溫度、pH值,降低鹽分可提高AAP活力,增加火雞肉中蛋白質的水解程度,提高產品的風味品質。
[1] FLORES M, ARISTOY M C, TOLDRá F. Hydrolysis of alanine oligopeptides by porcine muscle alanyl aminopeptidase[J]. Zeitschrift Fur Lebensmittel-Untersuchung Und-Forschung A, 1999, 208: 264-266.
[2] 趙改名. 肌肉蛋白水解酶在金華火腿加工過程中作用的研究[D]. 南京: 南京農業大學, 2004.
[3] 黃蓉, 劉敦華. 火雞產業發展狀況[J]. 肉類研究, 2010, 24(1): 3-4.
[4] SAMMEL L M, CLAUS J R, GREASER M L, et al. Investigation of mechanisms by which sodium citrate reduce the pink color defect in cooked ground turkey[J]. Meat Science, 2006, 72: 585-595.
[5] LEE E J, AHN D U. Quality characteristics of irradiated turkey breast rolls formulated with plum extract[J]. Meat Science, 2005, 71: 300-305.
[6] ZHU M J, LEE E J, MENDONCA A, et al. Effect of irradiation on the quality of turkey ham during storage[J]. Meat Science, 2003, 66: 63-68.
[7] TANG X Y, CRONIN D A. The effects of brined onion extracts on lipid oxidation and sensory quality in refrigerated cooked turkey breast rolls during storage[J]. Food Chemistry, 2007, 100: 712-718.
[8] MIELNIK M B, SEM S, EGELANDSDAL B, et al. By-products from herbs essential oil production as ingredient in marinade for turkey thighs[J]. LWT-Food Science and Technology, 2008, 41: 93-100.
[9] WANG J M, JIN G F, ZHANG W G, et al. Effect of curing salt content on lipid oxidation and volatile flavour compounds of dry-cured turkey ham[J]. LWT-Food Science and Technology, 2012, 48: 102-106.
[10] BAGGIO S R, MIGUEL A M R, BRAGAGNOLO N. Simultaneous determination of cholesterol oxides, cholesterol and fatty acids in processed turkey meat products[J]. Food Chemistry, 2005, 89: 475-484.
[11] RAMMOUZ R E, BABILé R, FERNANDEZ X. Effect of ultimate pH on the physicochemical and biochemical characteristics of turkey breast muscle showing normal rate of postmortem pH fall[J]. Poultry Science, 2004, 83: 1750-1757.
[12] CHAN J T Y, OMANA D A, BETTI M. Effect of ultimate pH and freezing on the biochemical properties of proteins in turkey breast meat[J]. Food Chemistry, 2011, 127(1): 109-117.
[13] TOLDRá F, ARISTOY M C, FLORES M. Contribution of muscle aminopeptidases to flavor development in dry-cured ham[J]. Food Research International, 2000, 33: 181-185.
[14] ROSELL C M, TOLDRá F. Comparison of muscle proteolytic and lipolytic enzyme levels in raw hams from Iberian and white pigs[J]. Journal of the Science of Food and Agriculture, 1998, 76: 117-122.
[15] TOLDRá F, FALKOUS G, FLORES M, et al. Comparison of aminopeptidase inhibition by amino acids in human and porcine skeletal muscle tissues in vitro[J]. Comparative Biochemistry and Physiology A: Molecular & Integrative Physiology, 1996, 115(4): 445-450.
[16] 胡瓊英, 狄洌. 生物化學實驗[M]. 北京: 化學工業出版社, 2007.
[17] YE Xiujuan, NG T B. Purification and characterisation of an alanine aminopeptidase from bovine skeletal muscle[J]. Food Chemistry, 2011, 124: 634-639.
[18] JAMADAR V K, JAMADAR S N, DANDEKAR S P, et al. Purification and characterization of aminopeptidase from chicken intestine[J]. Journal of Food Science, 2003, 68(2): 438-443.
[19] NISHIMURA T, KATO Y, OKITANI A, et al. Purification and properties of aminopeptidase C from chicken skeletal muscle[J]. Agricultural and Biological Chemistry, 1991, 55(7): 1771-1778.
[20] ARMENTEROS M, ARISTOY M C, TOLDRá F. Effect of sodium, potassium, calcium and magnesium chloride salts on porcine muscle proteases[J]. European Food Research & Technology, 2009, 229(1): 93-98.

