房顫患者血清HMGB1 水平和氧化應激的關系
吳超武,江 洪
(1.崇陽縣天城鎮衛生院,湖北 崇陽 437500;2.武漢大學人民醫院心內科)
房顫(AF)是臨床中最常見的持續性心律失常,其患病率與年齡關系密切,年齡小于65 歲者約占1%、而65 歲以上者約占5%[1]。AF 發生的病理生理機制仍不清楚,最近研究表明,炎癥和氧化應激參與了AF 的發展[2,3]。
高遷移率族蛋白1(HMGB1)是一種非染色體核蛋白質,由壞死細胞和凋亡細胞被動釋放、激活的非特異性免疫細胞(如巨噬細胞和單核細胞)主動釋放。HMGB1 作為一種新型的促炎細胞因子,常見于包括AF 的多種心血管疾病[4,5]。Salman等[6]研究表明,在敗血癥的危重患者中,陣發性AF 的發病率很高,這表明HMGB1 可能促進膿毒癥患者陣發性AF 的發生。Hu 等[7]報道,陣發性和持續性AF 患者血清HMGB1 水平均明顯升高。越來越多的證據表明,HMGB1 可能和AF 的發生相關[8]。在本研究中,我們探討了AF 患者HMGB1 和氧化應激的關系。
1 資料與方法
1.1 研究對象
該臨床研究方案經本醫療機構倫理委員會批準,并根據赫爾辛基宣言的道德準則進行。從武漢大學人民醫院選取86例AF 患者。AF 發作若可自行終止且持續時間少于7d,則為陣發性AF;持續時間超過7d 則為持續性AF,其中包括永久性AF。86例AF 中,陣發性AF53例,持續性AF33例。另外入選30例年齡和性別匹配的正常人作為對照組。3組基本資料和用藥情況見表1和表2,所有研究對象需采集詳細的病史、體格檢查、常規生化檢測、12 導聯心電圖等。排除標準如下:有結構性心臟疾病、冠心病、左室射血分數低于45%、其他類型的心律失常、6 個月內手術或中風、感染史、慢性炎癥、肝臟疾病、惡性腫瘤、慢性腎功能衰竭、自身免疫性疾病、甲狀腺功能異常、電解質紊亂、使用如皮質激素、非甾體抗炎藥等抗炎藥物(阿司匹林除外)者。
1.2 心臟彩超檢測
應用多普勒心臟超聲檢測瓣膜功能,測定左室舒張末期直徑(LVEDD)和左房直徑(LAD)及左室射血分數(LVEF)。
1.3 樣品采集和生化檢測
早晨空腹12h 后抽取外周靜脈血液。血清樣品分裝并儲存在-70℃冰箱至被檢測。所有樣品解凍一次。Hitachi 912 分析儀按標準實驗室技術測量血清hs-CRP 水平。ELISA 試劑盒(日本東京Shino Test 公司)測定血清HMGB1 水平。試劑盒(南京建成生物工程研究所)檢測心肌組織中MDA 含量和SOD 活性,分別作為心肌組織中氧自由基和脂質過氧化物水平指標。
1.4 統計分析
數據采用SPSS17.0 軟件包進行分析。數據以均數± 標準差或百分比表示。卡方檢驗或Fisher 精確檢驗被用來比較率。單因素方差分析或Welch 檢驗用于比較組間和SNK-q 檢驗或Dunnett-t 檢驗用于多組間兩兩比較。Pearson 相關系數來評估血清HMGB1 濃度和其它參數之間的關系。多因素logistic 回歸分析來評估CAD 與2 型糖尿病的風險因素。統計學顯著性定義為P<0.05。
2 結果
2.1 一般資料比較
如表1 所示,3組在性別百分比、吸煙、飲酒、高脂血癥、高血壓、糖尿病和介入(除地高辛可用于控制心室率)、年齡、體重指數(BMI)、左室舒張末期內徑與射血分數間無顯著性差異。持續性AF組LAD 明顯大于對照組和陣發性AF組(P <0.05)。陣發性AF組LAD 大于對照組,但無統計學意義(P >0.05)。持續性AF組HMGB1、hs-CRP 水平和MDA組含量均高于對照組和陣發性AF組(P <0.05)。然而,持續性AF組SOD 含量明顯低于對照組和陣發性AF組(P <0.05),陣發性AF組SOD 含量明顯低于對照組(P <0.05)。
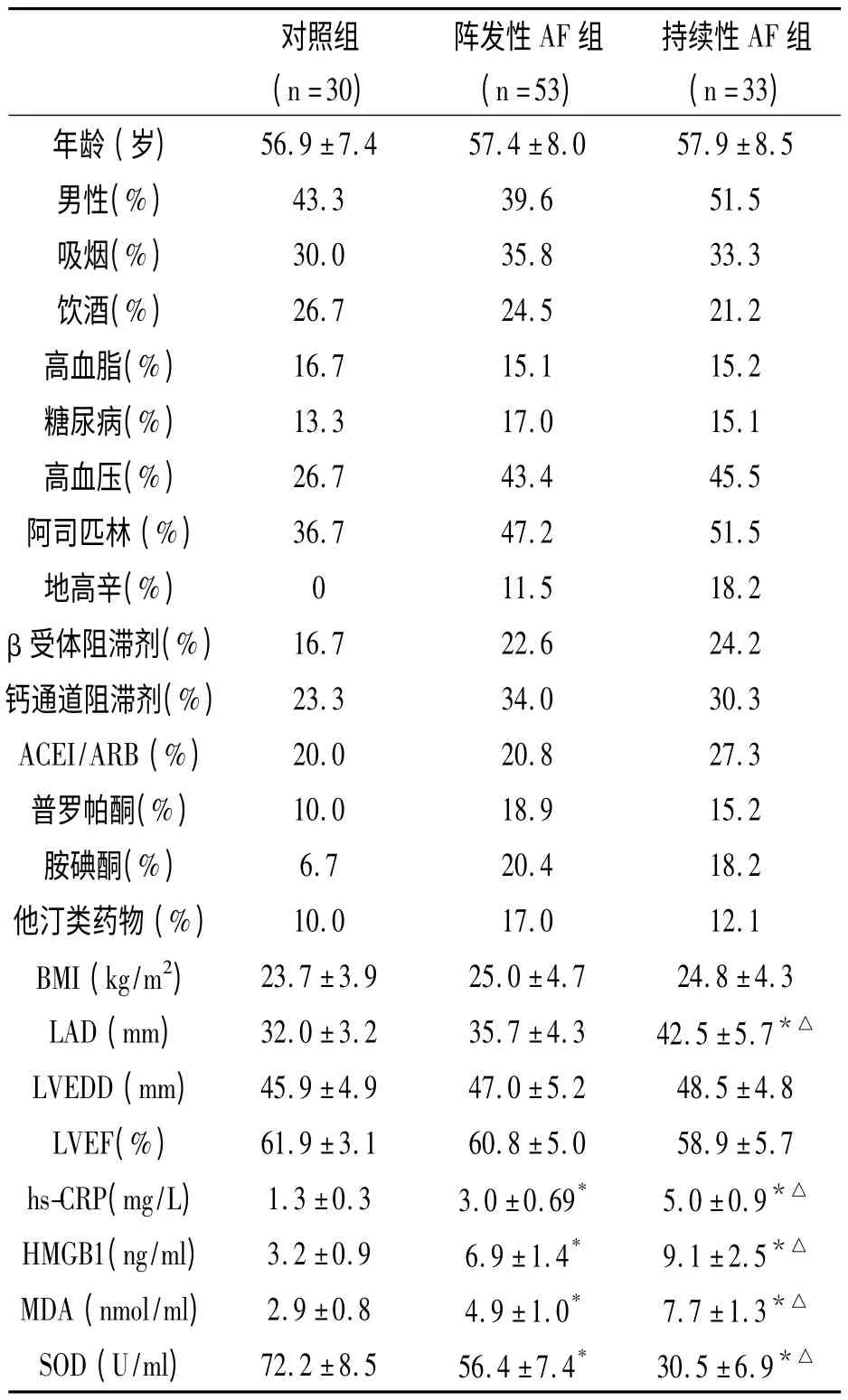
表1 3組一般資料比較
2.2 HMGB1 和其他心血管危險因素之間的相關性
如表2 所示,房顫患者HMGB1 和hs-CRP 間有顯著的正相關(n=86,R=0.507,P <0.05)。丙二醛的水平與HMGB1 的水平正相關(N=86,R=0.535,P <0.05),而SOD 水平與HMGB1 水平呈負相關(N=86,R=-0.491,P <0.05)。
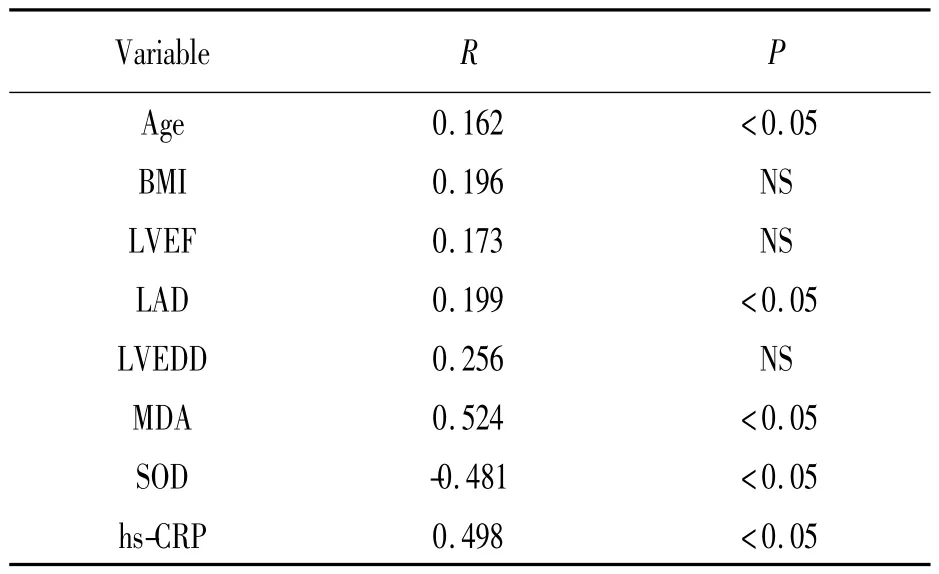
表2 房顫患者心血管危險因素與HMGB1 水平的Pearson 相關
2.3 房顫危險因素的多因素logistic 回歸分析
在這項研究中,我們發現MDA、SOD、血清hs-CRP 和HMGB1 水平分別為AF 的獨立預測因素:MDA:OR=1.705,95%CI(1.308 -2.545);SOD:OR=0.578,95% CI(0.263 -0.996);血清hs-CRP:OR=1.530,95% CI(1.287 -1.951);HMGB1:OR=1.832,95%CI(1.487 -2.454)。
3 討論
本研究中,我們發現陣發和持續房顫患者血清HMGB1 水平有顯著增高。同時,我們發現血清HMGB1 水平和血清中hs-CRP 成正相關,hs-CRP在房顫病人血清中顯著升高,是房顫病人復律成功及維持竇律的重要預測因子[2],這個結果和先前Hu[7]和Zhao[9]等關于房顫病人HMGB1 的表達和hs-CRP 緊密相關的論述一致。這些發現提示HMGB1 和hs-CRP 間有交互作用。HMGB1 由壞死損傷的細胞、凋亡細胞被動釋放或者由激活的非特異性免疫細胞(例如巨噬細胞和單核細胞)主動釋放,上調IL-1、IL-6 和TNF-α 和巨噬細胞炎癥蛋白-1α 和1β,表明這個機制加強了炎癥反應過程[10],這些研究表明HMGB1 在房顫的發生機制中可能是一個重要的促炎因子。因此,房顫病人HMGB1 上調可能和其他炎癥因子所致房顫的病理生理機制有關[2,3]。
越來越多的證據表明氧化應激可能導致心房重塑和心電重構,這在房顫的發生機制中有重要作用[3]。本研究中,房顫病人MDA 含量顯著升高,而SOD 的水平顯著降低,同時,氧化應激可能參與促炎因子HMGB1 的釋放。Tang 等[11]揭示過氧化氫可以刺激巨噬細胞和單核細胞主動釋放HMGB1。本研究中發現MDA 的水平和HMGB1的水平呈正相關,而SOD 的水平和HMGB1 的水平呈負相關。這些結果表明,氧化應激和促炎因子HMGB1 間有交互作用,氧化應激可能會加強炎癥對房顫發生的作用,這點和目前對于房顫發生機制的認識一致[3,11]。
本研究中,血清HMGB1 水平顯著升高,MDA含量與HMGB1 的水平呈正相關,而在陣發性和持續性房顫患者,SOS 的水平與HMGB1 的水平呈負相關。這些結果表明,氧化應激水平增加可能促進AF 患者HMGB1 水平的升高。因此,通過抑制氧化應激可能減少HMGB1 的表達,為AF 提供了一個潛在的治療策略。
[1]Go AS,Hylek EM,Phillips KA,et al.Prevalence of diagnosed atrial fibrillation in adults:national implications for rhythm management and stroke prevention:the anticoagulation and risk factors in atrial fibrillation (ATRIA)study[J].JAMA,2001,285:2370
[2]Watanabe E,Arakawa T,Uchiyama T,et al.High-sensitivity C-reactive protein is predictive of successful cardioversion for atrial fibrillation and maintenance of sinus rhythm after conversion[J].Int J Cardiol,2006,108:346
[3]Tousoulis D,Zisimos K,Antoniades C,et al.Oxidative stress and inflammayory process in patients with atrial fibrillation:the role of left atrium distension[J].Int J Cardiol,2009,136:258
[4]Hu X,Zhou X,He B,et al.Minocycline protects against myocardial ischemia and reperfusion injury by inhibiting high mobility group box 1 protein in rats[J].Eur J Pharmacol,2010,638:84
[5]Giallauria F,Cirillo P,Lucci R,et al.Autonomic dysfunction is associated with high mobility group box-1 levels in patients after acute myocardial infarction[J].Atherosclerosis,2010,208:280
[6]Salman S,Bajwa,Gajic O,et al.Paroxysmal atrial fibrillation in critically ill patients with sepsis[J].J Intensive Care Med,2008,23:178
[7]Hu X,Zhou W,Bai Q,et al.Increased serum high mobility group box 1 protein in patients with atrial fibrillation[J].Biomed Aging Pathol,2011,1:52
[8]Hu X,Wang X,Liu H,et al.High mobility group box 1 protein:possible pathogenic link to atrial fibrillation[J].Chin Med J (Engl),2012,125:2346
[9]Zhao D,Wang Y,Xu Y.Decreased serum endogenous secretory receptor for advanced glycation endproducts and increased cleaved receptor for advanced glycation endproducts levels in patients with atrial fibrillation[J].Int J Cardiol,2012,158:471
[10]Yamada S,Maruyama I.HMGB1,a novel inflammatory cytokine[J].Clin Chim Acta,2007,375:36
[11]Tang D,Shi Y,Kang R,et al.Hydrogen peroxide stimulates macrophages and monocytes to actively release HMGB1[J].J Leukoc Biol,2007,81:741

