青島啤酒酵母和高濃酵母原生質體融合選育高濃釀造菌株
李居寧,易慶平
(荊楚理工學院生物工程學院,湖北 荊門 448000)
青島啤酒酵母和高濃酵母原生質體融合選育高濃釀造菌株
李居寧,易慶平
(荊楚理工學院生物工程學院,湖北 荊門 448000)
以青島啤酒酵母和高濃酵母為供試菌株,通過原生質體融合得到融合子。對融合子利用銅抗性初篩,利用耐壓和發酵性能為指標進行實驗室和100 L發酵復篩,并對融合子進行鑒定及遺傳穩定性實驗。結果表明:通過原生質體融合選育出的高濃菌株與青島啤酒酵母菌株相比,表現出酵母數峰值高、降糖和還原雙乙酰快的優勢,且代謝風味物質組成與青島啤酒酵母接近;經過連續使用8代后,其總染色體DNA指紋圖譜保持一致,證明該菌株的遺傳穩定性高。
原生質體融合;高濃酵母;青島啤酒酵母;選育;高濃釀造
啤酒質量的關鍵是發酵菌種,酵母是啤酒的靈魂[1]。酵母菌種的優化、培育、篩選工作被啤酒生產廠家放在非常重要的位置。選育一株耐高酒精度、耐高糖度、耐高滲透壓、同時分泌良好風味物質的酵母菌是高濃釀造啤酒的核心工作。近年來,國內外許多釀造工作者在啤酒菌株性能及選育方面進行大量研究[2-4]。國外部分研究者利用酵母融合技術選育釀酒菌種,取得了較理想效果[5]。通過原生質體融合得到的菌株具有遺傳親本的許多優良性狀,啤酒酵母原生質體融合菌株在實驗室的研究較多[6-12],工業上的應用鮮有報道[13-14]。在啤酒釀造中菌種代謝產生的酶催化一系列生化反應產生的雙乙酰、乙醛和高級醇等物質會影響啤酒口感及質量。本研究以選育優良的啤酒高濃釀造生產菌株為目的,通過青島啤酒酵母和高濃酵母為親株進行原生質體融合,對融合子進行實驗室復篩和100 L發酵復篩,獲得既能適應高濃釀造、高酒精環境,又能保持青島啤酒基本風味的融合菌株,對滿足工業生產所要求的高濃釀造、提高啤酒產量具有指導意義。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株與培養基
根據青島啤酒公司酵母菌種庫的檔案數據,從中挑選S.cerevisiae屬中的優質的青島啤酒酵母和高濃酵母作為融合親株通過初篩和100 L發酵分析篩選得到4株供試菌:青島啤酒酵母T1(T2318)、青島啤酒酵母T3(T2360)、高濃酵母H4(1300)、高濃酵母H6(1325)。
11°P麥芽汁培養基加蛋清澄清處理后,115℃、20 min濕熱滅菌后使用。銅抗性篩選培養基:YEPD固體培養基融化后冷卻至55~60℃,無菌操作加入一定量滅菌的1 mol/L CuSO4,使培養基中CuSO4的濃度達到實驗要求。
1.1.2 試劑[15]
限制性內切酶Bcl I、EcoRI、Eco RV、Dra I,0.1 mol/L Tris[15]飽和酚、氯仿(分析純) 南京市華美日化工有限公司。
1.1.3 儀器與設備
90-B型PCR儀 中國科學院遺傳研究所;生化培養箱 上海精宏實驗設備有限公司;CHEF-DR Ⅲ脈沖場電泳系統 美國Bio-Rad公司;DYY-5穩壓穩流電泳儀北京六一儀器廠;1100型高效液相色譜分析儀 美國安捷倫公司;1 000 L糖化設備 德國Jacalb Karl公司;100 L啤酒發酵設備 哈爾濱漢德釀造設備有限公司。
1.2 方法
1.2.1 糖化工藝
糖化工藝的設計原則為在遵循青島啤酒的生產工藝基礎上提高原麥汁濃度到150°P,具體配方及工藝如表1所示。
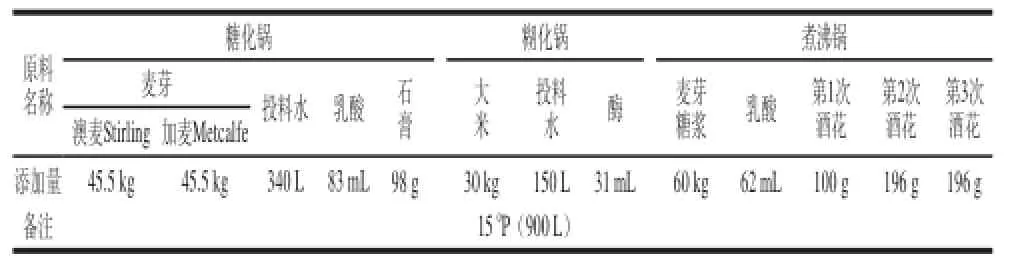
表1 糖化配方Table 1 Formulation of raw materials used in saccharification
糖化工藝曲線如圖1所示。
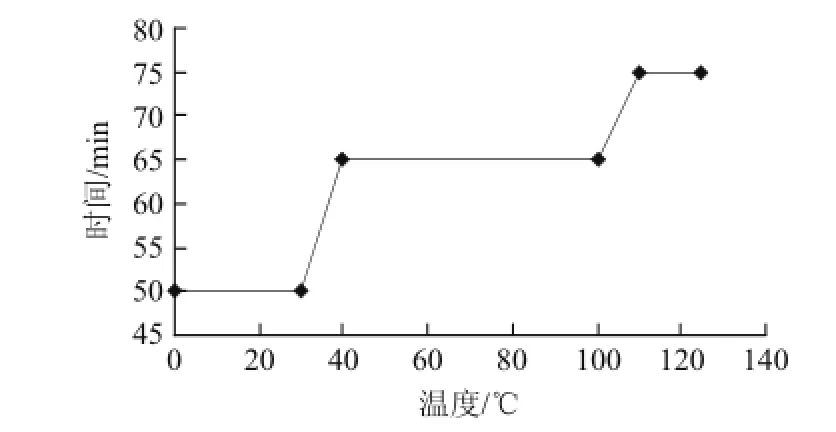
圖1 糖化工藝曲線Fig.1 The curve of saccharification process
1.2.2 酵母擴培[16]
試管斜面5 mL液體麥汁培養基試管(25℃培養24 h)10 mL液體麥汁培養基試管(25℃培養36 h)240 mL液體麥汁培養基三角瓶(20℃培養36 h)2 000 mL液體麥汁培養基三角瓶(18℃培養36 h)2瓶2 000 mL培養液進100 L發酵罐。
1.2.3 發酵工藝
麥汁溫度(8.0±0.5)℃進罐,滿罐后24 h內排渣1次;自然升溫至9.0~9.5℃發酵;當糖度降至4.8~5.2oBx,升溫至12 ℃,還原雙乙酰;當糖度降至3.8~4.2oBx,封罐,保持罐壓0.8~1.0 kg/cm2;封罐24~48 h回收酵母,以后每2 d排1次酵母;雙乙酰降至0.05 mg/L時降溫,溫度降至0 ℃后貯7 d。
1.2.4 原生質體制備及再生[17-18]
制備:取處于對數生長中期的酵母菌液5 mL,3 500 r/min、5 min離心收集菌體,菌體經PB離心機離心洗滌2次,懸浮于2 mL 0.3%β-巰基乙醇-0.1%EDTA-Na2中,于37℃水浴保溫10~15 min,3 500 r/min離心5 min收集菌體,0.18 mol/L KCl溶液洗滌2次,懸浮于1 mL 2%的蝸牛酶液中,37℃恒溫水浴酶解。酶解結束后,4 000 r/min離心10 min去除蝸牛酶液,pH 6.12高滲緩沖溶液洗滌2次,收集原生質體。
再生:雙層平板法,首先在培養皿中鋪一底層含瓊脂2.5%的高滲YEPD再生培養基,放溫箱中烘數小時,使其表面脫水。然后將10 mL預先保溫在40℃、含有0.5%瓊脂并混合了l mL原生質體懸液的YEPD高滲再生培養基倒入至底層平板中制成雙層平板,30℃培養48 h。
原生質體融合方案:T1+H4;T1+H6;T3+H4;T3+H6。
1.2.5 融合子銅離子抗性初篩
將培養出的菌落挑至無菌水中,饑餓,用饑餓后的菌懸液點板,分別將融合子及其親株點至含Cu2+濃度為4、6、8、10 mmol/L的YEPD固體培養基平皿上,點板后倒置培養,比較不同的Cu2+梯度平板上菌落的生長情況。
1.2.6 實驗室水平復篩
將初篩獲得的菌株進行實驗室發酵實驗,每株1瓶,以耐酒精度、耐壓指標、抗自溶能力、發酵力為指標進行篩選,分別篩選出耐酒精度≥9%的融合子、蛋白酶活力≤0.25U/mg、起發快、還原雙乙酰快、CO2減重多的融合子。
1.2.7 100 L發酵復篩
糖化生產15oP麥汁,將1.2.7節篩選出來的融合子與青島啤酒酵母菌株接入100 L發酵罐發酵,連續15 d,每天稀釋菌液在YEPD固體培養基培養后測定酵母菌數量、雙乙酰質量濃度[19],發酵完成后測定發酵度[20]、菲林試劑測糖度[21]、pH值、酵母凝聚性[19]、α-N同化率[21]、可發酵性殘糖[22]和風味物質[23]分析。
1.2.8 限制性片段長度多態性(restriction fregrmeat length polymorphisms,RFLP)實驗
分別用4種酶包括Bcl I、EcoRI、Eco RV、Dra I對不同的酵母菌株總DNA進行酶切分析。供試酵母菌株的總DNA提取方法參照文獻[24]。Bcl I酶切體系(5 μL):0.5 μL Buffer E+0.5 μL BSA+0.2 μL Bcl I+2 μL DNA+1.8 μL dH2O,37 ℃條件下處理10~16 h;EcoRI酶切體系(5 μL):0.5 μL Buffer H+0.5 μL BSA+0.2 μL EcoRI+2 μL DNA+1.8 μL dH2O,37 ℃條件下處理10~16 h;Eco RV酶切體系(5 μL):0.5 μL BufferH+0.5 μL BSA+0.2 μL Eco RV+2 μL DNA+1.8 μL dH2O,37 ℃條件下處理10~16 h;37 ℃條件下處理10~16 h;Dra I酶切體系(5 μL):0.5 μL Buffer T+0.5 μL BSA+0.2 μL Dra I+2 μL DNA+1.8 μL dH2O,37 ℃條件下處理10~16 h。
1.2.9 遺傳穩定性實驗
在生產廠連續使用8代篩選獲得的融合子,回收后貯存于-80℃,同時采用CHEF電泳技術[25]對高濃酵母菌株的總染色體結構進行分析。
2 結果與分析
2.1 融合子的篩選
酵母原生質體融合獲得的融合子,其重組率相對較高,根據前期確定的銅抗性篩選標記,首先對融合子進行初步篩選,挑選出200支融合子。雖然原生質體融合具有定向育種的含義,但是融合子的性能不同的情況依然存在,只是性狀變化的范圍有所限制,所以要根據需要,對融合子作進一步的定向篩選。
2.1.1 銅抗性標記初篩
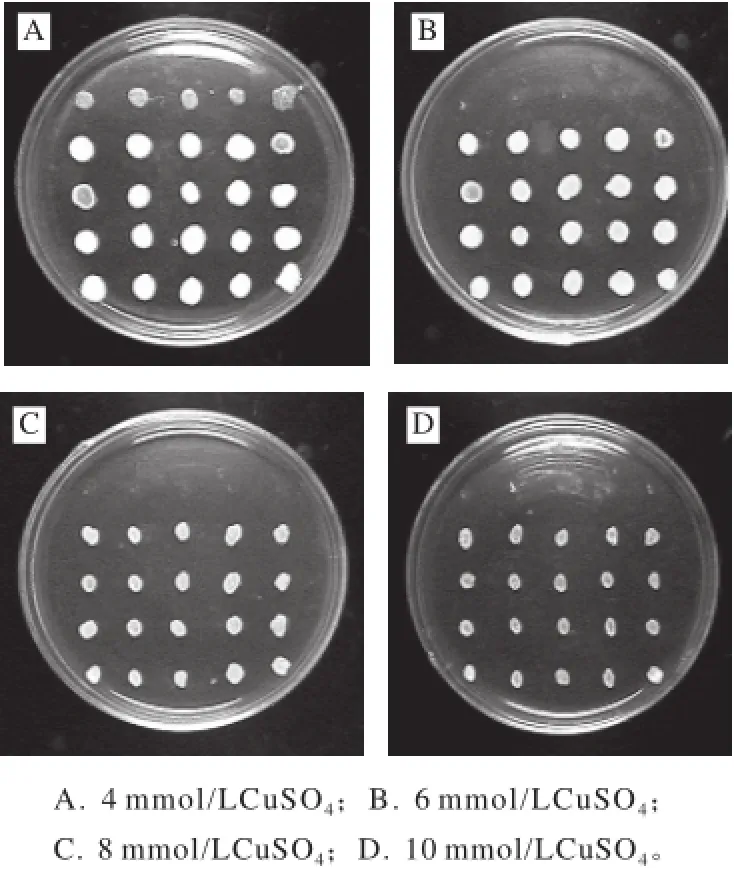
圖2 融合子菌株銅抗性篩選Fig.2 Copper resistance of the parental strains and their fusants
將培養出的菌落挑至無菌水中,饑餓,用饑餓后的菌懸液點板,分別將融合子及其親株點至含Cu2+濃度為4、6、8、10 mmol/L的YEPD固體培養基平皿上,點板后倒置培養,觀察結果如圖2所示。每個平皿中最上方5個菌落為融合親株,后面的20個菌落為融合子。結果說明在4 mmol/L CuSO4的YEPD培養基中融合親株還能生長,而在高于4 mmol/L CuSO4的YEPD培養基中融合親株不能生長,而融合子生長良好。比較不同的Cu2+梯度平板上菌落的生長情況,將在較高Cu2+濃度平板上長出的融合子200支接斜面,4 ℃保存。
2.1.2 實驗室水平復篩
利用耐壓指標和發酵性能作為篩選標記,逐步篩選優良高濃酵母,通過耐酒精度為指標篩選81支耐酒精度≥9%的融合子;以抗自溶能力為指標篩選出蛋白酶活性≤0.25 U/mg的融合子43支;以發酵力為指標,選擇啟發快、雙乙酰還原快、CO2減重多的融合子共2支(融合子1、融合子2)。
2.2 100 L發酵復篩
2.2.1 酵母數變化
啤酒發酵是依賴于啤酒酵母,對麥汁某些組分進行一系列的代謝過程,產生酒精等各種風味物質構成獨特風味的飲料,整個發酵籠統地可分3個階段:酵母恢復階段,有氧呼吸階段,無氧發酵階段。融合子2在酵母接種后,開始在麥汁充氧的條件下,恢復其生理活性;然后以麥汁中的氨基酸為主要氮源和以可發酵性糖為主要碳源,進行呼吸作用,并從中獲得能量而生長繁殖,在5 d內就達到酵母數最大值[26];之后即進入無氧發酵階段。而青島啤酒酵母和融合子1分別在12 d和10 d才達到酵母數最大值,無氧發酵階段很短。融合子2酵母峰值明顯高于其他菌株。
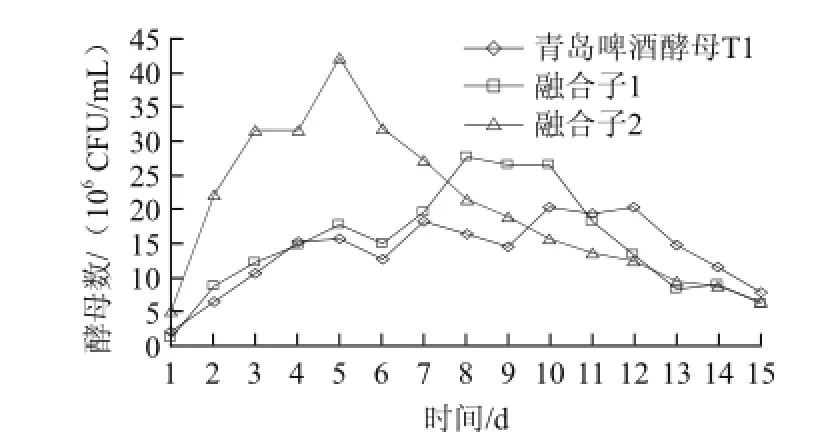
圖3 融合子100 L發酵實驗酵母數變化Fig.3 The growth curves of the original strain T1 and two fusants during cultivation in a 100 L fermenter
2.2.2 糖度變化
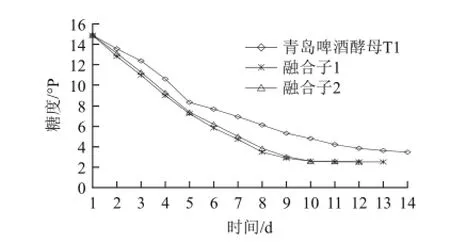
圖4 融合子復篩100 L發酵實驗糖度變化Fig.4 Time-dependent changes in wort concentration during cultivation of the original strain T1 and two fusants in a 100 L fermenter
融合子發酵過程中糖度變化見圖4所示。融合子1和融合子2發酵液的糖度降低比青島啤酒酵母T1多,說明融合子1和融合子2利用的可發酵糖比青島啤酒酵母T1多,融合子1、融合子2降糖能力明顯強于普通青島啤酒菌株。
2.2.3 雙乙酰變化
如圖5所示,融合子2發酵液中雙乙酰的質量濃度在發酵過程的12 d就達到要求≤0.1 mg/L,而融合子1發酵液中雙乙酰的質量濃度在發酵過程的14 d達到要求,青島啤酒酵母發酵液中雙乙酰的質量濃度在發酵過程的15 d還沒有達到要求,仍在0.3 mg/L。融合子2、融合子1雙乙酰峰值低于普通青島啤酒酵母菌株,而還原速度明顯快于普通青島啤酒菌株,特別是融合子2表現更為突出。
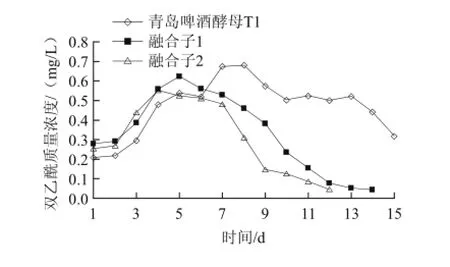
圖5 融合子復篩100 L發酵實驗雙乙酰變化跟蹤Fig.5 Time-dependent changes in diacetyl concentration during cultivation of the original strain T1 and two fusants in a 100 L fermenter
2.2.4 發酵液其他指標
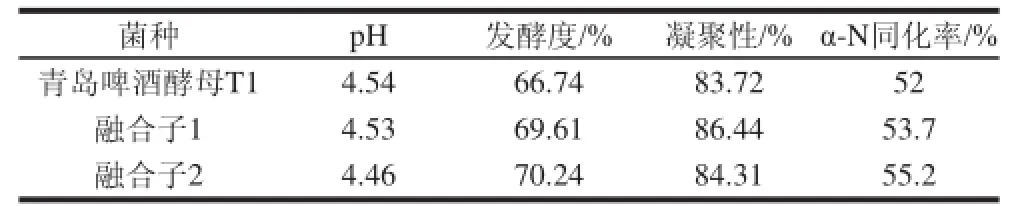
表2 融合子菌株發酵實驗發酵液分析Table 2 Analysis of the fermentation broths of the original strain T1 and two fusants
由表2可知,各種指標中,3種菌株均達到啤酒要求,而融合子2的pH值、發酵度、α-N同化率3種指標要優于其他兩種菌株,其凝聚性高于青島啤酒酵母T1,低于融合子1。不同啤酒酵母菌株凝集性差異很大。強凝集性酵母,從發酵液中分離早、沉淀快,因而酒液中酵母數量少、發酵慢、發酵度低;弱凝集性酵母,與發酵液分離晚,酒液中酵母細胞密度大、發酵快、發酵度高、回收酵母量少,濾酒困難。因此在選擇菌種時,要求酵母的凝聚性適中,既能達到較高的發酵度,又沉淀結實、容易分離的菌株。綜合以上因素,融合子2的pH值、發酵度、α-N同化率、凝集性4種指標要優于其他兩種菌。
2.2.5 可發酵性殘糖分析
由表3可知,3種菌株對果糖、葡萄糖和蔗糖的利用率都很高,在發酵液中都沒有檢測到3種糖,青島啤酒酵母對麥芽糖的利用率好于融合子,而融合子2對麥芽三糖的利用率好于其他2種酵母菌株。

表3 融合子菌株發酵實驗發酵液可發酵性糖殘留分析Table 3 Analysis of fermentable sugar residues in the fermentation broths of the original strain T1 and two fusants
2.2.6 風味物質組成
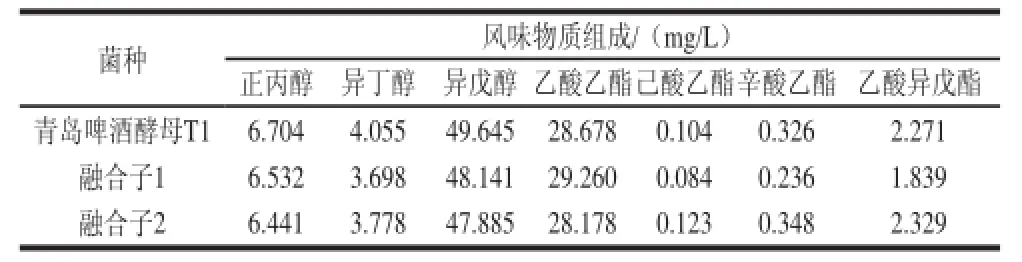
表4 發酵液風味物質分析Table 4 Flavor components of the fermentation broths of the original strain T1 and two fusants
由表4可知,3種菌株的風味物質組成沒有明顯區別。綜合以上實驗數據可以看出,融合子1和融合子2(都是T1+H6的融合方式)與青島啤酒酵母T1相比,都表現出酵母數峰值高、降糖和還原雙乙酰快的優勢,且代謝風味物質組成與青島啤酒酵母T1非常接近。其中融合子2的優勢更突出,最終選擇融合子2作為青島啤酒高濃酵母。
2.3 融合子的鑒定
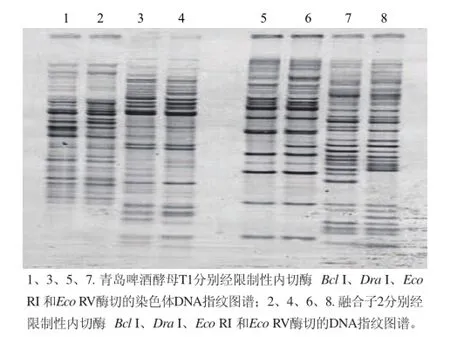
圖6 青島啤酒酵母與融合子2染色體DNA指紋圖譜比較Fig.6 Comparison of chromosomal DNA fingerprint between Tsingtao brewer’s yeast and fusant 2
銅抗性的初篩和耐壓指標、發酵性能的復篩,也可以看作是對融合子的鑒定,但只限于外觀表型的鑒定,還需要從酵母細胞的染色體DNA水平對融合子進行了遺傳本質的鑒定。利用RFLP技術分別對青島啤酒酵母T1和融合子2做染色體DNA指紋圖譜鑒定,電泳條帶如圖6所示。利用Eco RI 和Eco RV酶切的DNA指紋圖譜顯示融合子2與青島啤酒酵母T1的16S rDNA的序列存在差異,融合子2的DNA-DNA雜交的同源性在90%以上,說明兩株酵母的DNA存在不同,但親緣關系很近。
2.4 高濃釀造酵母的遺傳穩定性
由于原生質體的融合會產生兩種情況,一種是真正的融合,即產生雜合雙倍體,或單倍重組體;另一種是暫時的融合,形成異核體。前者一般是較穩定的,而后者則是不穩定的,會分離成親本類型,有的甚至可以異核狀態移接幾代[27]。在生產廠連續使用8代高濃酵母融合子2,回收后貯存于冰箱中,同時采用CHEF電泳技術對高濃酵母菌株的總染色體結構進行分析,總染色體DNA指紋圖譜如圖7所示。高濃酵母經過連續使用8代后,其總染色體DNA指紋圖譜基本保持一致,證明該菌株的遺傳穩定性較高。
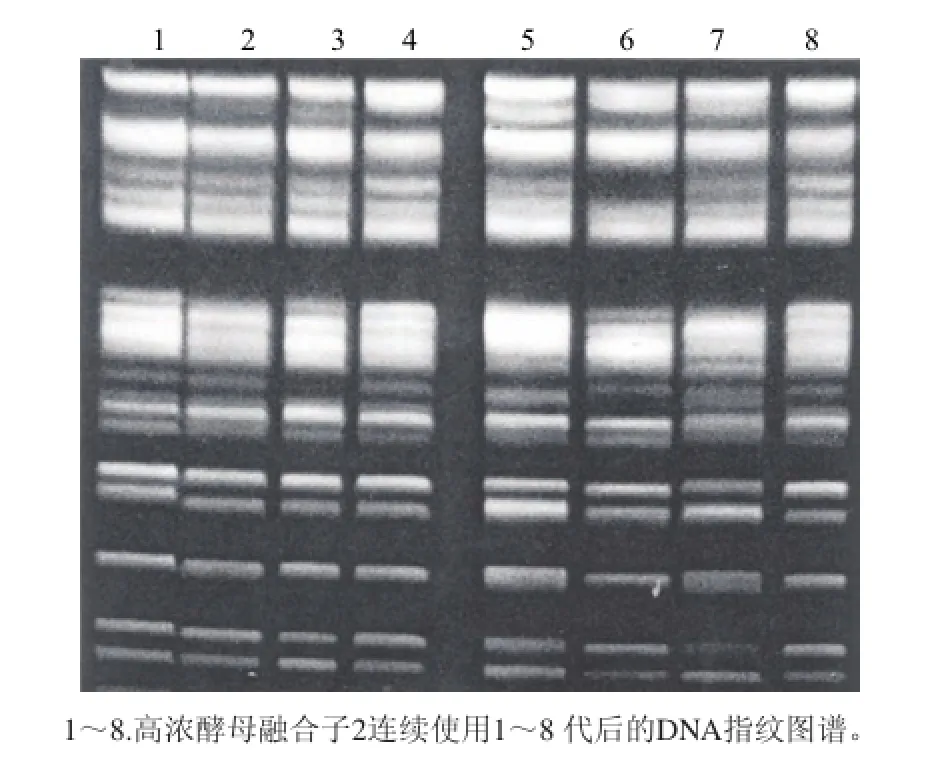
圖7 高濃酵母融合子2連續使用8代指紋圖譜Fig.7 The fingerprints of funsant 2 during 8 successive passages
3 結 論
應用酵母融合技術選育既適應高濃、高酒精環境,又能保持青島啤酒基本風味的菌株對滿足高濃釀造、提高啤酒產量意義重大。從本實驗結果可以看出,培育出的高濃菌種雜合子與青島啤酒酵母菌株相比,都表現出酵母數峰值高、降糖和還原雙乙酰快的優勢,且代謝風味物質組成與青島啤酒酵母非常接近,達到預期目標。雜合子2經過連續使用8代后,其總染色體DNA指紋圖譜保持基本一致,證明該菌株的遺傳穩定性高。
[1] 梅叢笑, 方元超, 王福榮. 啤酒酵母的改良途徑[J]. 食品工業科技, 2000, 21(3): 70-73.
[2] DUTTON I. Corn syrup brewing adjuncts-their manufacture and use[J]. Technical Quarterly-Master Brewers Association of the Americas, 1996, 33(1): 47-53.
[3] PIERPOINT D J. Glouse syrups and specialty syrups for beer brewing[J]. Drink Technology Market, 1998, 2(3): 11-12.
[4] PIERPONT D. Glucose syrups, dextrose and speciality adjuncts for beer brewing[J]. Biotechnology, 1998, 23(4): 28-35.
[5] VENTURINI F, CEREDA W G. Cassava starch hydrolysate as an adjunct in beer production: chemical and sensory evaluation[J]. Ciencia Technologia Aliment,1998, 18(2): 156-161.
[6] JAVADEKAR V S, SIVARAMAN H, GOKHALE D V. Industrial yeast strain improvement: construction of a highly floccu-lent yeast with a killer character by protoplast fusion[J]. Industrial Microbiology, 1995, 15: 94-102.
[7] 鄧紅梅. 利用原生質體融合提高釀酒酵母賴氨酸含量的研究[J]. 貴州大學學報: 自然科學版, 2002, 19(3): 227-231.
[8] 孫君社, 李雪, 李軍席. 原生質體融合構建耐高溫酵母菌株[J]. 食品與發酵工業, 2002, 28(5): 1-5.
[9] 蔡車國, 劉月英, 戴玉聰, 等. 用原生質體融合法優化啤酒酵母的凝絮性和發酵性能[J]. 廈門大學學報: 自然科學版, 2006, 45(1): 110-113.
[10] 王芬, 由媛, 全麗, 等. 雙親滅活的原生質體融合株啤酒酵母DR9-2的構建及其特性的研究[J]. 釀酒, 2007(5): 72-75.
[11] 蔡車國, 劉月英, 戴玉聰, 等. 啤酒酵母融合株GR8發酵特性的初步研究[J]. 釀酒, 2005, 32(4): 60-61.
[12] 戴玉聰. 啤酒釀造酵母原生質體融合株GR5的中試[J]. 釀酒, 2005 (2): 51-53.
[13] 全麗. 啤酒酵母原生質體融合株GR8的中試研究[J]. 釀酒科技, 2005 (8): 69-73.
[14] 劉月英, 王芬, 由媛, 等. 啤酒酵母原生質體融合株HN31-6的啤酒釀造中試研究[J]. 廈門大學學報: 自然科學版, 2006, 45(6): 855-858.
[15] 范秀英. 富硒及高谷胱甘肽酵母菌選育的研究[D]. 天津: 天津科技大學, 2004.
[16] 劉杰璞. 啤酒新產品的開發及風味研究[D]. 北京: 北京化工大學, 2006.
[17] 陳海昌, 唐屹, 張嶺花, 等. 原生質體融合技術提高啤酒酵母凝絮性的研究[J]. 微生物學通報, 1994, 24(4): 213-217.
[18] BALASUBRANMANIAN N, ANNIEJUIET G, SRIKALAVANI P, et al. Release and regeneration of protoplasts from the fungus Triehotheeium roseum[J]. Canadian Journal of Microbiology, 2003, 49(4): 263-268.
[19] 母茜. 高SOD、低雙乙酞啤酒酵母工程菌的構建[D]. 雅安: 四川農業大學, 2008.
[20] GUAN Dunyi. Handbook of brewing industry[M]. Beijing: Ligt Industry Press, 1982: 467-470.
[21] 中國食品發酵工業研究院. 啤酒工業國家標準與分析技術手冊[M]. 北京: 中國食品工業出版社, 2001.
[22] 李斌, 徐智斌, 馮波, 等. 糯小麥與普通小麥糖化過程的比較[J]. 中國農業科學, 2011, 44(13): 2760-2767.
[23] 王家林, 薛長湖, 付雪艷, 等. 啤酒風味物質及游離脂肪酸的氣相色譜研究[J]. 分析化學, 2006(6): 875-878.
[24] 蔡勇. 低乙醇脫氫酶II活性的抗老化啤酒酵母工程菌的構建[D]. 雅安: 四川農業大學, 2008 .
[25] 邊銀丙, 翁曼麗, 羅信昌, 等. 釀酒酵母染色體DNA樣品制備和CHEF分析[J]. 菌物系統, 1999, 18(3): 284-287.
[26] 寇鳳蓮. 大容積發酵罐啤酒醇酯比的控制研究[D]. 無錫: 江南大學, 2008.
[27] 程彬彬. 微生物絮凝劑及細胞融合技術處理印染廢水的研究[D]. 南昌: 南昌大學, 2008.
Strain Improvement through Protoplast Fusion between Tsingdao Brewer’s Yeast and High-Gravity Yeast
LI Ju-ning, YI Qing-ping
(College of Biological Engineering, Jingchu University of Technology, Jingmen 448000, China)
In this study, protoplast fusants between Tsingdao brewer’s yeast and high-gravity yeast were developed and preliminarily screened for their copper resistance. On the basis of this investigation, secondary screening was carried out on a laboratory scale or in a 100 L fermentor with respect to pressure tolerance and fermentation performance. The results showed that the selected fusant strain was superior to Tsingdao brewer’s yeast, as manifested by higher alcohol peaks as well as faster sugar consumption and diacetyl reduction. Moreover, both yeast strains presented similar fl avor compounds profi le during metabolism. The total chromosomal DNA fi ngerprinting of the fusant strain after 8 successive passages remained consistent, suggesting high genetic stability.
protoplast fusion; high-gravity yeast; Tsingdao brewer’s yeast; breeding; high-gravity brewing
TS261.1
A
1002-6630(2014)03-0173-05
10.7506/spkx1002-6630-201403035
2013-02-01
李居寧(1969—),女,講師,碩士,研究方向為現代生物技術發酵、檢測。E-mail:lijuning613@163.com

